Spodziectwo
| hypospadiasis | |
 | |
| ICD-10 | |
|---|---|
| Q54.0 | Spodziectwo żołędne |
| Q54.1 | Spodziectwo prąciowe |
| Q54.2 | Spodziectwo prąciowo-mosznowe |
| Q54.3 | Spodziectwo kroczowe |
| Q54.4 | Wrodzona strunowatość prącia |
| Q54.8 | Spodziectwo, inne |
| Q54.9 | Spodziectwo, nie określone |
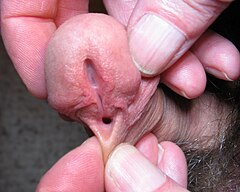
Spodziectwo (łac. hypospadiasis, hypospadia, z gr. ηυπο = na dole + σπαδōν = rozcięcie, szczelina[1], ang. hypospadias) – wada wrodzona polegająca na lokalizacji ujścia cewki moczowej na brzusznej stronie prącia. W szerszym i nowocześniejszym ujęciu definiowane jest jako hipoplazja brzusznej części prącia, w kierunku dalszym (dystalnie) od miejsca podziału ciała gąbczastego[2]. W zależności od stopnia ciężkości wady spodziectwo może stanowić niewielki defekt kosmetyczny lub cięższy, utrudniający oddawanie moczu, przyczyniający się do dysfunkcji seksualnej i stanowiący poważny problem psychologiczny.
Historia
Pierwszym, który użył określenia hypospadia, był Galen w II wieku n.e. Galenowi nie było obce znaczenie struny prącia (chorda), nierzadko uniemożliwiającej pacjentom spłodzenie potomstwa. Klasyczne prace o spodziectwie pozostawili francuscy chirurdzy Ambrose Paré i Pierre Dionis.
Jeden z pierwszych opisów chirurgicznego leczenia wady pochodzi z I wieku n.e. Heliodor Antyl przeprowadził wówczas zabieg amputacji dalszej (dystalnej) części prącia. Tę sama metodę stosował Paweł z Eginy (625–690)[3]. Metoda pozostawała w użyciu przez blisko dziesięć wieków; jedyne wyjątki to wzmianki o odmiennych zabiegach w dziele Galena i w Talmudzie. Następnym etapem w historii leczenia spodziectwa było wprowadzenie tunelowania i kaniulacji prącia. Abulcasis (936–1013) i Şerafeddin Sabuncuoğlu używali w tym celu ołowianych rurek, Guy de Chauliac srebrnych, sir Astley Cooper w 1815 roku użył gumowego elastycznego cewnika, podobnie jak Dupuytren i Mettauer w 1842[4]. Początki współczesnej chirurgii spodziectwa datują się na XIX wiek; za najistotniejsze uważa się prace Mettauera, Duplaya[5], Lauensteina, Edmundsa[6], Blaira i Byersa[7].
Epidemiologia
Występowanie wady szacuje się na 1:250–1:300 żywych urodzeń noworodków płci męskiej. Stwierdzono większe ryzyko spodziectwa u dzieci, w których rodzinach występowało ono już wcześniej (szacowana częstość 1:80–1:100)[8]. W ostatnich latach stwierdza się w Europie i w USA coraz częstsze występowanie tej wady: w latach 1970–1980 częstość wzrosła dwukrotnie[8]. Przyczyny tego zjawiska pozostają niewyjaśnione.
W starszym piśmiennictwie można znaleźć informacje o częstszym występowaniu wady u przedstawicieli rasy czarnej i u ludzi pochodzenia żydowskiego[9]. Obecnie uważa się, że częstość wady jest zbliżona we wszystkich populacjach, a opisywane różnice wynikały z błędów w metodologii badawczej[10].
Etiologia
W wystąpieniu wady postuluje się udział czynników genetycznych, endokrynnych i środowiskowych[11][12]. Udziału czynników genetycznych dowodzi rodzinne występowanie wady, podczas gdy do przypuszczalnych czynników środowiskowych należą estrogeny lub fitoestrogeny w roślinach spożywczych (np. soi), niektórych grzybach i substancje chemiczne, takie jak DDT i Vinclozolin (antyandrogen). W badaniu opublikowanym na łamach Lancet w 2002 roku dowodzono 20-krotnego wzrostu ryzyka spodziectwa u dzieci matek przyjmujących w ciąży dietylstilbestrol[13], ale późniejsze prace sugerowały mniej wyraźny związek[14]. Stwierdzono związek między występowaniem spodziectwa u dziecka a przestrzeganiem przez matki diety wegetariańskiej w pierwszych dwóch trymestrach ciąży, suplementacją żelaza w ciąży oraz przebyciem przez ciężarną grypy w pierwszym trymestrze[15]. Większe ryzyko spodziectwa dotyczy dzieci matek bardzo młodych i starszych[2]; niewydolnością łożyska tłumaczy się częstsze spotykanie spodziectwa w grupie dzieci o niskiej masie urodzeniowej[16] oraz bliźniąt[17][18]. Jako inne, rzadkie przyczyny wymienia się niedobór nabłonkowego czynnika wzrostu (EGF)[19], receptorów dla EGF, zaburzenia biosyntezy testosteronu[20] i defekt enzymatyczny 5α-reduktazy[21].
Patogeneza
Przyczyną spodziectwa jest zaburzenie przebiegu procesu zlewania się brzegów fałdów moczowo-płciowych (plicae urogenitale) i wytworzenia cewki prącia, polegające na zaburzeniu zamknięcia płytki cewkowej i (lub) rekanalizacji sznura endodermalnego w obrębie żołędzi prącia. Jeśli wyniosłości płciowe boczne (wyniosłości wargowo-mosznowe, tori genitales) nie połączą się (co ma prawidłowo miejsce w 10. tygodniu ciąży), dochodzi do rozszczepu moszny, a ujście cewki znajduje się między dwiema częściami rozszczepionej moszny (spodziectwo mosznowe). Gdy ujście zewnętrzne cewki znajduje się w pobliżu odbytu, narządy płciowe zazwyczaj są niewykształcone i mają postać tzw. pochwy rzekomej (pseudovagina). Do utworzenia żołędziowej części cewki dochodzi w 4. miesiącu życia, kiedy endodermalny sznur komórkowy ulega udrożnieniu i łączy się z końcem endodermalnej gąbczastej części cewki moczowej; zaburzenie tego procesu jest przyczyną przednich postaci wady.
Obraz kliniczny
W spodziectwie ujście zewnętrzne cewki moczowej znajduje się na dolnej powierzchni prącia. Najczęściej wada jest niewielka, i ma postać ujścia cewki na brzusznej stronie żołędzi. W cięższych przypadkach ujście cewki jest bardziej oddalone od szczytu prącia, a wadzie towarzyszy zazwyczaj rozszczep i hipoplazja dolnej części napletka oraz skóry prącia z jej przerostem po stronie grzbietowej, brzuszne przygięcie prącia i jego skrócenie wskutek częściowej agenezji ciała gąbczastego; spodziectwo jest więc w istocie zespołem nieprawidłowości budowy anatomicznej brzusznej strony prącia. Niekiedy ujście cewki jest zlokalizowane prawidłowo, a prącie jest przygięte brzusznie i towarzyszy mu częściowa agenezja ciała gąbczastego; sytuację taką określa się jako „spodziectwo bez spodziectwa”.
Brzuszne przygięcie prącia występuje u około 25–30% dzieci ze spodziectwem i towarzyszy przede wszystkim cięższym postaciom wady. Przyczyną jest nieprawidłowo rozwinięta skóra prącia po brzusznej stronie i zrosty z warstwami głębiej położonymi[22], zrośnięcie płytki cewkowej z brzuszną stroną osłonki białawej ciał jamistych, wachlarzowato rozpostarte hipoplastyczne ciało gąbczaste między ektopicznym ujściem cewki a żołędzią lub (w około 5%) hipoplazja brzusznej części ciał jamistych[23]. Zwyrodniałe ciało gąbczaste określa się mianem struny (chorda).
Nieprawidłowo wykształcona cewka moczowa w dystalnym odcinku nie przebiega w obrębie ciała gąbczastego, a obwodowy odcinek jest najczęściej hipoplastyczny. Od przemieszczonego ujścia zewnętrznego cewki do szczytu żołędzi przebiega różnej długości odcinek otwartej cewki z przetrwałą płytką cewkową w dnie. Wadzie zawsze towarzyszy brak tętnicy wędzidełkowej. Nieprawidłowo wykształcone ciało gąbczaste może być rozszczepione, a jego zarysy uwidaczniają się pod skórą bocznie od płytki cewkowej. Powięź Bucka i powięź kurczliwa często są przemieszczone na boki. Rzadką nieprawidłowością jest asymetria ciał jamistych prącia.
W przypadkach spodziectwa tylnego z niebadalnymi jądrami zaleca się diagnostykę w kierunku obojnactwa: oznaczenie kariotypu i badanie endoskopowe cewki moczowej.
Wady towarzyszące
Do najczęstszych wad wrodzonych towarzyszących spodziectwu należą wnętrostwo i przepuklina pachwinowa skośna. Ich częstość jest większa u pacjentów z postacią tylną wady i szacowana jest na 9,3–32%[24]. Często rozpoznaje się również przetrwały uchyłek łagiewki sterczowej określany czasem jako pochwa męska, rzadki u pacjentów z typem przednim wady, spotykany za to w 40% przypadków u pacjentów z mosznowo-kroczową i kroczową postacią wady[25]. Dokładnej diagnostyki w kierunku innych wad układu moczowego wymagają dzieci z widocznymi wadami innych układów, mogącymi tworzyć rozpoznawalne zespoły wad[24].
Spodziectwo żeńskie
Niektórzy autorzy wyróżniają spodziectwo żeńskie, polegające na przemieszczeniu ujścia zewnętrznego cewki do tyłu względem prawidłowego położenia[26]. Niekiedy wada ta może mieć postać ujścia cewki na przedniej ścianie pochwy.
Klasyfikacja
Stosowane podziały według różnych autorów są stosunkowo podobne. Poniżej znajduje się ich zestawienie:
| Smith 1928 | Browne 1938 | Schaefer 1950 | Avellan 1975 | Duckett 1996 | Hadidi 2004 | |
|---|---|---|---|---|---|---|
 | ||||||
Leczenie
Operacje naprawcze spodziectwa mogą być jedno- lub wieloetapowe, i zwykle składają się na nie:
- Wyprostowanie prącia
- Rekonstrukcja cewki moczowej
- Plastyka żołędzi
- Rekonstrukcja warstw brzusznej strony prącia
- Rekonstrukcja napletka.
Wskazania do leczenia operacyjnego
Konieczność zabiegu operacyjnego w przypadku niewielkich wad, w których ujście cewki znajduje się dystalnie do rowka zażołędnego i napletek jest wykształcony prawidłowo, budzi kontrowersje. Strumień moczu zazwyczaj jest w tych wadach skierowany prawidłowo. Przeważa pogląd, że jest to niewielki defekt kosmetyczny niewymagający zabiegu operacyjnego[27].
Czas wykonania zabiegu
Przed 1980 rokiem operacja naprawcza spodziectwa była wykonywana u dzieci starszych niż 3 lata, z powodu większych rozmiarów prącia ułatwiających zabieg. Takie odroczenie zabiegu sprawiało jednak, że często występowały problemy natury psychologicznej (zaburzenia zachowania, poczucie winy, zaburzona identyfikacja seksualna). Już w 1975 roku Amerykańska Akademia Pediatryczna zaleciła przeprowadzanie operacji przed ukończeniem 3. roku życia[28]. Obecnie uważa się wiek 6–24 miesięcy za najdogodniejszy do przeprowadzenia chirurgicznej korekty wady[2].
Techniki operacyjne służące wyprostowaniu prącia
W przypadku nieprawidłowego rozwoju skóry prącia po stronie brzusznej i obecności zrostów, technika operacyjnego wyprostowania prącia polega na przecięciu skóry od podstawy żołędzi bocznie od płytki cewkowej okalającym przemieszczone ujście cewki. Głębokie preparowanie powinno przeciąć boczne słupy hipoplastycznej tkanki gąbczastej i sięgać do osłonki białawej ciał jamistych. W przypadkach gdy nie daje to pożądanego rezultatu, chirurg odpreparowuje płytkę cewkową od ciał jamistych do wysokości prawidłowego odcinka cewki, otoczonego przez ciało gąbczaste. Bocznie od niej uwolniona zostaje od osłonki białawej ciał jamistych powięź kurczliwa, powięź Bucka i skóra. Zwyrodniałe ciało gąbczaste mające postać struny (chorda) jest usuwane. Jeśli postępowanie to nie jest skuteczne, wskazuje to na prawdopodobnie inną przyczynę przygięcia prącia: zbyt krótką płytkę cewkową lub hipoplazję brzusznej części osłonki białawej ciał jamistych. Zbyt krótką płytkę cewkową należy odciąć w odcinku zażołędnym i przesunąć w kierunku proksymalnym; drugą przyczynę niweluje się przez grzbietowe sfałdowanie i skrócenie osłonki (plikację grzbietową osłonki)[29]. Zaleca się w każdym przypadku sprawdzenie skuteczności zabiegu przez wywołanie sztucznej erekcji prącia[27][30].
Techniki operacyjne rekonstrukcji cewki moczowej
Wybór techniki zależy przede wszystkim od postaci wady, niekiedy od innych czynników (np. wybór techniki oszczędzającej napletek lub połączonej z obrzezaniem). Techniki jednoetapowe są popularniejsze od dwuetapowych[27]. Techniki dwuetapowe znajdują zastosowanie przede wszystkim w leczeniu spodziectw proksymalnych[31][32], a także postaci złożonych i wymagających reoperacji[27].
- Plastyka sposobem MAGPI (meatal advancement and glanduloplasty incorporated)
Metoda znajduje zastosowanie w przypadkach spodziectwa przedniego, gdy przy ujściu cewki stwierdza się grobelkę kierującą odpływ moczu w dół. W technice tej po wykonaniu denudacji prącia (odpreparowaniu skóry wraz z powięzią Bucka poniżej poziomu ektopicznego ujścia cewki) przemieszcza się ujście cewki ku górze i przeprowadza plastykę żołędzi (glanduloplastykę)[33].
- Metoda Thierscha i Duplaya
Metoda stosowana w przypadkach dystalnego spodziectwa, przy dostatecznie szerokim rowku cewkowym. Polega na okrojeniu rowka z następczą rulonizacją i zagłębieniem w obręb żołędzi. Może znaleźć także zastosowanie w leczeniu spodziectwa środkowego, pod warunkiem zachowania płytki cewkowej[5][34].
- Zmodyfikowana technika Ransleya (technika Yelsnar)
Rozwiązanie to polega na oswobodzeniu płytki cewkowej od podłoża i dalszym postępowaniu jak w technice Duplaya i Thierscha. Analogiczna metoda operacji wierzchniactwa została pierwotnie opisana przez Ransleya[35], stąd nazwa zabiegu (Yelsnar jest anagramem nazwiska tego chirurga).
- Metoda Snodgrassa
Ideą techniki Snodgrassa jest nacięcie zbyt wąskiej płytki cewkowej w linii środkowej, i zszycie jej po stronie brzusznej z pozostawieniem niezszytej strony grzbietowej. Ubytek w zamyśle ma ulec epitelializacji[36].
- Metoda Mathieu (flip-flap procedure, meatal based flap)
W metodzie tej przypadki spodziectwa przedniego ze zbyt wąską płytką cewkową leczone są w sposób następujący: po brzusznej stronie prącia wytwarzany jest płat skórny uszypułowany u podstawy przemieszczonego ujścia cewki, następnie wykonywane jest nacięcie żołędzi w miejscu wytworzenia płata w kierunku grzbietowym, po czym cewka jest pogrążana w obrębie żołędzi a ujście cewki sytuowane jest na szczycie żołędzi[37]. Metoda ta bywa stosowana w leczeniu postaci środkowych przednich.
- Metoda Barcata
W metodzie tej podobnie jak w operacji sposobem Mathieu wykorzystywany jest płat skórny, a dodatkowo wytwarzany jest płat błony śluzowej z rowka cewkowego. Żołądź nacinana jest w miejscu pobrania płata w kierunku grzbietowym, w jej osi umieszczany jest zrolowany płat skórny, a glanduloplastyka kończy zabieg[38].
- Onlay island flap procedure
W technice tej uszypułowany płat z wewnętrznej strony napletka służy rekonstrukcji brzusznej części cewki moczowej[39].
- Operacja sposobem Koffa
W modyfikacji Koffa po wykonaniu denudacji prącia cewka moczowa uwalniana jest od ciał jamistych, co pozwala na jej wydłużenie o około 15 mm i wyprowadzenie ujścia cewki na szczycie żołędzi[40][41].
- Operacja sposobem Mustarde’a
W technice tej do odtworzenia obwodowej części cewki wykorzystuje się płat ze skóry prącia, uszypułowany u ujścia cewki, podobnie jak w metodzie według Mathieu. Płat jest szerszy by mógł służyć rekonstrukcji całego obwodu cewki. Następnie zrekonstruowana cewka wyprowadzana jest na szczyt żołędzi przez wytworzony w niej tunel[42].
- Operacja sposobem Broadbenta i Woolfa
Kolejna technika wykorzystująca płat prąciowy uszypułowany przy ujściu zewnętrznym cewki. Nacięcie i preparacja wykonywane są powyżej ujścia cewki, a nie poniżej, jak w metodach Mustarde’a czy Mathieu[43]. Metodę można zastosować przy dużych niedoborach cewki moczowej, także w postaciach środkowych spodziectwa, o ile nie współistnieją z nimi duże niedobory skóry prącia uniemożliwiające utworzenie płata skórnego. Próby wykorzystania metody do leczenia spodziectwa tylnego spotykały się z dużym odsetkiem niepowodzeń, więc metoda ta ma ograniczone zastosowanie w leczeniu te grupy pacjentów.
Metody wykorzystujące do rekonstrukcji cewki płaty nieowłosionej skóry[44], błony śluzowej pęcherza moczowego[45][46] lub jamy ustnej[47][48] stosowane są w leczeniu postaci środkowych i tylnych spodziectwa. Techniki te dają gorsze wyniki niż te z zastosowaniem płatów uszypułowanych, są też obarczone większą ilością powikłań. Powszechniej wykorzystuje się błonę śluzową jamy ustnej, szczególnie przy konieczności reperacji.
- Operacja sposobem Ducketta
Metodzie tej wykorzystuje się uszypułowany płat skórny pochodzący z wewnętrznej strony napletka. Technika stosowana w leczeniu postaci tylnych spodziectwa, pozwala nawet na odtworzenie siedmiocentymetrowego odcinka cewki[49].
- Operacja sposobem Glassberga
Technika należąca do grupy kombinowanych, wykorzystująca ideę rekonstrukcji cewki moczowej według Thierscha i Dupleya oraz rulonizacji sposobem Ducketta uszypułowanego płata pochodzącego z wewnętrznej strony napletka[50][51].
- Operacja sposobem Koyanagi
Technika jednoetapowej rekonstrukcji cewki w ciężkich postaciach spodziectwa, wykorzystująca płat uszypułowany wokół ujścia cewki, podobnie jak w operacji sposobem Broadbenta i Woolfa[52].
- Operacja sposobem Standoli
W operacji sposobem Standoli płat służący do rekonstrukcji cewki tworzony jest z zewnętrznej strony napletka[53]. Tak jak w innych metodach tej grupy, na cewniku odpowiedniej średnicy płat jest zwijany w rurkę, której jeden koniec zespalany jest z ektopicznym ujściem cewki a drugi koniec wyprowadza się na szczyt żołędzi, uprzednio ją rozszczepiając od strony brzusznej lub przeprowadzając jej tunelizację.
- Operacja sposobem Hayashi
Technika wykorzystująca do rekonstrukcji cewki kombinowane płaty skórne, pochodzące zarówno z napletka i prącia[54].
- Pogłębienie rowka cewkowego sposobem Brendlera
Technika stosowana u pacjentów ze spodziectwem przednim bez przygięcia prącia lub po zabiegu wyprostowania, stwarzająca dogodne warunki do odtworzenia żołędziowego odcinka cewki. Polega na częściowym rozcięciu żołędzi w linii pośrodkowej od strony brzusznej i pokryciu rozcięcia uszypułowanym płatem skórnym pochodzącym z napletka. Korzyści metody płyną z faktu, że chirurg ma więcej dostępnego materiału do rekonstrukcji cewki i lepszą sposobność do umieszczenia odcinka cewki w tunelizowanej żołędzi[55][56].
- Operacja sposobem Byarsa
Technika uzupełnienia ubytku skórnego po stronie brzusznej prącia, polegająca na przecięciu rozprostowanego napletka w linii środkowej i przemieszczeniu utworzonych dwóch płatów skórnych na powierzchnię brzuszną narządu[7].
- Operacja sposobem Ombredanne’a i Nesbita (buttonhole)
Technika polegająca na wykonaniu okalającego żołądź cięcia i rozprostowaniu blaszek napletka. Następnie chirurg wykonuje w niej otwór na żołądź, a nadmiar skóry przenoszony jest na brzuszną powierzchnię prącia[29][57].
Wymienione powyżej techniki mogą być uzupełnione o wykonanie z wkłucia czasowej przetoki pęcherzowo-skórnej. Typowo utrzymuje się ją 3 tygodnie. Pozwala ona na szybkie usunięcie cewnika z cewki, co znacznie zwiększa komfort dziecka i umożliwia wykonywanie opatrunków przez rodziców. Mocz odpływa przez cewnik wychodzący bezpośrednio z powłok brzucha. Cewnik przetoki jest dobrze tolerowany przez dziecko zwiększając jedynie nieznacznie ryzyko infekcji dróg moczowych.
Wyniki leczenia
W większości postaci wady uzyskiwany efekt kosmetyczny jest co najmniej zadowalający. Problematyczne mogą być możliwości rekonstrukcji napletka, co nierzadko jest istotne dla rodziców lub opiekunów operowanego dziecka[58][59].
Powikłania pooperacyjne
Najczęstszym powikłaniem pooperacyjnym jest przetoka cewkowa. Częstość powikłania zależy od zastosowanej techniki operacyjnej i od postaci operowanej wady[60]. W operacji sposobem Mathieu częstość tego powikłania szacuje się na 4%, a w operacjach typu onlay 15–20%[61][62]. Najwięcej powikłań dotyczy operowanych dzieci z tylnymi postaciami wady – dotyczą one nawet 50% pacjentów[54]. Przetoka rzadko ulega samoistnemu zamknięciu, jeśli dodatkowo nie wystąpiło zwężenie cewki, po wygojeniu się rany pooperacyjnej dokonuje się zabiegu chirurgicznego zamknięcia przetoki.
Drugim powikłaniem jest zwężenie, najczęściej w miejscu zespolenia cewki ze zrekonstruowanym odcinkiem lub na szczycie żołędzi. Nierzadko zwężenie współistnieje z przetoką. Zwężenie cewki może być przyczyną objawów podrażnieniowych pęcherza i cewki oraz zakażeń układów moczowych. Niekiedy dla wyleczenia tego powikłania wystarczająca jest kilkakrotna kalibracja przy pomocy rozszerzadeł Hegara, czasem niezbędna jest jednak reoperacja.
Innym powikłaniem jest urethrocele, polegające na odcinkowym poszerzeniu cewki. Urethrocele może być wtórne do zwężenia ujścia zewnętrznego cewki lub może wystąpić proksymalnie do miejsca zespolenia cewki z jej zrekonstruowanym odcinkiem. Inne możliwe powikłania to: wynicowanie ujścia zewnętrznego cewki, obecność włosów w świetle cewki (tworzą się na nich kamienie moczowe), uchyłkowatość cewki i przetrwałe przygięcie brzuszne prącia, oraz balanitis xerotica obliterans (przewlekły proces zapalny ujścia cewki z włóknieniem i postępującym zwężeniem)[46]. Możliwości terapeutyczne tego ostatniego stanu obejmują miejscowe stosowanie steroidów w maściach lub meatoplastykę.
Przypisy
- ↑ Dorland's Medical Dictionary: Hypospadias (ang.). [dostęp 2010-05-02].
- ↑ a b c Mouriquand PD, Mure PY. Current concepts in hypospadiology. „BJU Int”. 93. Suppl 3, s. 26-34, 2004. PMID: 15086439.
- ↑ Paulus Aegineta: The seven books of Paulus Aeginata. Londyn: Sydenham Society, 1844.
- ↑ Mettauer JP. Practical observations on those malformations of the male urethra and penis, termed hypospadias and epispadias. „Am J Med Sci”. 4. 43, 1842.
- ↑ a b Duplay, S. De l’hypospade périnéoscrotal et de son traitement chirurgical. „Arch Gen Med”. 1, s. 613–657, 1874.
- ↑ Edmunds A. An operation for hypospadias. „Lancet”. 447. 15, 1913.
- ↑ a b Byars LT. Functional restoration of hypospadias deformities; with a report of 60 completed cases. „Surg Gynecol Obstet”. 92. 2, s. 149–54, 1951. PMID: 14809573.
- ↑ a b Paulozzi LJ, Erickson JD, Jackson RJ. Hypospadias trends in two US surveillance systems. „Pediatrics”. 100. 5, s. 831–834, 1997. PMID: 9346983.
- ↑ Hypospadias. W: Welch, KJ: Pediatrics surgery. Ravitch, MM, Welch, KJ, Benson, CD. Chicago: Year Book Medical Publisher, ss. 1353–1376.
- ↑ Helen Dolk: Epidemiology of Hypospadias. [w:] Ahmed T. Hadidi, A. A. F. Azmy (red.): Hypospadias Surgery: An Illustrated Guide. Springer, 2003 s. 51 ISBN 3-540-43041-5
- ↑ Albers N, Ulrichs C, Glüer S, Hiort O, Sinnecker GH, Mildenberger H, Brodehl J. Etiologic classification of severe hypospadias: implications for prognosis and management. „J Pediatr”. 131. 3, s. 386–92, 1997. PMID: 9329414.
- ↑ Fredell L, Iselius L, Collins A, Hansson E, Holmner S, Lundquist L, Läckgren G, Pedersen J, Stenberg A, Westbacke G, Nordenskjöld A. Complex segregation analysis of hypospadias. „Hum Genet”. 111. 3, s. 231-4, 2002. PMID: 12215834.
- ↑ Klip H, Verloop J, van Gool JD, Koster ME, Burger CW, van Leeuwen FE; OMEGA Project Group. Hypospadias in sons of women exposed to diethylstilbestrol in utero: a cohort study. „Lancet”. 359. 9312, s. 1102-7, 2002. PMID: 11943257.
- ↑ Brouwers MM, Feitz WF, Roelofs LA, Kiemeney LA, de Gier RP, Roeleveld N. Hypospadias: a transgenerational effect of diethylstilbestrol?. „Hum Reprod”. 21. 3, s. 666–669, 2006. PMID: 16293648.
- ↑ North K, Golding J. A maternal vegetarian diet in pregnancy is associated with hypospadias. The ALSPAC Study Team. Avon Longitudinal Study of Pregnancy and Childhood. „BJU International”. 85, s. 107-113, 2000. PMID: 10619956.
- ↑ Gatti JM, Kirsch AJ, Troyer WA, Perez-Brayfield MR, Smith EA, Scherz HC. Increased incidence of hypospadias in small-for-gestational age infants in a neonatal intensive care unit. „BJU Int”. 87, s. 548–50, 2001. PMID: 11298055.
- ↑ Fredell L, Kockum I, Hansson E, Holmner S, Lundquist L, Lackgren G, Pedersen J, Stenberg A, Westbacke G, Nordenskjold A. Heredity of hypospadias and the significance of low birth weight. „J Urol”. 167. 3, s. 1423–1427, 2002. PMID: 11832761.
- ↑ Fredell L, Lichtenstein P, Pedersen NL, Svensson J, Nordenskjold A. Hypospadias is related to birth weight in discordant monozygotic twins. „J Urol”. 160. 6 Pt 1, s. 2197–2199, 1998. PMID: 9817368.
- ↑ el-Galley RE, Smith E, Cohen C, Petros JA, Woodard J, Galloway NT. Epidermal growth factor (EGF) and EGF receptor in hypospadias. „Br J Urol”. 79. 1, s. 116-9, 1997. PMID: 9043509.
- ↑ Aaronson IA, Cakmak MA, Key LL. Defects of the testosterone biosynthetic pathway in boys with hypospadias. „J Urol”. 157. 5, s. 1884-8, 1997. PMID: 9112555.
- ↑ Silver RI, Russell DW. 5alpha-reductase type 2 mutations are present in some boys with isolated hypospadias. „J Urol”. 162. 3 Pt 2, s. 1142-5, 1999. PMID: 10458450.
- ↑ Allen TD, Spence HM. The surgical treatment of coronal hypospadias and related problems. „J Urol”. 100. 4, s. 504-8, 1968. PMID: 5677389.
- ↑ Bellinger MF. Embryology of the male external genitalia. „Urol Clin North Am”. 8. 3, s. 375–82, 1981. PMID: 7324305.
- ↑ a b Khuri FJ, Hardy BE, Churchill BM. Urologic anomalies associated with hypospadias. „Urol Clin North Am”. 8. 3, s. 565–71, 1981. PMID: 6119828.
- ↑ Ritchey ML, Benson RC Jr, Kramer SA, Kelalis PP. Management of mullerian duct remnants in the male patient. „J Urol”. 140. 4, s. 795-9, 1988. PMID: 3418801.
- ↑ Lech Korniszewski: Dziecko z zespołem wad wrodzonych. Diagnostyka dysmorfologiczna. Wyd. Wydanie II. Warszawa: Wydawnictwo Lekarskie PZWL, 2005, s. 117–118. ISBN 83-200-3042-0.
- ↑ a b c d Spodziectwo. W: Wiesław Urbanowicz: Chirurgia dziecięca. Jerzy Czernik (red.). Wyd. Wydanie I. Warszawa: Wydawnictwo Lekarskie PZWL, 2005, s. 725–742. ISBN 83-200-3066-8.
- ↑ Ahmed T. Hadidi, A. A. F. Azmy: Timing of elective Hypospadias Repair (ang.). W: Hypospadias surgery: an illustrated guide [on-line]. Springer, 2004. s. 83. [dostęp 2011-06-10].
- ↑ a b Nesbit RM. Congenital curvature of the phallus: report of three cases with description of corrective operation. „J Urol”. 63, s. 230, 1965. PMID: 11905897.
- ↑ Gittes RF, McLaughlin AP 3rd. Injection technique to induce penile erection. „Urology”. 4. 4, s. 473-4, 1974. PMID: 4418594.
- ↑ Greenfield SP, Sadler BT, Wan J. Two-stage repair for severe hypospadias. „J Urol”. 152. 2 Pt 1, s. 498–501, 1994. PMID: 8015102.
- ↑ Retik AB, Bauer SB, Mandell J, Peters CA, Colodny A, Atala A. Management of severe hypospadias with a 2-stage repair. „J Urol”. 152. 2 Pt 2, s. 749–51, 1994. PMID: 8022010.
- ↑ Duckett JW. MAGPI (meatoplasty and glanuloplasty): a procedure for subcoronal hypospadias. „Urol Clin North Am”. 8. 3, s. 513-9, 1981. PMID: 7324318.
- ↑ Thiersch C. Uber die entstehungswise und operative behandlung der epispadie. „Arch Heitkunde”. 10, s. 20–25, 1869.
- ↑ Bladder exstrophy closure and epispadias repair. W: Ranslay PG, Duffy PG, Wollin M: Rob and Smith’s Operative Surgery. Dudley H, Carter D, Russel RCG (red.). London: Butterworth, 1988, s. 620–632.
- ↑ Snodgrass W. Tubularized, incised plate urethroplasty for distal hypospadias. „J Urol”. 151, s. 464–469, 1994.
- ↑ Mathieu P. Traitement en un temps de l’hypospade balanique et juxta-balanique. „J Chir (Paris)”. 39, s. 481–484, 1932.
- ↑ Current Concepts of Treatment. W: Barcat J: Plastic and reconstructive surgery of genital area. Horton CE (red.). Boston: Little, Brown & Co, 1973, s. 249-263.
- ↑ Hollowell JG, Keating MA, Snyder HM 3rd, Duckett JW. Preservation of the urethral plate in hypospadias repair: extended applications and further experience with the onlay island flap urethroplasty. „J Urol”. 143. 1, s. 98-101, 1990. PMID: 2294275.
- ↑ Koff SA, Brinkman J, Ulrich J, Deighton D. Extensive mobilization of the urethral plate and urethra for repair of hypospadias : the modified Barcat technique. „J Urol”. 151, s. 466–469, 1994. PMID: 8283562.
- ↑ Warwick RT, Parkhouse H, Chapple CR. Bulbar elongation anastomotic meatoplasty (BEAM) for subterminal and hypospadiac urethroplasty. „J Urol”. 158, s. 1160-1167, 1997. PMID: 9258162.
- ↑ Mustarde JC. One-stage correction of distal hypospadias: and other people's fistulae. „Br J Plast Surg”. 18. 4, s. 413–22, 1965. PMID: 5321280.
- ↑ Broadbent TR, Woolf RM. Hypospadias. One-stage repair. „Rocky Mt Med J”. 68. 1, s. 35-7, 1971. PMID: 5100442.
- ↑ Devine CJ Jr, Horton CE. A one stage hypospadias repair. „J Urol”. 85, s. 166–72, 1961. PMID: 13722372.
- ↑ Keating MA, Cartwright PC, Duckett JW. Bladder mucosa in urethral reconstructions. „J Urol”. 144. 4, s. 827–34, 1990. PMID: 2204726.
- ↑ a b Mouriquand PD, Persad R, Sharma S. Hypospadias repair: current principles and procedures. „Br J Urol”. 76. Suppl 3, s. 9–22, 1995. PMID: 8535769.
- ↑ Mollard P, Mouriquand P, Bringeon G, Bugmann P. Repair of hypospadias using a bladder mucosa graft in 76 cases. „J Urol”. 142, s. 1548–50, 1989.
- ↑ Duckett JW, Coplen D, Ewalt D, Baskin LS. Buccal mucosal urethral replacement. „J Urol”. 153. 5, s. 1660-3, 1995. PMID: 7715003.
- ↑ Duckett JW Jr. Transverse preputial island flap technique for repair of severe hypospadias. „Urol Clin North Am”. 7. 2, s. 423–30, 1980. PMID: 7404875.
- ↑ Glassberg KI. Augmented Duckett repair for severe hypospadias. „J Urol”. 138. 2, s. 380-1, 1987. PMID: 3599259.
- ↑ Zaontz MR, Kaplan WE, Ritchie EL. Use of distal Thiersch-Duplay urethroplasty for proximal hypospadias repairs in conjunction with short island pedicle flap. „Urology”. 36. 5, s. 420-3, 1990. PMID: 2238300.
- ↑ Koyanagi T, Nonomura K, Kakizaki H, Takeuchi I, Yamashita T. Experience with one-stage repair of severe proximal hypospadias: operative technique and results. „Eur Urol”. 24. 1, s. 106–10, 1993. PMID: 8365429.
- ↑ Standoli L. Vascularized urethroplasty flaps. The use of vascularized flaps of preputial and penopreputial skin for urethral reconstruction in hypospadias. „Clin Plast Surg”. 15. 3, s. 355–70, 1988. PMID: 3292108.
- ↑ a b Hayashi Y, Kojima Y, Mizuno K, Nakane A, Kohri K. The modified Koyanagi repair for severe proximal hypospadias. „BJU Int”. 87. 3, s. 235–238, 2001. PMID: 11167649.
- ↑ Brendler H. A new method for the construction of a glandular urethra in hypospadias repair. „J Urol”. 59, s. 1164, 1949.
- ↑ Gross R. Usuwalne szwy ciągłe podskórne w leczeniu spodziectwa u chłopców. „Probl Chir dziec”. 8, s. 46–52, 1981.
- ↑ Ombredanne, L. L’hypospadias pénien chez l’enfant. „Bull Soc Chir Paris”. 37, s. 1076, 1911.
- ↑ Mureau MA, Slijper FM, Slob AK, Verhulst FC, Nijman RJ. Satisfaction with penile appearance after hypospadias surgery: the patient and surgeon view. „J Urol”. 155. 2, s. 703-6, 1996. PMID: 8558709.
- ↑ Urbanowicz W. Odtworzenie obwodowego odcinka cewki moczowej sposobem MAGPI. „Pol Przegl Chir”. 12, s. 1089, 1986.
- ↑ Retik AB, Keating M, Mandell J. Complications of hypospadias repair. „Urol Clin North Am”. 15. 2, s. 223–236, 1988. PMID: 3381369.
- ↑ Mollard P, Mouriquand P, Basset T. Le traitement de l'hypospade. „Chir Pediatr”. 28. 4–5, s. 197–203, 1987. PMID: 3442922.
- ↑ Parsons KF, Abercrombie GF. Transverse preputial island flap neo-urethroplasty. „Br J Urol”. 54. 6, s. 745-7, 1982. PMID: 7150934.
Zobacz też
- andrologia
- wnętrostwo
- wynicowanie pęcherza moczowego
- wierzchniactwo
Linki zewnętrzne
- John M Gatti: Hypospadias (ang.). eMedicine Pediatrics, 2006. [dostęp 2007-10-11].
- http://www.hypospadias-surgery.com/
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.hypospadias close-up


