Atrezja przełyku
| atresia oesophagi | |
| ICD-10 | |
|---|---|
| Q39.0 | Zarośnięcie przełyku bez przetoki |
| Q39.1 | Zarośnięcie przełyku z przetoką tchawiczo-przełykową |
| Q39.2 | Wrodzona przetoka tchawiczo-przełykowa bez zarośnięcia |

Atrezja przełyku (łac. atresia oesophagi, ang. (o)esophagal atresia, OA) – grupa wad wrodzonych obejmująca przerwanie ciągłości przełyku związane lub nie z przetrwałym połączeniem przełyku z tchawicą.
W 86% przypadków atrezji przełyku towarzyszy dystalna przetoka tchawiczo-przełykowa (łac. fistula tracheoesophagea, ang. tracheo-(o)esophagal fistula, TEF, TOF), w 7% przypadków nie ma przetoki, natomiast w 4% przetoka tchawiczo-przełykowa jest obecna bez atrezji przełyku[1]. Częstość wady ocenia się na 1:2.500[1]–1:3.500[2] urodzeń. Niemowlęta z całkowitą atrezją przełyku nie są w stanie przełykać, a obfite ślinienie wymagające systematycznego odsysania zalegającej wydzieliny jest jednym z wczesnych objawów wady. W 50% przypadków wada jest izolowana; w pozostałej połowie występują inne wady, w większości wchodzące w skład asocjacji VACTERL (wady kręgów, odbytnicy i odbytu, serca, nerek i kończyn).
Etiologia nie jest poznana; uważa się, że jest ona wieloczynnikowa. Zwierzęce modele atrezji przełyku sugerowały nieprawidłową ekspresję genu Sonic hedgehog (Shh) jako jedną z przyczyn, ale jak dotąd nie potwierdzono roli ludzkiego homologu tego genu w patogenezie malformacji. Zidentyfikowano przynajmniej trzy zespoły wad wrodzonych o zbadanym podłożu genetycznym, w których obrazie klinicznym stwierdza się atrezję przełyku[2]. Zdecydowana większość przypadków OA jest jednak sporadyczna, a ryzyko wystąpienia wady w kolejnej ciąży wynosi około 1%. Możliwa jest diagnoza prenatalna wady na podstawie badania USG płodu, począwszy od 18. tygodnia ciąży. Prawdopodobieństwo wystąpienia atrezji przełyku u noworodka jest zwiększone w przypadku wielowodzia. Potwierdzenie rozpoznania stawiane jest na podstawie zdjęcia rentgenowskiego klatki piersiowej i brzucha dziecka. Leczenie wady jest chirurgiczne; rokowanie bezpośrednio zależy od masy urodzeniowej dziecka i od ewentualnej obecności towarzyszących wad serca. Przed wprowadzeniem chirurgicznych metod leczenia wada była letalna.
Historia
Angielski lekarz William Durston w 1670 roku opublikował doniesienie „A Narrative of a Monstrous Birth in Plymouth”[3] na łamach Philosophical Transactions of Royal Society, w którym znajdowała się obserwacja niedrożności przełyku u jednego z bliźniąt syjamskich[4]. Pierwszy dobrze udokumentowany przypadek atrezji przełyku potwierdzonej badaniem post mortem pochodzi z roku 1697 roku i jest autorstwa Thomasa Gibsona[5]. Lekarz zapisał: „Około listopada 1696 roku zostałem wezwany do niemowlęcia które nie chciało przełykać. Dziecko wyglądało na bardzo głodne i chciwie jadło pokarm podawany mu łyżką, ale kiedy miało go przełknąć, wyglądało jakby się krztusiło, a to co miało być połknięte i powinno pójść w dół, wracało do ust i nosa (...)”. Następny przypadek opisał Thomas Hill w 1840 roku[6]. Niemowlę prezentowało takie same objawy jak pacjent Gibsona; Hill zaproponował że „delikatna stymulacja odbytnicy może usunąć problem”, ale okazało się, że „nie było śladu odbytu”; tym samym Hill był pierwszym, który stwierdził istnienie innej wady wrodzonej skojarzonej z atrezją przełyku.
Thomas Holmes w 1869 roku zasugerował możliwości leczenia chirurgicznego wady, ale jednocześnie odradzał próby w tym kierunku[7]. Pierwszej próby operacji udrożnienia przełyku narzędziem przez wytworzoną gastrostomię dokonał Thomas Steele 20 listopada 1888 roku; wysiłki połączenia obu końców cewy przełyku były jednak bezowocne, dziecko zmarło 24 godziny po zakończeniu operacji[8]. Dopiero w 1913 roku Harry Richter zaproponował plan operacji wady, polegający na połączeniu przetoki i anastomozy na obu końcach przełyku: u dwóch noworodków z dostępu przeopłucnowego podwiązał przetokę oskrzelową i założył gastrostomię[9]. Kolejne próby poczynił Lanman w 1936 roku[10]. Jego pacjent przeżył 3 godziny; gdy w 1940 roku opublikował pracę przeglądową dokumentując swoje doświadczenia, żadne z 30 zoperowanych przez niego dzieci nie przeżyło operacji. Pierwsze sukcesy w operacyjnym leczeniu atrezji przełyku odnotowali Leven[11] i Ladd[12] w 1939 roku. Cameron Haight pierwszy na świecie w 1941 roku przeprowadził jednoetapową operację polegającą na połączeniu niedrożnych odcinków metodą „koniec do końca”; 12-dniowy noworodek płci żeńskiej przeżył, mimo poważnych pooperacyjnych powikłań[13]. Wkrótce przeżywalność dzieci z wadami wrodzonymi typu OA/TEF uległa spektakularnej poprawie; we wczesnych latach 50. wynosiła ona 57,6%[14]. W połowie lat 80. śmiertelność spadła do 15%, a w niektórych ośrodkach do poniżej 10%[1].
W Polsce pionierskie operacje wad przełyku wykonali pod koniec lat 50., niezależnie od siebie, Adam Michejda i Wanda Poradowska z ośrodków wrocławskiego i warszawskiego[15].
Epidemiologia
OA/TEF są stosunkowo częstymi malformacjami, występując z częstością 1:2500–1:3500 żywych urodzeń[1][2]. Zdecydowana większość przypadków OA jest sporadyczna (nie wchodzi w skład zespołów wad wrodzonych), chociaż mała część tych nie występujących rodzinnie przypadków spowodowana jest aberracjami chromosomowymi. Rodzinne występowanie OA/TEF jest niezwykle rzadkie, stanowiąc mniej niż 1% ogółu. OA występuje 2 do 3 razy częściej u bliźniąt[16]. Stwierdzono niewielkie różnice geograficzne w występowaniu OA/TEF; w jednym z badań częstość w Norwegii wynosiła 1,82:10.000 urodzeń, a w Szwecji 2,67:10.000[17]. Częstość OA/TEF jest wysoka szczególnie w Finlandii, wynosząc 4:10.000[18]. Stwierdzono malejącą częstość tych wad na przestrzeni ostatnich lat w Europie[19]. Gdy wykluczyć przypadki OA/TEF towarzyszące aberracjom chromosomalnym, nie ma związku między wiekiem matki a ryzykiem wady u dziecka[2].
Patogeneza
Przyczyną malformacji typu atrezji przełyku i przetok między tchawicą a przełykiem jest zaburzenie różnicowania prajelita w kierunku przełyku i dróg oddechowych w okresie embriogenezy. Zawiązek układu oddechowego powstaje około 4. tygodnia[2] z uwypuklenia brzusznej ściany jelita przedniego, poniżej kieszonek skrzelowych, z początku jako bruzda krtaniowo-tchawicza, a następnie jako zachyłek krtaniowo-tchawiczy (respiratory diverticulum). Światło zarodkowych dróg oddechowych i przełyku oddziela przebiegająca w płaszczyźnie czołowej ciała przegroda tchawiczo-przełykowa (esophagotracheal septum), mająca powstać w klasycznym modelu embriogenezy z krawędzi (oesophagal ridges) wyrastających ze ścian bocznych światła i spotykających się w linii pośrodkowej[20]. Model ten jest kwestionowany przez niektórych autorów, według których separacja przełyku i tchawicy zachodzi wskutek zapadnięcia się światła jelita przedniego w płaszczyźnie czołowej, fuzji ścian bocznych i apoptozie powstałej przegrody[21]; hipotezę tę potwierdza stwierdzenie ciałek apoptotycznych w miejscu separacji przełyku i tchawicy[22].
Etiologia
Dane z ciąż bliźniaczych i rzadkość rodzinnego występowania sugerują niewielkie znaczenie czynników genetycznych w patogenezie malformacji przełyku[2]. W grupie pacjentów z atrezją przełyku stanowiącą element zespołu wad wrodzonych znajdują się chorzy z aberracjami chromosomalnymi, rzadkimi zespołami wad wrodzonych o dziedziczeniu jednogenowym, asocjacja VACTERL i szereg zespołów o nakładających się fenotypach.
OA/TEF w zespołach aberracji chromosomalnych
W około 10% przypadkach OA/TEF stwierdza się trisomię albo niezrównoważoną translokację chromosomów[2]. Wydaje się, że trisomia 18 (zespół Edwardsa) jest większym czynnikiem ryzyka malformacji tego typu niż trisomia 21 (zespół Downa), gdyż mimo znacznie rzadszego występowania tej pierwszej aneuploidii, w dużych badaniach epidemiologicznych pacjentów z OA/TEF liczba noworodków z trisomią 18 była wyższa niż tych z trisomią 21[2].
Obok trisomii, istnieje pojedyncze doniesienie o malformacji przełyku u dziecka z zespołem delecji 22q11[23]. Ponadto stwierdzono związek delecji 17q22q23.3 z OA/TEF[24].
Ekspozycja na teratogeny
Odnotowano kilka przypadków zespołu wad wrodzonych obejmującego atrezję przełyku u dzieci matek przyjmujących metimazol w pierwszym trymestrze ciąży[25][26].
Asocjacja VACTERL
Zespoły wad wrodzonych o dziedziczeniu jednogenowym
Znane są przynajmniej trzy zespoły wad wrodzonych, w których obrazie klinicznym stwierdza się OA/TOF:
- Zespół Feingolda (zespół oczno-palcowo-przełykowo-dwunastniczy, OMIM#164280) – udowodniono istnienie mutacji w genie N-MYC u pacjentów z tym zespołem[27]. Fenotyp zespołu nakłada się na fenotyp asocjacji VACTERL[28]. Stwierdza się w nim mikrocefalię, nieprawidłowości budowy palców (brachymezofalangia i klinodaktylia 2. i 5. palca dłoni, syndaktylia palców stóp), atrezje przewodu pokarmowego (zwłaszcza przełyku, także dwunastnicy), niewielkie cechy dysmorficzne twarzy (krótkie szpary powiekowe, „pełność” oczodołów).
- Zespół anoftalmiczno-przełykowo-genitalny (zespół Rogersa, AEG syndrome, OMIM#206900) – rzadki, ale dobrze udokumentowany zespół wad, obejmujący atrezję przełyku, anoftalmię i nieprawidłowości budowy narządów płciowych. Stwierdzono mutacje w genie SOX2 u pacjentów z tym zespołem[29].
- Zespół CHARGE (asocjacja CHARGE, OMIM#214800) – mimo że OA/TEF nie uwzględniono w akronimie oddającym najczęściej spotykane w tej asocjacji wady (koloboma, wady serca, atrezja nozdrzy tylnych, opóźniony wzrost, hipoplazja narządów płciowych zewnętrznych, anomalie uszne), malformacje tego typu spotyka się u około 10% pacjentów z rozpoznanym zespołem[30]. U części pacjentów z zespołem CHARGE stwierdzono mutacje w genie CHD7[31].
Klasyfikacja


Podział Vogta z 1929 roku wciąż jest używany[33]; zmodyfikowane klasyfikacje Ladda[34] i Grossa[35] również są spotykane, podobnie jak rozbudowana i skomplikowana klasyfikacja Klutha, obejmująca kazuistyczne warianty malformacji, takie jak przetoka przełykowo-oskrzelowa i duplikacja przełyku[36][37].
| Typ | Opis |
|---|---|
| A | OA bez TEF („czysta” atrezja) |
| B | OA z proksymalną TEF |
| C | OA z dystalną TEF |
| D | OA z dystalną i proksymalną TEF |
| E | TEF bez OA albo tzw. przetoka-H |
| F | Wrodzona stenoza przełyku |
| Typ | Opis |
|---|---|
| I | Aplazja przełyku |
| II | OA bez TEF |
| IIIA | OA z proksymalną TEF |
| IIIB | OA z dystalną TEF |
| IIIC | OA z dystalną i proksymalną TEF |
| IV | TEF bez OA (przetoka-H) |
Anatomiczne relacje przełyku i tchawicy przedstawiają się następująco (warianty od najczęstszych do najrzadszych, częstości za Spitz, 2007[1]):
- atrezja przełyku z dystalną przetoką tchawiczo-przełykową (typ IIIB według Vogta, typ C według Grossa, 86%),
- izolowana atrezja przełyku bez przetoki (typ II według Vogta, typ A według Grossa, 7%),
- przetoka tchawiczo-przełykowa bez atrezji (typ IV według Vogta, typ E według Grossa, 4%),
- atrezja przełyku z proksymalną przetoką tchawiczo-przełykową (typ IIIA według Vogta, typ B według Grossa, 2%),
- atrezja przełyku z podwójną przetoką (typ IIIC według Vogta, typ D według Grossa, <1%).
Objawy i przebieg
Najwcześniejszym objawem wady jest wielowodzie, wynikające z faktu, że noworodek nie połyka wód płodowych. USG może ujawnić obecność malformacji (uwidocznienie przepływu płynu w obu kierunkach w obrębie górnej, ślepo zakończonej „kieszeni” przełyku). W wariancie bez przetoki widoczny jest także niedostatek płynu w żołądku i dwunastnicy. Noworodek z całkowitą atrezją przełyku rodzi się z dusznością i sinicą, może wystąpić kaszel, czkawka i tachypnoe. Noworodek nie może przełykać śliny, której nadmiar wydostaje się przez nos. Po odśluzowaniu jamy nosowej i ustnej dziecka, objawy ustępują, by powrócić po krótkim czasie, co jest pierwszym sygnałem wady. Przy podejrzeniu niedrożności dziecka nie wolno karmić, zanim wada nie zostanie wykluczona. Gdy założenie zgłębnika 10-12 F jest niemożliwe z powodu oporu, istnienie wady jest niemal pewne. Standardowym działaniem po rozpoznaniu jest natychmiastowe założenie przez nos lub usta sondy Replogle’a służącej odsysaniu śliny i zapobiegającej jej aspiracji do dróg oddechowych przez dziecko. Przed zabiegiem chirurgicznym konieczne jest określenie typu malformacji[38].
Towarzyszące anomalie
Ponad 50% niemowląt obok OA ma jedną lub więcej towarzyszących wad wrodzonych[39]. Najczęstsze z nich to:
- wady układu sercowo-naczyniowego (29%),
- anomalie odbytu i odbytnicy (14%),
- wady układu moczowo-płciowego (14%),
- wady układu pokarmowego (13%),
- wady kośćca (10%),
- wady układu oddechowego (6%),
- inne (11%).
Rozpoznanie
- Diagnostyka prenatalna
W dwóch spośród sześciu typów TEF, w których brak jakiegokolwiek połączenia między tchawicą a żołądkiem, w prenatalnym USG nie można uwidocznić żołądka płodu. W pozostałych typach wady żołądek może być mały albo prawidłowej wielkości. Diagnostyka różnicowa ultrasonograficznego objawu braku widocznego żołądka obejmuje situs inversus, przepuklinę przeponową albo czasowe fizjologiczne opróżnienie żołądka.
Wadę można też wykryć na podstawie zwiększonej objętości płynu owodniowego lub wielowodzia w trzecim trymestrze ciąży[40].
W przypadku podejrzenia OA/TEF płód powinien zostać poddany badaniom w referencyjnym dla podobnych wad ośrodku pod kątem potwierdzenia rozpoznania i wykluczenia innych wad. Zaleca się badanie kariotypu płodu.
Leczenie

Przeciwwskazaniem do leczenia operacyjnego jest sekwencja Potter (obustronna agenezja nerek) i zespół Pataua – w 90% przypadków dzieci z tymi zespołami wad wrodzonych nie przeżywają okresu niemowlęcego. Leczenie zachowawcze nieoperacyjne jest też wskazane u noworodków z niemożliwymi do korekcji chirurgicznej wadami serca i krwawieniem dokomorowym IV stopnia[1].
Leczenie malformacji przełyku i tchawicy polega na chirurgicznym odtworzeniu ciągłości przełyku i (lub) usunięciu przetoki. Wydzielenie przetoki wymaga szczególnej ostrożności, należy uważać, aby nie uszkodzić gałązek naczyniowych nerwu błędnego. W trakcie operacji podwiązuje się przetokę nitką lnianą blisko ściany tchawicy, aby nie pozostał zachyłek od strony dróg oddechowych, który mógłby powodować stany zapalne.
Zespalanie przełyku polega na wycięciu na obu ślepo zakończonych końcach otworów średnicy równej światłu przełyku, które zszywa się następnie szwami jedwabnymi. Po utworzeniu zespolenia sprawdza się jego szczelność, nalewając do niego płyn fizjologiczny.
Przygotowanie przedoperacyjne
Odpowiednie przygotowanie noworodka do zabiegu operacyjnego jest jednym z czynników wpływających na pomyślny wynik operacji. Składa się na nie zapewnienie dziecku komfortu cieplnego i odpowiedniej wilgotności otoczenia przez umieszczenie go w inkubatorze transportowym lub inkubatorze otwartym z promiennikiem ciepła; stałe lub doraźne odsysanie wydzieliny z jamy ustnej i górnego odcinka przełyku; ułożenie dziecka na boku lub z uniesieniem górnej połowy ciała; tlenoterapia (wentylacja mechaniczna w razie potrzeby) i założenie stałego dostępu do żyły. Zabieg operacyjny przeprowadzany jest po uzyskaniu stabilizacji podstawowych funkcji życiowych.
Metody leczenia operacyjnego
Pierwotne zespolenie „koniec do końca”
Metodę można zastosować, gdy odległość między drożnymi odcinkami przełyku nie jest duża i wynosi do 2,5–3 cm. Jest to najkorzystniejsze rozwiązanie zarówno z czynnościowego, jak i anatomicznego punktu widzenia. Noworodek do zabiegu układany jest na lewym boku z uniesioną i lekko odwiedzioną kończyną górną prawą; pod klatkę piersiową podkładany jest niewielki wałek. Działanie to ma na celu uzyskanie lepszego dostępu do przestrzeni międzyżebrowych. Operację wykonuje się zazwyczaj z jednego z dwóch cięć: poprzecznego biegnącego pod kątem łopatki od linii pachowej przedniej do przedniego brzegu mięśnia najszerszego grzbietu, albo z wertykalnego biegnącego od podstawy dołu pachowego do poziomu VI-VII żebra, między linią pachową środkową i tylną. Z obydwu cięć dostęp do klatki piersiowej uzyskuje się drogą IV przestrzeni międzyżebrowej. W drugim przypadku można zastosować dostęp przezopłucnowy bądź pozaopłucnowy.
Wydłużenie przełyku przez ponadśluzówkowe okrężne nacięcie błony mięśniowej (technika Livadisa)
Technika ta pozwala na wydłużenie górnego odcinka przełyku niezależnie od jego mobilizacji; w metodzie tej wykonuje się najpierw okrężne ponadśluzówkowe jedno- lub wielokrotne nacięcie górnego odcinka, następnie nacięcie spiralne błony mięśniowej z jednoczesnym zbliżeniem nacięć, i w końcu wytworzenie płata z przedniej powierzchni górnego odcinka.
Zabiegi odraczane
- Wydłużenie krzywizny mniejszej żołądka metodą Scharliego
W metodzie tej szereg działań powoduje wydłużenie dystalnego odcinka przełyku kosztem krzywizny mniejszej żołądka; chirurg podwiązuje i przecina lewą tętnicę żołądkową, wykonuje poprzeczne przecięcie żołądka, fundoplikację, pyloroplastykę, i ostatecznie zespolenie w obrębie klatki piersiowej albo nawet na szyi.
- Metoda Rehbeina
Technika ta polega na przeprowadzeniu nylonowej nitki przez niedrożny kikut przełyku. Końce nitek wyprowadza się na zewnątrz przez gastrostomię i jamę ustną. Pociąganie nitek zakończonych metalowymi oliwkami prowadzi do stopniowego zbliżenia kikutów przełyku, utworzenia zrostu i udrożnienia przełyku. Wytworzony w ten sposób kanał jest wąski i wymaga poszerzenia lub, w przyszłości, wycięcia i wykonania zespolenia. Nitki można założyć bez otwierania klatki piersiowej, metodą endoskopową.
- Wydłużanie górnego odcinka przełyku na zewnątrz klatki piersiowej (multiple extrathoracic esophageal elongations, ETEEs)
Technikę wprowadzoną przez Kimurę i Sopera[41] ulepszyli Takamizawa i wsp.[42] z ośrodka w Kobe. Chirurdzy najpierw mobilizowali górny ślepo zakończony odcinek ślepo przełyku z cięcia poprzecznego powyżej prawego obojczyka i wykonywali tunel podskórny na klatce piersiowej poniżej, po czym zespalali przełyk ze skórą z utworzeniem przetoki ślinowej. Po kilku miesiącach ezofagostomię mobilizowano i wszywano ponownie kilka centymetrów niżej na klatce piersiowej. Kolejne przemieszczenie ezofagostomii wykonywano po upływie następnych 2-3 miesięcy. Procedurę kontynuuje się aż do uzyskania odpowiedniej długości przełyku, umożliwiającej zespolenie z jego obwodowym odcinkiem. Podczas definitywnej operacji chirurdzy mobilizowali przełyk do wysokości chrząstki pierścieniowatej i przemieszczali poprzez tunel pomiędzy tchawicą i kręgami szyjnymi do klatki piersiowej. Zespolenie obu odcinków sposobem koniec do końca wykonywane jest z prawostronnego dostępu przez klatkę piersiową.
Zabiegi wytwórcze
- Przemieszczenie żołądka do śródpiersia tylnego (gastric pull up)
W metodzie tej chirurg uwalnia wpierw zrosty między lewym płatem wątroby a żołądkiem i zamyka gastrostomię; następnie moblizuje krzywiznę większą i mniejszą podwiązując naczynia sieci i lewą tętnicę żołądkową. Kolejnym etapem jest wypreparowanie dystalnego kikuta przełyku, jego odcięcie i zamknięcie powstałego ubytku. Po wykonaniu pyloromiotomii zakłada się w najwyższym punkcie żołądka dwa szwy kierunkowe zapobiegające skręceniu żołądka podczas jego przeprowadzania przez śródpiersie. Następnie chirurg wypreparowuje przetokę szyjną i przygotowuje do zespolenia górny ślepo zakończony koniec przełyku
- Wytworzenie przełyku z krzywizny większej żołądka
W technice tej wytwarzany jest płat rurowaty pobrany w sposób izoperystaltyczny, unaczyniony przez prawą tętnicę żołądkowo-sieciową (arteria gastroepiploica dextra) lub antypersytaltyczny, unaczyniony przez tętnicę żołądkowo-sieciową lewą (arteria gastroepiploica sinistra).
- Wytworzenie przełyku z jelita grubego
W technice tej wykorzystuje się najczęściej prawą albo lewą część okrężnicy; przedtem należy wykluczyć schorzenia jelita grubego, złe unaczynienie brzeżne oraz towarzyszące wady wrodzone tego odcinka przewodu pokarmowego. Przygotowanie jelita do zabiegu polega na wlewach płuczących i antybiotykoterapii. Odcinek o odpowiedniej długości jest przecinany między zaciskami, po czym odtwarzana jest ciągłość jelita, a dolny segment okrężnicy zespalany jest z przednią lub tylną ścianą żołądka. Po wykonaniu pyloromiotomii jelito przeprowadzane jest przez uprzednio wytworzony tunel pod mostkiem i dwuwarstwowo zespalane z przełykiem.
- Wytworzenie przełyku z jelita cienkiego
W metodzie tej wykorzystuje się uszypułowany lub wolny segment jelita cienkiego. Operacja polega na wykonaniu cięcia brzuszno-piersiowego po stronie lewej, otwarciu dostępu do klatki piersiowej drogą VII międzyżebrza, szerokim nacięciu przepony od rozworu przełykowego wzdłuż brzegu żebrowego; następnie odcinek jelita odpowiedniej długości (zwykle 25 cm, począwszy od 5 cm za więzadłem Treitza) jest wycinany ze szczególnym zwróceniem uwagi na jego unaczynienie. Ciągłość jelita cienkiego jest odtwarzana, a przeszczepiany fragment przemieszczany poza okrężnicę poprzeczną i tylną ścianę żołądka do klatki piersiowej. W następnej kolejności wykonuje się zespolenie jelita z kikutem dolnym i górnym przełyku lub żołądkiem i kikutem górnym w obrębie klatki piersiowej lub szyi. Wykonanie pyloromiotomii lub pyloroplastyki i zamknięcie klatki piersiowej kończy zabieg.
Należy się liczyć z szeregiem powikłań pooperacyjnych: nawracającymi zapaleniami dolnych dróg oddechowych, nadreaktywnością oskrzeli, objawami tracheomalacji i zaburzeniami motoryki przełyku. Powikłania pooperacyjne można podzielić na wczesne i późne.
Powikłania wczesne
Możliwe wczesne powikłania operacji obejmują przeciek przez zespolenie, nawracającą TEF i zwężenie w miejscu zespolenia, a także zakażenie rany, zapalenie śródpiersia, odmę opłucnową, ropniaka opłucnej i zaburzenia połykania.
Nieszczelność zespolenia
Przeciek przez anastomozę (anastomotic leak) zwykle powstaje 3 lub 4 dni po operacji. Donoszono o 15-20% częstości tego powikłania[18][43]. Objawia się bólem, często dochodzi do posocznicy. Leczenie jest podtrzymujące; wdraża się antybiotykoterapię, dziecku nie podaje się nic doustnie, drenuje się śródpiersie i odsysa ślinę. Operacja nie jest wskazana, nawet przy dużym przecieku. Jeżeli przeciek się utrzymuje, może być wskazana ezofagoskopia z użyciem rozpuszczalnego w wodzie środka kontrastowego. Przyjęte postępowanie polega na oczekiwaniu na samoistne zamknięcie przecieku. Jeżeli operację przeprowadzono z dojścia pozaopłucnowego, dziecko jest w stosunkowo lepszym stanie niż przy innych metodach dojścia operacyjnego; przetoka przełykowo-skórna zamyka się w ciągu kilku dni. Jeżeli operację przeprowadzono z dojścia przezopłucnowego, stan dziecka jest cięższy, a powikłanie może przebiegać z powstaniem ropniaka wymagającego dalszego leczenia i zdrenowania. Nie dowiedziono pewnego związku między pooperacyjnym przeciekiem a zwężeniem w miejscu zespolenia[18].
Nawrotowa przetoka
Nawrotowa TEF może wystąpić w ciągu kilku dni od operacji, ale najczęściej następuje to w kilka tygodni po niej. Częstość tego powikłania szacuje się na 3-14%[18]. Pierwszym objawem nawracającej TEF może być zapalenie płuc, a także kaszel i niewydolność oddechowa podczas jedzenia. Rozpoznanie stawiane jest na podstawie wyniku ezofagografii z rozpuszczalnym w wodzie środkiem kontrastowym przeprowadzonej u leżącego na brzuchu dziecka pod fluoroskopią. Środek kontrastowy powoli podaje się przez cewnik do przełyku i stopniowo wycofuje przewód, a obrazy boczne otrzymuje się metodą wideofluoroskopii. Nawrotowa przetoka objawia się jako smuga środka kontrastowego nagle krzyżująca cień tchawicy. Ta tzw. ezofagografia „pull-back” (pull-back tube esophagoscopy, PBTE) jest metodą z wyboru w diagnostyce nawrotowej przetoki. Bronchoskopia i ezofagoskopia mogą być badaniami komplementarnymi, dostarczającymi dodatkowych informacji. Jedna z technik endoskopowych polega na iniekcji 0,5 ml błękitu metylenowego do rurki dotchawiczej i stwierdzenie ewentualnego przecieku płynu przez przetokę w obrazie z ezofagoskopu. Historycznie, uważano pooperacyjne nawrotowe przetoki za wskazanie do zabiegu chirurgicznego, jednak okazało się, że przetoka ulegała z powodzeniem samoistnemu zamknięciu przy zaleceniu nie podawania dziecku niczego doustnie i przy jednotygodniowej antybiotykoterapii. Donoszono również o sukcesach terapeutycznych metod kauteryzacji endoskopowej i przy użyciu kleju fibrynowego[44][45].
Zwężenie w miejscu zespolenia
Zwężenie w miejscu zespolenia stwierdzano w 30-40%[46], a nawet 50% przypadków, ale wskaźnik ten zależy w pewnym stopniu od zdefiniowania „zwężenia”. Średnica przełyku jest zmniejszona w miejscu zespolenia zasadniczo u wszystkich dzieci, ale nie zawsze ma to znaczenie kliniczne. W przypadkach gdy zwężenie wydaje się być czynnościowo znaczące (co sprawdza się metodami diagnostycznymi z doustnym podaniem środka kontrastowego), poszerzenie przełyku pod kontrolą fluoroskopii i przy użyciu balonu Grüntziga jest metodą bezpieczną i najskuteczniejszą[18]. Procedura ta powinna być przeprowadzana przez doświadczonego radiologa. Uważa się, że u małych dzieci zabieg powinien być odroczony, dopóki dziecko nie skończy 6 tygodni i nie miną 4 tygodnie od operacji zespolenia[18]. Inne metody poszerzania przełyku obejmują zastosowanie specjalnych poszerzadeł różnych typów (np. poszerzadło Tuckera albo Maloneya). Farmakologiczna blokada receptorów H2 powinna być wdrożona, ponieważ refluks żołądkowo-przełykowy może być zarówno czynnikiem zaostrzającym, jak i powodującym tworzenie się zwężenia. Innymi czynnikami są metoda operacji, rodzaj założonych szwów, odległość dzieląca zespalane końce przełyku, niedokrwienie dystalnego odcinka, i, przypuszczalnie, ewentualne wystąpienie przecieku w miejscu zespolenia. Zwężenia oporne na powtarzane zabiegi poszerzenia wymagają bardziej agresywnego leczenia, takiego jak operacja antyrefluksowa i (lub) resekcja zwężenia. Rzadko niezbędne jest protezowanie przełyku. Używano stentów, ale jedynie eksperymentalnie. Rodzice mogą być przyuczeni w kierunku przeprowadzania poszerzeń przy użyciu poszerzadła Maloneya samodzielnie w warunkach domowych[18].
Późne powikłania
Późne powikłania operacji OA/TEF mogą obejmować refluks żołądkowo-przełykowy, zaburzenia perystaltyki przełyku (esophageal dysmotility) i tracheomalację (rozmiękanie tchawicy). Niektóre z nich mogą wystąpić stosunkowo wcześnie.
- Refluks żołądkowo-przełykowy
Refluks żołądkowo-przełykowy (GER) jest szczególnie problematyczny u pacjentów z atrezją przełyku z powodu wrodzonych zaburzeń w motoryce przełyku, dysfunkcją naturalnych mechanizmów fizjologicznych zapobiegających refluksowi, możliwej przypadkowej częściowej wagotomii podczas operacji, lub istotnej dysfunkcji nerwu błędnego prowadzącej do opóźnionego opróżniania żołądka. Praktycznie wszystkie dzieci z atrezją przełyku mają wykrywalny refluks żołądkowo-przełykowy; należy starannie wybrać pacjentów wymagających leczenia[18]. Wszystkie dzieci z OA powinny profilaktycznie przyjmować ranitydynę zanim ukończą 6 miesięcy. Niechęć do ssania, kaszel, krztuszenie się, występowanie świstów i astmy, nawracające zapalenia płuc, wymioty, sinica, ślinotok i wyraźna dysfagia u pacjenta są wskazaniami do zbadania stopnia nasilenia refluksu. Dokonuje się tego podając doustnie środek kontrastowy i przeprowadzając endoskopię. pH-metria może być pomocna, o ile próbnik uda się umieścić poniżej zwężenia. Test opróżniania żołądka również jest wskazany[18].
Metody chirurgiczne leczenia GER obejmują operację antyrefluksową (antireflux operation). Częściowa fundoplikacja (partial-wrap fundoplication) jest zazwyczaj preferowana ze względu na zaburzenia motoryki zoperowanego przełyku. Nierzadka jest dysfagia po fundoplikacji, nawet przy bardzo luźnym utworzeniu fałdu. Jeżeli żołądek opróżnia się z opóźnieniem, metodą do rozważenia jest pyloroplastyka balonowa albo chirurgiczna. Część specjalistów preferuje farmakologiczne leczenie refluksu blokadą receptorów H2 albo podając inhibitory pompy protonowej (PPI). Mimo dobrych wyników, część pacjentów kwalifikuje się do leczenia chirurgicznego.
Zaburzenia motoryki przełyku
Zaburzenia motoryki przełyku (ang. esophageal dysmotility) są przewlekłym powikłaniem, dającym różnorodne objawy dysfagii. Dzieci z czasem przyzwyczajają się do dokładnego przeżuwania pokarmów i ich popijania. U małych dzieci, nawet bez wyraźnego zwężenia przełyku, nierzadko dochodzi do zatrzymania kęsa pokarmu w świetle przełyku (ang. food bolus obstructions). Rodzice pacjentów muszą być uświadomieni co do możliwości takiego zdarzenia i powinni wybierać odpowiednie pokarmy dla dzieci. Pomocne mogą być leki prokinetyczne, takie jak domperidon.
Rozmiękanie tchawicy
Tracheomalacja jest manifestacją zaburzenia w embriogenezie. W ciężkiej postaci dotyczącej około 10% pacjentów objawy są dramatyczne, z niemożnością odstawienia dziecka od respiratora i klasycznymi napadami anoksemicznymi włącznie; pacjent staje się blady i bezwładny, zazwyczaj pozostaje w bezdechu i sinicy przez krótki czas. Dzieci z tracheomalacją wymagają dokładnego zbadania i leczenia. Łagodniejsze przypadki tracheomalacji wiążą się z nawracającymi zapaleniami płuc i napadami astmy; inne dolegliwości ze strony układu oddechowego również są częstsze u tych pacjentów. Bronchoskopia przeprowadzona u pacjenta samodzielnie oddychającego uwidacznia tchawicę znacząco zapadającą się, wiotką, zwężającą się lub zamykającą swoje światło przy wydechu. Leczenie polega na wykonaniu aortopeksji, czyli przemieszczeniu łuku aorty poniżej mostka, przez co aorta podtrzymuje przednią ścianę tchawicy od przodu, zapobiegając jej zapadaniu się[47]. Jeżeli ta metoda nie skutkuje, proponuje się stentowanie tchawicy, chociaż budzi to kontrowersje wśród specjalistów[18]. Metodą ostateczną jest tracheotomia. Na szczęście, tracheomalacja zazwyczaj łagodnieje z czasem, wraz ze wzrostem i dojrzewaniem pacjenta.
Rokowanie
W 1962 Waterston i wsp. podzielili pacjentów z malformacjami przełyku na trzy grupy rokownicze, biorąc pod uwagę masę urodzeniową, obecność towarzyszących wad wrodzonych i zapalenia płuc[14].
| Grupa | Charakterystyka | Przeżywalność 1951-1959[14] | Przeżywalność 1980-1992[48] |
|---|---|---|---|
| A | Masa urodzeniowa > 2500 g, stan dobry | 95% (36/38) | 99% (153/154) |
| B | 1. Masa urodzeniowa 1800–2500 g, stan dobry 2. Masa urodzeniowa >2500 g, średnio nasilone zapalenie płuc i wada wrodzona | 68% (29/43) | 95% (72/76) |
| C | 1. Masa urodzeniowa < 1800 g 2. Masa urodzeniowa > 1800 g, ciężkie zapalenie płuc i ciężkie wady wrodzone | 6% (2/32) | 71% (101/142) |
Spitz w 1994 roku podzielił pacjentów na trzy grupy rokownicze, za kryteria przyjmując masę urodzeniową i skojarzone wady wrodzone serca[48]. Wyniki były następujące:
| Grupa | Charakterystyka | Przeżywalność 1980-1992[48] | Przeżywalność 1993-2004[49] |
|---|---|---|---|
| I | Masa urodzeniowa > 1500g, bez dużych wad wrodzonych serca | 97% | 98% |
| II | Masa urodzeniowa < 1500 g lub duże wady wrodzone serca | 59% | 82% |
| III | Masa urodzeniowa < 1500 g i duże wady wrodzone serca | 22% | 50% |
Przypisy
- ↑ a b c d e f g h i Spitz, L.. Oesophageal atresia. „Orphanet Journal of Rare Diseases”. 2. 24, 2007. PMID: 17498283.
- ↑ a b c d e f g h Shaw-Smith, C.. Oesophageal atresia, tracheo-oesophageal fistula, and the VACTERL association: review of genetics and epidemiology. „J Med Genet”. 43. 7, s. 545-554, 2006. PMID: 16299066.
- ↑ Strona tytułowa oryginału tego doniesienia.
- ↑ Durston W.. A narrative of monstrous birth in Playmouth. „Philosophical Transactions of Royal Society”, 1670.
- ↑ Gibson T.: The anatomy of humane bodies epitomized. Wyd. 5th edition. Londyn: Awnsham, Churchill J., 1697.
- ↑ Hill T.P.. Congenital malformation. „Boston Med Surg J.”. 21, s. 320-321, 1840.
- ↑ Holmes T.: Cattive conformazioni nel collo, in chiusura congenita dell’esofagao. 1869.
- ↑ Steele, C.. Case of deficient oesophagus. „The Lancet”. 764, 1888.
- ↑ Richter H.M.. Congenital atresia of the oesophagus: an operation designed for its cure. „Surg Gynecol Obstet”. 17, s. 397-402, 1913.
- ↑ Lanman T.H.. Congenital atresia of the esophagus. A study of 32 cases. „Arch Surg”. 41. 41, s. 1060-1083, 1940.
- ↑ Leven N.L.. Congenital atresia of the esophagus with tracheo-esophageal fistula. „J Thorac Cardiovasc Surg”. 10, s. 648-657, 1941.
- ↑ Ladd W.E.. The surgical treatment of esophageal atresia and tracheoesophageal fistulas. „New England Journal of Medicine”. 230, s. 625-637, 1944.
- ↑ Haight C., Towsley H.. Congenital atresia of the esophagus with tracheoesophageal fistula: extrapleural ligation of fistula and end-to-end anastomosis of esophageal segments. „Surg Gynecol Obstet”. 76, s. 672-688, 1943.
- ↑ a b c Waterston D.J., Carter R.E., Aberdeen E.. Oesophageal atresia: tracheo-oesophageal fistula. A study of survival in 218 infants. „Lancet”. 1, s. 819-822, 1962. PMID: 14005235.
- ↑ Wrodzone zarośnięcie przełyku. W: Jerzy Czernik: Chirurgia dziecięca. Jerzy Czernik (red.). Wyd. Wydanie I. Warszawa: Wydawnictwo Lekarskie PZWL, 2005, s. 101-139. ISBN 83-200-3066-8.
- ↑ Orford J., Glasson M., Beasley S., Shi E., Myers N., Cass D.. Oesophageal atresia in twins. „Pediatr Surg Int”. 16. 8, s. 541-545, 2000. PMID: 11149389.
- ↑ Robert E., Mutchinick O., Mastroiacovo P., Knudsen L.B., Daltveit A.K., Castilla E.E., Lancaster P., Kallen B., Cocchi G.. An international collaborative study of the epidemiology of esophageal atresia or stenosis. „Reprod Toxicol”. 7, s. 405–421, 1993. PMID: 8274816.
- ↑ a b c d e f g h i j Geoffrey Blair: Esophageal Atresia With or Without Tracheoesophageal Fistula. eMedicine Pediatrics, 2006. [dostęp 2007-08-17].
- ↑ Depaepe A., Dolk H., Lechat M.F.. The epidemiology of tracheo-oesophageal fistula and oesophageal atresia in Europe. EUROCAT Working Group. „Arch Dis Child”. 68, s. 743–8, 1993. PMID: 8333763.
- ↑ Sadler T.: Langman’s medical embryology. Wyd. 9th ed. Baltimore: Lippincott Wilkins and Williams, 2003, s. 276-277. ISBN 0-7817-4310-9.
- ↑ Williams A.K., Quan Q.B., Beasley S.W.. Three-dimensional imaging clarifies the process of tracheoesophageal separation in the rat. „J Pediatr Surg”. 38, s. 173–7, 2003. PMID: 12596097.
- ↑ Qi B.Q., Beasley S.W.. Stages of normal tracheo-bronchial development in rat embryos: resolution of a controversy. „Dev Growth Differ”. 42, s. 145–53, 2000. PMID: 10830438.
- ↑ Digilio M.C., Marino B., Bagolan P., Giannotti A., Dallapiccola B.. Microdeletion 22q11 and oesophageal atresia. „J Med Genet”. 36, s. 137–139, 1999. PMID: 10051013.
- ↑ Marsh A.J., Wellesley D., Burge D., Ashton M., Browne C., Dennis N.R., Temple K.. Interstitial deletion of chromosome 17 (del(17)(q22q23.3)) confirms a link with oesophageal atresia. „J Med Genet”. 37, s. 701–4, 2000. PMID: 11182929.
- ↑ Clementi M., Di Gianantonio E., Pelo E., Mammi I., Basile R.T., Tenconi R.. Methimazole embryopathy: delineation of the phenotype. „Am J Med Genet”. 83, s. 43–46, 1999. PMID: 10076883.
- ↑ Ozgen M.H., Reuvers-Lodewijks W.E., Hennekam R.C.. Possible teratogenic effects of thiamazole. „Ned Tijdschr Geneeskd”. 150. 2, s. 101-104, 2006. PMID: 16440566.
- ↑ van Bokhoven H., Celli J., van Reeuwijk J., Rinne T., Glaudemans B., van Beusekom E., Rieu P., Newbury-Ecob R.A., Chiang C., Brunner H.G.. MYCN haploinsufficiency is associated with reduced brain size and intestinal atresias in Feingold syndrome. „Nat Genet”. 374, s. 65–67, 2005. PMID: 15821734.
- ↑ Celli J., van Bokhoven H., Brunner H.G.. Feingold syndrome: clinical review and genetic mapping. „Am J Med Genet A.”. 122, s. 294–300, 2003. PMID: 14518066.
- ↑ FitzPatrick D.R., Magee A., Fiedler Z., Turnpenny P., Schneider A., Messina M., Hever A., Williamson K.A., van Heyningen V.. Mutations in SOX2 cause Rogers syndrome (anophthalmia, tracheo-esophageal fistula and genitourinary anomalies). „The American Society of Human Genetics Annual Meeting”. Session 54. 190, 2004.
- ↑ Tellier A.L., Cormier-Daire V., Abadie V., Amiel J., Sigaudy S., Bonnet D., de Lonlay-Debeney P., Morrisseau-Durand M.P., Hubert P., Michel J.L., Jan D., Dollfus H., Baumann C., Labrune P., Lacombe D., Philip N., LeMerrer M., Briard M.L., Munnich A., Lyonnet S.. CHARGE syndrome: report of 47 cases and review. „Am J Med Genet”. 76, s. 402–409, 1998. PMID: 9556299.
- ↑ Vissers L.E., van Ravenswaaij C.M., Admiraal R., Hurst J.A., de Vries B.B., Janssen I.M., van der Vliet W.A., Huys E.H., de Jong P.J., Hamel B.C., Schoenmakers E.F., Brunner H.G., Veltman J.A., van Kessel A.G.. Mutations in a new member of the chromodomain gene family cause CHARGE syndrome. „Nat Genet”. 36, s. 955–7, 2004. PMID: 15300250.
- ↑ Gupta K., Vankalakunti M., Sachdeva M.U.. Glomerulocystic Kidney Disease and its rare associations: an autopsy report of two unrelated cases. „Diagnostic Pathology”. 2. 12, 2007. PMID: 17459157.
- ↑ Vogt E.G.. Congenital esophageal atresia. „Am J Roentgenol”. 22, s. 463-460, 1929.
- ↑ Ladd WE: The surgical treatment of esophageal atresia and tracheoesophageal fistulas. „New England Journal of Medicine”. 230, s. 625-637, 1944.
- ↑ Gross R.E.: The surgery of infancy and chilhood. Philadelphia: WB Saunders, 1953.
- ↑ Lambrecht W., Kluth D.. Esophageal atresia: a new anatomic variant with gasless abdomen. „J Pediatr Surg”. 29. 4, s. 564-565, 1994. PMID: 8014817.
- ↑ Kluth D.. Atlas of esophageal atresia. „J Pediatr Surg”. 11, s. 901–19, 1976. PMID: 1003302.
- ↑ Oesophagal Atresia. W: Michael E. Höllwarth, Paola Zaupa: Pediatric Surgery. P. Puri, M. E. Höllwarth (Eds.). Berlin-Heidelberg-New York: Springer, s. 29-48. ISBN 3-540-40738-3.
- ↑ Chittmittrapap S., Spitz L., Kiely E.M., Brereton R.J.. Oesophageal atresia and associated anomalies. „Arch Dis Child”. 64. 3, s. 364-368, 1989. PMID: 2705799.
- ↑ Estroff J.A., Parad R.B., Share J.C., Benacerraf B.R.. Second trimester prenatal findings in duodenal and esophageal atresia without tracheoesophageal fistula. „J Ultrasound Med”. 13. 5, s. 375-379, 1994. PMID: 8015045.
- ↑ Kimura K., Soper R.T.. Multistaged extrathoracic esophageal elongation for long gap esophageal atresia. „J Pediatr Surg”. 29. 4, s. 566-568, 1994. PMID: 8014818.
- ↑ Takamizawa S., Nishijima E., Tsugawa C., Muraji T., Satoh S., Tatekawa Y., Kimura K.. Multistaged esophageal elongation technique for long gap esophageal atresia: experience with 7 cases et a single institution. „J Pediatr Surg”. 40, s. 781-784, 2005. PMID: 15937813.
- ↑ Chittmittrapap S., Spitz L., Kiely E.M., Brereton R.J.. Anastomotic leakage following surgery for esophageal atresia. „J Pediatr Surg”. 27. 1, s. 29-32, 1992. PMID: 1552439.
- ↑ Gutierrez San Roman C., Barrios J.E., Lluna J., Ibanez V., Hernandez E., Ayuso L., Valdes E., Roca A., Marco A., Garcia-Sala C.. Long-term assessment of the treatment of recurrent tracheoesophageal fistula with fibrin glue associated with diathermy. „J Pediatr Surg”. 41. 11, s. 1870-1873, 2006. PMID: 17101361.
- ↑ Hoelzer D.J., Luft J.D.. Successful long-term endoscopic closure of a recurrent tracheoesophageal fistula with fibrin glue in a child. „Int J Pediatr Otorhinolaryngol”. 48. 3, s. 259-263, 1999. PMID: 10402124.
- ↑ Chittmittrapap S., Spitz L., Kiely E.M., Brereton R.J.. Anastomotic stricture following repair of esophageal atresia. „J Pediatr Surg”. 25. 5, s. 508-511, 1990. PMID: 2352084.
- ↑ Corbally M.T., Spitz L., Kiely E., Brereton R.J., Drake D.P.. Aortopexy for tracheomalacia in oesophageal anomalies. „Eur J Pediatr Surg”. 3. 5, s. 264-266, 1993. PMID: 8292576.
- ↑ a b c Spitz L., Kiely E.M., Morecroft J.A., Drake D.P.. Oesophageal atresia: at-risk groups for the 1990s. „J Pediatr Surg”. 29. 6, s. 723-725, 1994. PMID: 8078005.
- ↑ Lopez P.J., Keys C., Pierro A., Drake D.P., Kiely E.M., Curry J.I., Spitz L.. Oesophageal atresia: improved outcome in high-risk groups?. „J Pediatr Surg”. 41. 2, s. 331-334, 2006. PMID: 16481246.
Linki zewnętrzne
- Geoffrey Blair: Esophageal Atresia With or Without Tracheoesophageal Fistula. eMedicine Pediatrics, 2006. [dostęp 2007-08-17].
- TRACHEOESOPHAGEAL FISTULA WITH OR WITHOUT ESOPHAGEAL ATRESIA w bazie Online Mendelian Inheritance in Man (ang.)
- Krystyna Knypl: ATREZJA PRZEŁYKU. 101 pytań i odpowiedzi. Warszawa: 2017, s. 200. ISBN 978-83-939070-2-1.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: see above, Licencja: CC BY 2.0
The operative repair of an oesophageal atresia and distal tracheooesophageal fistula
Autor: see above, Licencja: CC BY 2.0
Plain X-ray of the chest and abdomen showing the radio-opaque tube in the blind upper oesophageal pouch
Autor: unknown, Licencja: CC BY 2.0
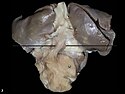
Gross photo of tracheo-esophageal fistula type A; child died within 3 hours after birth. Oesophageal atresia with tracheo-oesophageal fistula of type A was noted with a fistulous connection between the distal segment of oesophagus and the lower end of trachea.
Autor: see above, Licencja: CC BY 2.0
Common anatomical types of oesophageal atresia a) Oesophageal atresia with distal tracheooesophageal fistula (86%). b) Isolated esophageal atresia without tracheooesophageal fistula (7%). c) H-type tracheooesophageal fistula (4%)