Bazydiospora
Bazydiospora, zarodnik podstawkowy (łac. basidiospora) – rodzaj zarodnika wytwarzany przez grzyby z gromady podstawczaków (Basidiomycota). Powstaje w wyniku mejozy, należy więc do grupy mejospor[1].
Wytwarzanie i rola bazydiospor
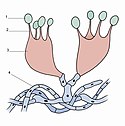
Wytwarzanie bazydiospor to jeden z etapów cyklu rozwojowego grzybów. U pieczarniaków (Agaricomycetes) z grzybni powstaje owocnik, na nim hymenofor, a w jego hymenium wytwarzane są specjalne struktury zwane podstawkami (basidium). To na nich wytwarzane są bazydiospory. Po rozprzestrzenieniu się kiełkują, wytwarzają grzybnię i cykl się powtarza[2]. Niektóre rodzaje bazydiospor nazywane bywają sporydiami (np. powstające u rodziny rdzowatych Pucciniaceae)[3]. U grzybów wytwarzających hymenofor blaszkowy bazydiospory powstają na ostrzach blaszek, czasami jednak na bokach – są to pleurospory[4].
U grzybów podstawkowych strzępki są dikarionami, tzn. w każdej komórce posiadają po dwa haploidalne jądra. Gdy grzyb wytwarza owocniki, w znajdujących się w nich podstawkach dochodzi do kariogamii, czyli zlania się jąder. Powstaje jedno jądro diploidalne. Po tym następuje mejoza, w wyniku której z każdego jądra powstają 4 jądra haploidalne. Na wierzchołku podstawki w tym czasie wytwarzane są wyrostki zwane sterygmami. Najczęściej na każdej podstawce powstają po 4 sterygmy. Do każdej z nich przechodzi jedno jądro i powstaje z niego bazydiospora, która wkrótce otacza się grubą błoną i odpada od sterygmy[3].
Dzięki rozmnażaniu płciowemu bazydiospory zapewniają gatunkowi różnorodność genetyczną. U podstawczaków są głównym sposobem rozmnażania się. Są głównie memnosporami, czyli zarodnikami przeznaczonymi do rozprzestrzeniania się i rozmnażania[2].
Budowa bazydiospor
Bazydiospory są zazwyczaj jednokomórkowe (bez przegród) i zwykle mają kształt kulisty, owalny, podłużny, elipsoidalny lub cylindryczny. Powierzchnia zarodników może być dość gładka lub może być urzeźbiona: szorstka, brodawkowata (guzkowata), brodawkowato-siatkowata, siatkowata, z błoniastymi wyrostkami (epicutis, calyptra) lub kolczasta. Mogą być hialinowe (szkliste) lub barwne. Barwę zwykle nadaje im ich ściana komórkowa, chociaż w rzadkich przypadkach – jak np. u Clavaria helicoides za barwę odpowiada cytoplazma. W ścianie wyróżnia się 5 warstw: endosporium, episporium, exosporium, perisporium i ektosporium. Ściana zawiera chitynę i glukan, co jest cechą charakterystyczną wyłącznie dla grzybów[2].
Długość bazydiospor może wynosić od 2,3–3 μm u gęśnicy czerwonawej (Rugosomyces chrysenteron) do 16 μm u monetki bukowej (Oudemansiella mucida), a to przy mniej więcej kulistym kształcie oznacza, że ich objętość waha się w granicach 1:350 u różnych gatunków. Zmienność rozmiarów w obrębie jednego gatunku zwykle waha się w granicach 20%. Zarodniki powstające na podkładkach 4-sterygmowych są zazwyczaj mniejsze od zarodników na podkładkach 2-sterygmowych. Gdy wystawione są przez dłuższy czas na działanie wilgoci pęcznieją, zwiększając swoje rozmiary. Drobne owocniki, a także starzejące się podstawki wytwarzają mniejsze zarodniki. U niektórych gatunków zmienność rozmiarów jest tak duża, że mówi się o ich różnozarodnikowości. Wielkość zarodników jest ważną cechą diagnostyczną przy rozróżnianiu gatunków. Aby otrzymać wiarygodne dane, do pomiaru identyfikacyjnego bierze się 10–20 zarodników z młodych i starych owocników w stanie świeżym, a przy eksykatach 25 lub więcej, następnie oblicza się wartość średnią (liczba Q)[2].
Wiele bazydiospor ma asymetryczny kształt ze względu na ich rozwój na podstawce. Na ich powierzchni w miejscu, w którym przyczepione były do sterygmy, zwykle występuje wyrostek wnęki (hilar appendage, apiculus). W niektórych zarodnikach jest on dobrze widoczny, w innych słabo i to również jest cechą diagnostyczną przy rozróżnianiu gatunków. U niektórych gatunków po przeciwległej stronie wnęki występuje pora rostkowa[2].
Rozprzestrzenianie bazydiospor
Występują 3 sposoby rozprzestrzeniania się bazydiospor:
- Większość bazydiospor to balistospory – zarodniki wyrzucane mechanicznie. Siła napędowa do tego wyrzutu pochodzi z nagłej zmiany środka ciężkości wyrzuconego zarodnika. Ważną rolę w wyrzucaniu balistospor odgrywa kropla Bullera, która może gromadzić się na proksymalnym końcu (wyrostek wnęki) każdej bazydiospory. Po osiągnięciu dojrzałości bazydiospor cukry obecne w ścianie komórkowej zaczynają służyć jako loci kondensacji pary wodnej w powietrzu. Kluczowe znaczenie mają dwa oddzielne obszary kondensacji. Na spiczastym czubku zarodnika (wnęki) najbliżej podstawy podtrzymującej gromadzi się duża, prawie kulista kropla wody. W tym samym czasie kondensacja zachodzi w cienkiej warstwie na doosiowej powierzchni zarodnika. Kiedy te dwa zbiorniki wodne połączą się, następuje uwolnienie napięcia powierzchniowego. Nagła zmiana środka masy prowadzi do nagłego wyrzucenia bazydiospor. N.P. Money oszacował początkowe przyspieszenie zarodnika na około 10 000g. Pomyślne uwolnienie bazydiospor może nastąpić tylko wtedy, gdy dostępna jest wystarczająca ilość pary wodnej do skondensowania się na zarodniku[5]. Balistospory wyrzucane są z podstawek na niewielką odległość, wystarczającą jednak, by uwolnione mogły zostać dalej rozniesione przez prądy powietrza. Wykazują specjalne przystosowania do tego celu, ale dla 90% bazydiispor odległość na jaką zostają przeniesione przez prądy powietrza nie przekracza 100 m. Szorstka powierzchnia umożliwia im przyczepienie się do podłoża, co ma szczególne znaczenie u grzybów nadrzewnych. Bazydiospory grzybów ektomykoryzowych zazwyczaj rozprzestrzeniają się w odległości do 1 m od owocnika[2].
- U grzybów z rodzin purchawkowatych i tęgoskórowatych bazydiospory nie są mechanicznie wyrzucane przez podstawki. Dojrzewający owocnik tych grzybów pęka, zarodniki zwane statismosporami oddzielają się od podstawek i przeważnie są uwalniane przez rozpryskujące się krople deszczu lub wiatr[2].
- U niektórych grup grzybów (np. w rzędzie sromotnikowców Phallales) także brak mechanizmu mechanicznego wyrzucania zarodników. Wykorzystują one do ich rozprzestrzeniania owady, które zwabiają zapachem[6].
Przypisy
- ↑ Janusz Błaszkowki, Mariusz Tadych, Tadeusz Madej, Przewodnik do ćwiczeń z fitopatologii, Szczecin: wyd. AR w Szczecinie, 1999, ISBN 83-87327-23-9.
- ↑ a b c d e f g Hans Halbwachs, Claus Bässler, Gone with the wind – a review on basidiospores of lamellate agarics, „Mycosphere”, 6 (1), 2015, s. 78–112, DOI: 0.5943/mycosphere/6/1/10, ISSN 7019 2077 7019 [dostęp 2022-03-12].
- ↑ a b Edmund Malinowski, Anatomia roślin, Warszawa: PWN, 1966.
- ↑ Wanda Rudnicka-Jezierska, Grzyby (Mycota). Podstawczaki (Basidiomycetes): purchawkowe (Lycoperdales), tęgoskórowe (Sclerodematales), pałeczkowe (Tulostomatales), gniazdnicowe (Nidulariales), sromotnikowe (Phallales), osiakowe (Podaxales), t. 23, Kraków: Instytut Botaniki PAN, 1991, ISBN 83-85444-01-7.
- ↑ N.P. Money, More g’s than the Space Shuttle: ballistospore discharge, „Mycologia” (90), 1998, s. 547–558.
- ↑ C.T. Ingold, A view of the active basidium in heterobasidiomycetes, „Mycological Research” (95), 1991, s. 618–621.
Media użyte na tej stronie
Autor: Vadthanarat S, Raspé O, Lumyong S (2018) Phylogenetic affinities of the sequestrate genus Rhodactina (Boletaceae), with a new species, R. rostratispora from Thailand. MycoKeys 29: 63-80. https://doi.org/10.3897/mycokeys.29.22572, Licencja: CC BY 4.0
Figure 4E-F; Scanning electron micrographs of basidiospores. Rhodactina rostratispora (O. Raspé 1055) showing the basidiospores with 8–9 longitudinal ridges, the wide and prominent hilar appendage (ha), a terminal hilum (th) and anastomosing ridges in some spores (as).
Autor: Prof. Meike Piepenbring, Licencja: CC BY-SA 3.0
Diagramm/Zeichnung von Prof. Meike Piepenbring freigegeben.
Autor: Liu S-L, He S-H (2018) Taxonomy and phylogeny of Dichostereum (Russulales), with descriptions of three new species from southern China. MycoKeys 40: 111-126. https://doi.org/10.3897/mycokeys.40.28700, Licencja: CC BY 4.0
Figure 6; Scanning electron micrographs (SEM) of basidiospores of Dichostereum. a D. austrosinense (holotype, He 4871) b D. boidinii (holotype, He 5026) c D. eburneum (holotype, He 5374) d D. granulosum (He 1887) e D. pallescens (He 3266) f D. rhodosporum (Dai 18625A). Scale bar: 1 µm.