Czapla modra
| Ardea herodias[1] | |||
| Linnaeus, 1758 | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | czapla modra | ||
| Podgatunki | |||
| |||
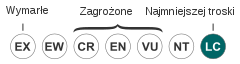
| Kategoria zagrożenia (CKGZ)[2] | |||
 | |||
| Zasięg występowania | |||
 Pora występowania Przebywa stale Odwiedza zimą Odwiedza latem, rozród Jedynie migruje | |||
Czapla modra (Ardea herodias) – gatunek dużego ptaka brodzącego z rodziny czaplowatych (Ardeidae), zamieszkującego w kilku podgatunkach różnego rodzaju tereny podmokłe i wybrzeża morskie Ameryki Północnej oraz wyspy Galapagos. Koczujące osobniki zauważono kilkakrotnie w zachodniej Europie[3]. Wszystkie (poza jednym) podgatunki migrują na południe na czas zimy. Czapla modra nie jest zagrożona wyginięciem (nadano jej pod tym względem kategorię LC – najmniejszej troski), jednak istotnym zagrożeniem dla niej jest utrata siedlisk[4].
Jest jednym z największych gatunków czapli (największym w Ameryce Północnej[5]), rozpiętość jej skrzydeł sięga niekiedy 2 metrów. Jest bardzo podobna do europejskiej czapli siwej, która jest jednak od niej nieco mniejsza. Można spotkać osobniki należące do dwóch odmian barwnych: szaro-niebieskiej i białej, a także różne formy pośrednie między nimi. Osobniki młodociane są całkowicie szare. Posiada na głowie charakterystyczny, czarny czub z piór, podobnie jak większość innych gatunków ptaków z podrodziny czapli. W locie można ją łatwo rozpoznać po „esowato” wygiętej szyi.
Wyprowadza najczęściej jeden lęg w roku. Gniazdo, mające kształt platformy, budowane jest zazwyczaj na drzewie. Gniazduje przede wszystkim w dużych i hałaśliwych koloniach lęgowych, rzadko indywidualnie. Pary łączą się ze sobą jedynie na jeden sezon. Nie ma wielu naturalnych wrogów, jednak jeżeli osobniki należące do kolonii zostaną w jej obrębie zaatakowane, inne ptaki mogą kolonię porzucić, jednak zachowania takie nie należą do reguły. Poluje głównie na ryby i inne zwierzęta wodne, które atakuje z zaskoczenia, brodząc w płytkiej wodzie. Dawniej była częstym obiektem polowań dla piór[4][6]. Obecnie w stosunku do człowieka jest nieufna i płochliwa.
Systematyka
Gatunek po raz pierwszy zgodnie z zasadami nazewnictwa binominalnego opisał w 1758 roku Karol Linneusz w 10. edycji swego dzieła Systema Naturae, pod nazwą systematyczną, którą nosi do dziś – Ardea herodias[7].
W Starym Świecie (Europa) ten gatunek został zastąpiony przez podobną czaplę siwą (A. cinerea), która jest nieco mniejsza i nieznacznie różni się kolorem upierzenia. Razem z czaplą siwą oraz południowoamerykańską czaplą czarnobrzuchą (A. cocoi) tworzą grupę blisko spokrewnionych gatunków, w języku angielskim określaną nazwą superspecies („nadgatunek”).
Kryterium podziału na podgatunki stanowią różnice w upierzeniu, morfologii oraz zachowania migracyjne[8]. Obecnie wyróżnia się cztery lub pięć podgatunków[1][9][10]:
- Ardea herodias fannini Chapman, 1901 – Wybrzeże Północno-Zachodnie od południowej Alaski do Seattle[11].
- Ardea herodias herodias Linnaeus, 1758 (podgatunek nominatywny) – czapla modra[12] – od południowej Kanady po środkową część Stanów Zjednoczonych[9].
- Ardea herodias wardi Ridgway, 1882 – stany Kansas i Oklahoma do północnej Florydy[10] oraz zachodni i północno-wschodni Meksyk[9].
- Ardea herodias occidentalis Audubon, 1835 – czapla karaibska[12] – południowa Floryda i Karaiby[9].
- Ardea herodias cognata – wyspy Galapagos[9].
Niektórzy systematycy wyróżniają jeszcze kilka podgatunków[13][14], lecz ich pozycja taksonomiczna jest sporna i nie są akceptowane przez większość autorów[1][9][12][10]:
- Ardea herodias adoxa Oberholser, 1912
- Ardea herodias hyperonca Oberholser, 1912 – wybrzeża stanów Oregon i Kalifornia.
- Ardea herodias lessoni Wagler 1831
- Ardea herodias olgista Oberholser, 1912
- Ardea herodias repens Bangs & Zappey, 1905
- Ardea herodias sanctilucae Linnaeus, 1758 – południowa część Półwyspu Kalifornijskiego.
- Ardea herodias treganzai Court, 1908
Osobniki o białym upierzeniu występujące na Florydzie i Karaibach były wcześniej uważane za odrębny gatunek Ardea occidentalis. Tę klasyfikację popiera m.in. współczesny amerykański ornitolog David Allen Sibley[15]. Obecnie białe osobniki są uważane za podgatunek[1][9] lub gatunek[16], w zależności od autora.
Charakterystyka
Jeden z największych przedstawicieli czaplowatych, rozmiarem ustępuje jedynie czapli olbrzymiej i czapli białobrzuchej.
Wymiary średnie
- długość ciała (od głowy do ogona) ok. 91–140 cm
- wysokość w pozycji stojącej z wyciągniętą szyją ok. 100 cm
- rozpiętość skrzydeł ok. 167–201 cm
- masa ok. 2–3,6 kg[17].
Upierzenie i wygląd zewnętrzny
Przeważające upierzenie w kolorze szaro-niebieskim, jaśniejsze latem i ciemniejsze zimą. Czarne lotki, czerwono-brązowe uda, para brązowych lub czarnych plam na nadgarstkach, rdzawo- lub cynamonowo-szara szyja, pióra paskowane poniżej białego gardła i na piersi. Głowa jaśniejsza, maska biała, ciemne czoło i ciemię, czarny czub, jasnożółte tęczówki. Para charakterystycznych długich czarnych piór wyrastających nad oczami (przedłużenie czarnych brwi) i opadających z tyłu głowy. Posiada pióra pudrowe, które rozkrusza i używa powstałego proszku do czyszczenia i zabezpieczania upierzenia. Zaostrzony, żółty dziób, długie nogi pokryte ciemnym włosiem[18]. Skrzydła długie i szerokie, krótki ogon. Młode osobniki mają ciemniejsze upierzenie o bardziej jednolitym kolorze, ciemnoszary czub i żółto-zielony dziób[19]. Nie mają piór ozdobnych[18].
W szacie godowej długie pióra na piersi, plecach i bokach oraz pióra puchowe na dole szyi i plecach. Jasnożółty dziób i rdzawe nogi na początku okresu godowego[20].
Brak wyraźnie zaznaczonego dymorfizmu płciowego, samiec i samica wykazują nieznaczne różnice w odcieniu upierzenia i rozmiarze. Samiec jest zwykle 5–10%[17] większy[18]. Stwierdza się polimorfizm – występują dwa podstawowe typy upierzenia: charakterystyczny szaro-niebieski i całkowicie biały. Osobniki z białym upierzeniem (brak pigmentu w piórach) różnią się także budową dzioba i długością piór na głowie. Występuje także typ pośredni (w Stanach Zjednoczonych nazywany czaplą Würdemanna[21]) posiadający typowe dla gatunku szaro-niebieskie upierzenie, lecz głowa jest biała[17]. Ten typ czapli modrej zamieszkuje archipelag Florida Keys[22].
- Rodzaje upierzenia
Upierzenie szare i białe
Czarne lotki i brązowe plamy na nadgarstkach widoczne w locie
Występowanie
Środowisko
Występuje na zróżnicowanych siedliskach takich jak słodkowodne jeziora, rzeki o powolnym nurcie, słonawe bagna, laguny, lasy namorzynowe i przybrzeżne mokradła[19]. Rzadko występuje na dużych wysokościach, zaobserwowano czaplę modrą na wys. do 1500 m n.p.m. w Panamie[23].
Zasięg występowania
Gniazduje w południowo-wschodniej Alasce, południowej Kanadzie (prowincje: Kolumbia Brytyjska, Alberta, Manitoba, Ontario, Quebec, Nowy Brunszwik, Wyspa Księcia Edwarda i Nowa Szkocja), na terenie Stanów Zjednoczonych oraz Meksyku (po stany Guerrero i Veracruz) i na Wyspach Galapagos[24]. Zimuje na wschodnich wybrzeżach Stanów Zjednoczonych i Kanady oraz w Meksyku, na Karaibach i Antylach, w północnej Kolumbii, Wenezueli, zachodnim Ekwadorze i na Wyspach Galapagos[19][24]. Rzadko dociera do Europy, aczkolwiek zaobserwowano osobniki na Azorach, w Hiszpanii, Anglii i Holandii[3].
Migracje
Migrują na południe zimą (wrzesień – październik) i na północ latem (od połowy marca do końca kwietnia). Najczęściej przemieszczają się same lub w małych grupach, chociaż zaobserwowano także migrujące grupy liczące ok. 100 osobników. Zamieszkujący Wybrzeże Północno-Zachodnie podgatunek A. herodias fannini jest jedynym, który nie migruje[25]. Niewielka część populacji migrujących podgatunków pozostaje przez cały rok na swoim terytorium, jeżeli ma dostęp do niezamarzającego zbiornika wodnego (np. niezamarzające rzeki w okolicach Nowej Anglii). Jednak jeśli woda zamarza zimą, co uniemożliwia zdobycie pożywienia, czapla modra przenosi się bardziej na południe, na wybrzeża lub wyspy[26].
Pożywienie
Żeruje głównie w płytkich (do 50 cm głębokości), często zarośniętych wodach, bagnistych zbiornikach i leśnych mokradłach, rzadziej na suchych terenach. Podczas żerowania czatuje stojąc nieruchomo, cierpliwie czeka, aż ofiary przyzwyczają się do jej obecności i przestaną traktować ją jak drapieżnika. Żerując na rzece lub w strumieniu ustawia się, lub powoli przemieszcza pod prąd wody. W wodzie stojącej może naganiać zdobycz rozkładając skrzydła i uderzając ich końcówkami o taflę wody lub burząc wodę nogami[21]. Dziobie i smakuje, powoli spaceruje lub atakuje szybkim, gwałtownym ruchem. Podlatuje, przysiada, unosi się nad wodą wypatrując zdobycz, nurkuje głową do przodu lub wskakuje nogami do wody, pływa lub unosi się na powierzchni. Zaobserwowano nurkowanie w głębszej wodzie, lecz nie jest to typowe zachowanie dla tego gatunku[19].
Zwykle połyka zdobycz w całości, często obraca nią w powietrzu, aby ustawić ją w łatwiejszej do przełknięcia pozycji. W przypadku, gdy złowi dużą rybę, może zabić ją dziobem[27] lub uderzając nią o ziemię (wielokrotnie upuszczając i podnosząc, aż znieruchomieje). Próby połknięcia zbyt dużej ofiary mogą prowadzić do zadławienia i śmierci[21]. Trawi kości, ale nie trawi sierści, jeżeli upoluje gryzonia lub małego ssaka, to wydala niestrawione resztki w postaci wypluwki. Żeruje dniem i nocą (dobrze widzi w ciemności[21][26]), ale najczęściej o świcie i o zmroku, zwykle samotnie, w grupie poluje w miejscach o dużej ilości pożywienia, gdzie obrona własnego żerowiska jest niemożliwa.
Ulubionym pożywieniem są ryby (do ok. 30 cm długości[27]), ale poluje także na ropuchy, kijanki, traszki, jaszczurki, węże, małe ssaki i gryzonie, ptaki, kraby, raki, ślimaki i owady. Zjada także padlinę[19].
Tryb życia i zachowanie
Wykazują terytorializm w zależności od płci, wieku i pory roku. Samce bronią swojego terytorium przez cały rok, a samice w okresie gniazdowania. Jeżeli obrona nie wymaga opuszczenia gniazda, para będzie go razem bronić (najczęściej atakując dziobem). Młode osobniki oraz dorosłe samice nie są terytorialne na zimowych żerowiskach[26].
Maskują się pośród roślin, nieruchomiejąc z wyciągniętą pionowo do góry szyją i dziobem, delikatnie poruszając ciałem do przodu i do tyłu w rytm wiatru. Szaro-niebieski kolor upierzenia sprawia, że nie wyróżnia się w wodzie ani na tle nieba o świcie lub zmroku, gdy żerują[28].
W sytuacji stresowej, lub w reakcji na zagrożenie młode osobniki zwracają zawartość żołądka[20]. To zachowanie sprawia, że trudno jest uratować chore lub osłabione młode, które trafiają pod opiekę człowieka. Zaobserwowano również, że dorosłe sępniki różowogłowe specjalnie drażnią młode czaple, aby ukraść zwrócony przez nie pokarm i nakarmić nim swoje młode[29].
Lot
W trakcie lotu czapla esowato zgina szyję[30]. Nie robi tego, gdy podrywa się do lotu lub przelatuje krótki odcinek[23]. Widoczne podczas lotu lotki są ciemne, niemal czarne[17], nogi utrzymuje wyciągnięte wzdłuż osi ciała. Powoli, miarowo i głęboko uderza skrzydłami[18] i często krzyczy. Lata z prędkością 32–48 km/h[17], wykonuje ok. 2,3–3,2 uderzeń skrzydeł na sekundę[23].
Krok
Krok długości ok. 22 cm, stawiany niemal w linii prostej. Dwa z trzech przednich placów są zwykle zbliżone do siebie, między szerzej rozstawionymi palcami występuje niewielka błona pławna. Na odcisku stopy często widoczne są pazury, zarówno przednie, jak i tylne. Pazur na środkowym przednim palcu ma zębaty brzeg przypominający grzebień, służy do pielęgnacji upierzenia i rozprowadzania proszku z piór pudrowych[21].
Głos
Odzywa się ostrym głosem, przypominającym ochrypłe, gardłowe krakanie[18], może także wydawać dźwięki określane jako ryczenie lub gdakanie, lub stukać dziobem. Najgłośniejsza w okresie godowym, może odezwać się o każdej porze roku, gdy czuje się zagrożona lub w czasie terytorialnych sporów[31].
Długość życia
Samiec i samica osiągają dojrzałość płciową po ok. 22 miesiącach. Średnia długość życia na wolności to 15–17 lat[26], maksymalna zanotowana to 23 lata[32].
Śmiertelność w pierwszym roku życia wynosi ok. 69%, w drugim 36,3% oraz 21,9% w kolejnych latach[25]. Udokumentowane przyczyny śmierci to: choroby, drapieżnictwo (głównie w przypadku młodych), zima, kłusownictwo, zakrztuszenie oraz chemiczne zanieczyszczenie środowiska. Młode są także narażone na śmierć głodową, zmiany pogody i wypadnięcie z gniazda (przypadkowe lub za sprawą silniejszego rodzeństwa). Pestycydy są możliwą przyczyną słabnięcia skorupy jaja (staje się zbyt cienka), które negatywnie wpływa na sukces rozrodczy. Udokumentowano również zatrucie środkami owadobójczymi takimi jak DDT i dieldryna jako bezpośrednią przyczynę śmierci[5]. Czaple giną też często wpadając na druty elektryczne[26].
Ten gatunek jest nosicielem pasożytniczych nicieni Eustrongylides ignotus, które mogą doprowadzić do śmierci. Zarażenie następuje przez spożycie ryb z larwami nicienia, które następnie przebijają ściany żołądka powodując zapalenie otrzewnej i atrofię narządów wewnętrznych. Szczególnie narażone są młode osobniki, które mogą umrzeć na skutek wywołanych przez nicienia krwotoków wewnętrznych lub powiązanych infekcji bakteryjnych[33]. Różne podgatunki zarażają się również czaplim wirusem zapalenia wątroby typu B (HHBV)[34].
Naturalni wrogowie
Dorosłe czaple modre ze względu na duże rozmiary oraz fakt, że znajdują się na szczycie łańcucha pokarmowego, mają niewielu naturalnych wrogów, głównie ptaki drapieżne i szopy[35].
Jednym z najważniejszych drapieżników zagrażających czaplom jest bielik amerykański, którego areał osobniczy pokrywa się w dużej mierze z areałem czapli modrej. Gniazda bielika znajdują się w pobliżu większych kolonii czapli lub nawet na ich terenie. Przypuszcza się, że bieliki strzegące swojego terytorium jednocześnie chronią czaple przed innymi drapieżnikami. Jednakże zarówno dorosłe bieliki, jak i ich potomstwo polują wewnątrz kolonii[4].
Inne drapieżniki polujące na jaja i młode to m.in.: sępnik różowogłowy, różne ptaki z rodziny krukowatych, jastrzębie, niedźwiedzie i szopy. Ostatnie dwa stanowią zagrożenie także dla dorosłych osobników. Mogą być porwane także przez puchacza wirginijskiego[20][36]lub rzadziej przez myszołowa rdzawosternego[17]. W przypadku kiedy dorosły osobnik lub młode zostaną zaatakowane, kolonia może zostać porzucona przez pozostałe ptaki, aczkolwiek takie zachowanie nie stanowi reguły[20].
Żerujące w wodzie czaple są narażone na ataki aligatorów, którym jednak rzadko udaje się je złowić[32].
Rozród
Gniazdo


Najczęściej gniazduje w koloniach, często w towarzystwie kormoranów rogatych, ślepowronów lub innych gatunków czapli, sporadycznie w odosobnionych parach[26]. Wybór miejsca na założenie kolonii jest uwarunkowany kilkoma czynnikami. Często jest to obszar odosobniony (wyspy lub bagna oraz wysokie drzewa są wybierane w celu ograniczenia dostępu drapieżnikom), znajdujący się w pobliżu żerowisk (średnia odległość 2,3 km, maks. 12 km) i obfitujący w materiał do budowy gniazd[4]. Niektóre kolonie są zajmowane przez wiele konsekutywnych lat, jednak ptaki często przenoszą się w inne miejsce po 1-2 latach. Mogą także powrócić do dawnej kolonii po kilku latach. Powrót do kolonii zależy również od wytrzymałości drzew na zbierające się wokoło guano i jego fitotoksyczny charakter. Niektóre drzewa mogą z tego powodu umrzeć w ciągu dekady[21].
Gniazda buduje zarówno na iglastych, jak i liściastych drzewach (na wysokości 20–50 m), w pobliżu jezior, mokradeł lub innych zbiorników wodnych, rzadziej na ziemi lub strukturach wzniesionych przez człowieka (np. na słupach linii elektrycznych). Kolonie mogą liczyć 5-500 gniazd, średnio ok. 160. Wiele gniazd może znajdować się na tym samym drzewie, zwykle 1–5, ale zaobserwowano nawet 32 sztuki[37]. Samiec i samica wspólnie budują gniazdo. Samiec zbiera materiał (gałązki, liście, trawę, igliwie, mech, trzcinę) z ziemi, drzew lub niestrzeżonych gniazd, a następnie oddaje go samicy, która zajmuje się budową[38]. Dość niezgrabne gniazdo jest uzupełniane w ciągu całego okresu gniazdowania, może być odnawiane i używane rokrocznie przez różne pary. Rozmiar gniazda zależy od jego wieku, nowe może mieć do 0,5 m średnicy, starsze (wielokrotnie uzupełniane) do 1 m i ok. 50 cm głębokości[31].
Okres godowy
Samce jako pierwsze powracają do zeszłorocznych kolonii, zajmują gniazdo, którego będą zaciekle bronić, krzycząc i nacierając na ewentualnego przeciwnika z otwartym dziobem i rozłożonymi skrzydłami[20]. Te czaple co roku wybierają nowych partnerów. Po przybyciu samic łączą się w pary i rozpoczynają toki. Jednym z elementów godów jest przynoszenie przez samca materiału do budowy gniazda. Samica wita go wyciągając szyję i dziób prosto do góry i jednocześnie przysiadając. Unosi pióra na szyi, plecach i piersi oraz kracze. Również samiec stroszy pióra na głowie i plecach oraz wydaje serię krótkich dźwięków. Częsty jest też taniec po okręgu, krzyżowanie szyi, uderzanie dziobami, szczypanie, wzajemne skubanie i gładzenie piór[28][39]. Kopulacja, poprzedzana przez zaloty, prawie zawsze odbywa się w gnieździe, rzadziej na sąsiadującej gałęzi. Zbliżenie trwa średnio 12–15 sekund[20]. W czasie toków ptaki te są bardzo wrażliwe na hałas i obecność potencjalnych agresorów (także człowieka) oraz podatne na porzucenie gniazda. Od momentu złożenia jaj więź z gniazdem rośnie i ryzyko porzucenia maleje[4].
Okres lęgowy

Okres lęgowy trwa od marca do maja w północnej części obszaru występowania oraz od listopada do kwietnia w części południowej. Typowy lęg odbywa się raz do roku, samica składa 3–7 (średnio 4) jasnych zielono-niebieskich jaj o wymiarach ok. 61–63 mm x 42–46 mm[17] i masie 65–75 g. Jaja są składane w 2–3-dniowych odstępach[17][26]. Jeżeli gniazdo zostanie zniszczone lub porzucone, samica może złożyć nowe jaja. Obecność człowieka źle wpływa na rozmnażanie tego gatunku. Wielokrotne wtargnięcie na obszar gniazdowania może spowodować porzucenie jaj lub młodych. Para wysiaduje jaja na zmianę, samica głównie w nocy, a samiec w ciągu dnia. Okres inkubacji trwa 25-29 dni, młode (gniazdowniki) wykluwają się niejednocześnie w przeciągu kilku dni[17]. Pisklę, które wykluje się pierwsze, często szybciej rośnie – jest bardziej doświadczone w przyjmowaniu pokarmu i może zachowywać się agresywnie w stosunku do młodszego rodzeństwa. W okresie karmienia rodzice spożywają nawet do 4 razy więcej pokarmu niż zwykle. Oboje rodzice karmią młode poprzez regurgitację, podają pokarm bezpośrednio do otwartego dzioba stojąc na krawędzi gniazda[38]. Młode otrzymują pokarm w ten sposób przez około pierwszych 10 dni, później same wkładają dziób do gardła rodziców, aż w końcu rodzice wrzucają zdobycz prosto do gniazda[20]. Młode odbywają pierwszy lot po ok. 60 dniach od wyklucia. Zdarza się, że po wykonaniu pierwszych lotów młode omyłkowo wracają do innego gniazda, co może zakończyć się wyrzuceniem właściwych lokatorów. Definitywnie opuszczają gniazdo po 60-91 dniach w zależności od wieku (kolejności wyklucia) oraz pory lęgu – młode z późniejszych lęgów usamodzielniają się wcześniej[26].
Status, zagrożenie i ochrona
Międzynarodowa Unia Ochrony Przyrody (IUCN) stosuje ujęcie systematyczne według listy ptaków świata opracowywanej we współpracy BirdLife International z autorami Handbook of the Birds of the World[40] i od 2020 roku dzieli ten takson na dwa osobne gatunki, które klasyfikuje następująco:
- czapla modra (Ardea herodias) – gatunek najmniejszej troski (LC – Least Concern); w 2019 roku organizacja Partners in Flight szacowała, że liczebność populacji mieści się w przedziale 500 000 – 4 999 999 dorosłych osobników; trend liczebności uznawany jest za lekko wzrostowy[2],
- czapla karaibska (Ardea occidentalis ) – gatunek zagrożony (EN – Endangered); liczebność populacji szacowana na 1000–2499 dorosłych osobników, ale raczej bliżej dolnej granicy; trend liczebności uznawany za spadkowy[41].
Zagrożenie tego gatunku jest związane z działalnością człowieka, a w szczególności z niszczeniem naturalnych siedlisk oraz zakłócaniem spokoju w okresie gniazdowania. Podstawą dla ochrony czapli modrej jest regularne śledzenie liczebności populacji i analiza sukcesu rozrodczego. Istotne jest także przyjazne dla czapli zagospodarowanie przestrzenne, uwzględniające terytorialne potrzeby gatunku[38]. Różne organizacje, takie jak kanadyjska MARS (Mountainaire Avian Rescue Society) zajmują się ochroną gatunku oraz ratowaniem chorych i rannych osobników[29].
Obserwacja
Systematyczne obserwacje z udziałem wolontariuszy są prowadzone w wielu stanach m.in. w Michigan, gdzie gatunek ten gniazduje od kwietnia do lipca, oraz nad Zatoką Meksykańską, gdzie obserwuje się liczne grupy w drugiej połowie grudnia[38]. Czapla modra jest płochliwa, ale kiedy żeruje, pozwala człowiekowi zbliżyć się na niewielką odległość, jest wtedy bardzo skoncentrowana. W czasie obserwacji w okresie gniazdowania należy pamiętać o zachowaniu bezpiecznej odległości i ciszy, gdyż wtedy jest bardzo wrażliwa na hałas. Zaniepokojona przez człowieka znajdującego się w odległości kilkuset metrów może porzucić lęg[26].
Znaczenie w życiu i kulturze człowieka
Indianie Nisqually (plemię z okolic Waszyngtonu) nazywali czaplę modrą swoim dziadem. Według ich tradycji mężczyźni, którzy kłócili się ze swoimi żonami, zostali zamienieni w czaple. Obecnie czapla modra widnieje na wielu znakach firmowych oraz jako element logo imprez muzycznych. Miasto Portland organizuje coroczny festiwal czapli modrej (Great Blue Heron Festival)[4], a w Sherman od 1992 roku odbywa się festiwal muzyki (Great Blue Heron Music Festival)[42].
Według amerykańskich obserwatorów głos wydawany przez ten gatunek brzmi fraaahnk i przypomina imię Frank, dlatego w niektórych regionach czapla modra jest nazywana Old Frankie[27].
Czapla modra stanowi zagrożenie dla prywatnych stawów i oczek, w których często hoduje się drogie ryby. Zwłaszcza kolorowe, egzotyczne okazy mocno przykuwają jej uwagę, jest w stanie powracać do tego samego miejsca, aż zje wszystkie ryby ze zbiornika[43].
Pod koniec XIX w. na wschodnim wybrzeżu Ameryki Północnej intensywnie polowano na czaple modre dla ich piór (m.in. do produkcji ozdób i damskich kapeluszy) oraz kolekcjonowano jaja. Czaple tępiono również ze względu na to, że stanowiły istotną konkurencję dla rybaków. Poławiacze homarów używali ich jako przynęty do pułapek. Rozwój miast i ekspansja człowieka na wybrzeżu przyczyniły się do drastycznego spadku populacji czapli modrej w tym okresie[4].
Przypisy
- ↑ a b c d Ardea herodias, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b Ardea herodias, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ a b Stanley Cramp, K.E.L. Simmons: Handbook of the Birds of the Western Palearctic Volume 1. Oxford University Press, 1977.
- ↑ a b c d e f g Ann Eissinger, Nahkeeta Northwest: Great Blue Herons in Puget Sound. Puget Sound Nearshore Partnership, czerwiec 2007. [dostęp 2012-06-22]. [zarchiwizowane z tego adresu (2013-04-08)]. (ang.).
- ↑ a b Laura Spess Jackson, James J. Dinsmore, Carol A. Thompson: Iowa Breeding Bird Atlas. University of Iowa Press, 1996, s. 52–53. ISBN 08-7745-572-4.
- ↑ Allen Hayward: The Great Blue Heron. NorthWord Press, 1991, s. 10. ISBN 15-597-1094-2.
- ↑ Carolus Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, wyd. 10, 1758, s. 237 (łac.).
- ↑ J. Hancock, H. Elliott: The Herons of the World. Nowy Jork: Harper and Row, 1978.
- ↑ a b c d e f g F. Gill, D. Donsker & P. Rasmussen (red.): Ibis, spoonbills, herons, hamerkop, shoebill, pelicans. IOC World Bird List (v10.1). [dostęp 2020-05-21]. (ang.).
- ↑ a b c Great Blue Heron (Ardea herodias). IBC: The Internet Bird Collection. [zarchiwizowane z tego adresu (2016-06-13)]. (ang.).
- ↑ Grand héron Ardea herodias fannini – sous-espèce fannini au Canada. British Columbia’s Wildlife at Risk, 2008. [dostęp 2013-04-15]. (fr.).
- ↑ a b c Paweł Mielczarek, Marek Kuziemko: Rodzina: Ardeidae Leach, 1820 - czaplowate - Herons. Wersja 2020-06-25. [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2022-11-03].
- ↑ R. W. Dickerman. A review of the North American subspecies of the Great Blue Heron (Ardea herodias). „Proceedings of the Biological Society of Washington”. 117 (3), s. 242–250, 2004. (ang.).
- ↑ Czapla modra (Ardea herodias) Linnaeus, 1758. Avibase. [dostęp 2012-07-30].
- ↑ D.A. Sibley: Sibley Guides Notebook. 05-11-2007. [dostęp 2012-06-22]. (ang.).
- ↑ Heather L. McGuire: Taxonomic status of the great white heron (Ardea herodias occidentalis): an analysis of behavioral, genetic, and morphometric evidence. Florida Game and Freshwater Fish Commission Nongame Project Report NG96-025, s. 1, czerwiec 2002. [dostęp 2014-05-05]. (ang.).
- ↑ a b c d e f g h i R.W. Butler: Great Blue Heron. W: A. Poole, P. Stettenhiem, F. Gill: The birds of North America. The Academy of Natural Sciences. Waszyngton: D.C. and American Ornithologists' Union, 1992.
- ↑ a b c d e Perrins i in.: Atlas ptaków świata. tłum. M. Keller. Warszawa: Multico Oficyna Wydawnicza, 2008, s. 52. ISBN 978-83-7073-556-2.
- ↑ a b c d e Henry L. Short, Robert J. Cooper: Habitat suitability index models: Great Blue Heron. U.S. Fish and Wildlife Service, 1985. [dostęp 2009-05-08]. (ang.).
- ↑ a b c d e f g W. Powell: Great blue heron: behavior at the nest. [w:] Museum of Zoology, University of Michigan [on-line]. 1958. [dostęp 2012-07-30]. (ang.).
- ↑ a b c d e f John Andrew Eastman: Birds of Lake, Pond, and Marsh: Water and Wetland Birds of Eastern North America. Stackpole Books, 1999, s. 191–196. ISBN 08-1172-681-9.
- ↑ David S. Maehr, Herbert W. Kale: Florida's Birds: A Field Guide and Reference. Pineapple Press Inc, 2005, s. 40. ISBN 15-6164-335-1.
- ↑ a b c James Hancock, James A. Kushlan: The Herons Handbook. A&C Black, 2010. ISBN 1-4081-3496-9.
- ↑ a b Wells W. Cooke: Distribution and migration of American herons and their allies. [w:] United States. Bureau of Biological Survey, biuletyn nr 45 [on-line]. Waszyngton, 1913. [dostęp 2016-12-22]. (ang.).
- ↑ a b Ross G. Vennesland: Great Blue Heron Ardea herodias. [w:] Accounts and Measures for Managing Identified Wildlife – Accounts V. 2004 [on-line]. 2004. [dostęp 2012-06-22]. (ang.).
- ↑ a b c d e f g h i EPA United States Environmental Protection Agency: Species profile> Great Blue Heron. [dostęp 2012-06-22]. (ang.).
- ↑ a b c Great Blue Heron Ardea herodias. British Columbia’s Wildlife at Risk, wrzesień 1998. [dostęp 2012-06-22]. (ang.).
- ↑ a b Diana Vos: Great Blue Heron (Ardea herodias). [w:] Utah Division of Wildlife Resources [on-line]. Wildlife Notebook Series No. 14, luty 1999. [dostęp 2013-08-27]. (ang.).
- ↑ a b S. Fairfield: Great Blue Heron. [w:] MARS Moments [on-line]. Mountainaire Avian Rescue Society. [dostęp 2015-12-10]. [zarchiwizowane z tego adresu (2013-04-30)]. (ang.).
- ↑ Dirk Frankenberg: The Nature of North Carolina's Southern Coast: Barrier Islands, Coastal Waters, and Wetlands. UNC Press Books, 1997, s. 74–75. ISBN 08-0784-655-4.
- ↑ a b Clara Jonson: The Great Blue Heron. [dostęp 2012-06-22]. (ang.).
- ↑ a b David W. Nellis: Common Coastal Birds of Florida & the Caribbean. Pineapple Press Inc, 2001, s. 116. ISBN 1-5616-4196-0.
- ↑ Carter T. Atkinson, Nancy J. Thomas, D. Bruce Hunter: Parasitic Diseases of Wild Birds. John Wiley & Sons,, 2009, s. 289. ISBN 08-1380-457-4.
- ↑ Hüseyin Sirma, Falko Steinbach. Evidence from nature: interspecies spread of heron hepatitis B viruses. „Journal of General Virology”. 86, s. 1335–1342, 2005. DOI: 10.1099/vir.0.80789-0. (ang.).
- ↑ Ron Regan: Guidelines for protection & mitigation of impacts to Great Blue Heron rookeries in Vermont. styczeń 2002. [dostęp 2015-12-10]. (ang.).
- ↑ Wayne Grady: The Great Lakes: The Natural History of a Changing Region. Greystone/David Suzuki Fdtn, 2007, s. 188. ISBN 15-5365-197-9.
- ↑ J.P. Kelsall: The Great Blue Herons of Point Roberts: History, Biology, and Management. Waszyngton: Points Roberts, 1989. (ang.).
- ↑ a b c d Great Blue Heron Rookery. [w:] Michigan Natural Features Inventory [on-line]. [dostęp 2012-08-05]. (ang.).
- ↑ Life History Notes Great Blue Heron. Ohio Division of Wildlife, Publikacja nr 70. [dostęp 2015-12-10]. (ang.).
- ↑ HBW and BirdLife International, Handbook of the Birds of the World and BirdLife International digital checklist of the birds of the world. Version 6.0b, lipiec 2022 [dostęp 2022-11-03].
- ↑ Ardea occidentalis, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2022-11-03] (ang.).
- ↑ Great Blue Heron Music Festival. [dostęp 2020-05-21]. [zarchiwizowane z tego adresu (2013-09-27)]. (ang.).
- ↑ P. Ferguson: The Dreaded Predator. [w:] What’s Up, Doc [on-line]. listopad 1998. [dostęp 2012-06-22]. (ang.).
Bibliografia
- Tony King: Great Blue Heron. Time & Quiet Press, 2009. ISBN 0-9821359-5-5.
- Charles Fergus: Wildlife of Pennsylvania and the Northeast. Stackpole Books, 2000, s. 127–128. ISBN 08-1172-899-4.
- Jon L. Dunn, Jonathan Alderfer: National Geographic Field Guide to the Birds of North America. National Geographic Books, 2006, s. 114. ISBN 07-9225-314-0.
Linki zewnętrzne
- Zdjęcia, nagrania głosów i krótkie filmy. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
- The Heron Working Group. sfu.ca. [zarchiwizowane z tego adresu (2016-03-04)]. (ang.)
- Charakterystyka, głos. The Cornell Lab of Ornithology, Cornell University (ang.)
- Informacje i zdjęcia. arkive.org. [zarchiwizowane z tego adresu (2016-10-16)]. ARKive (ang.)
- Czapla w origami.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Patrick Coin, Licencja: CC BY-SA 2.5
Great Blue Heron, Ardea herodias, adult. Location: Anhinga Trail, Everglades National Park, Florida, United States
Call of the Great Blue Heron (Ardea herodias)
Approximate range/distribution map of the Great Blue Heron (Ardea herodias). In keeping with WikiProject: Birds guidelines, yellow indicates the summer-only range, blue indicates the winter-only range, green indicates the year-round range, and orange indicates areas through which the species will pass during migratory activity.
Autor: leppyone, Licencja: CC BY 2.0
Würdemann's Heron: Great Blue Heron x Great White Heron (Ardea herodias -- Family: Ardeidae). Flamingo, Everglades National Park, Monroe Co., Florida 04/07/2007
A Great Blue Heron (Ardea herodias) attempts to swallow a ~3 lb. (1.3 kg) fish. Taken at w:Quivira National Wildlife Refuge.
(c) "Mike" Michael L. Baird, CC BY 2.0
Great Blue Heron (Ardea herodias) (and Great Egret (Casmerodius albus)), Morro Bay Estuary, Morro Bay, CA 18may2007 - Canon 20D 100-400mm IS handheld from a kayak - photo by Mike Baird bairdphotos.com
Autor: Alan D. Wilson, www.naturespicsonline.com, Licencja: CC BY-SA 2.5
Great Blue Heron, Rockport Beach Park, Rockport, Texas
Autor: Brocken Inaglory, Licencja: CC BY-SA 4.0
Feeding Great Blue Heron (Ardea herodias) chicks, San Francisco, California
Great blue heron (Ardea herodias) on the beach of Hilton Head Island, South Carolina.
Autor: Cephas, Licencja: CC BY-SA 3.0
Great Blue Heron, immature, Cap Tourmente National Wildlife Area, Quebec, Canada
Autor: Brocken Inaglory, Licencja: CC BY-SA 3.0
The nest of w:Great blue herons, Ardea herodias. San Francisco, California
(c) John Harrison, CC BY-SA 3.0
Great Blue Heron (Ardea herodias) eating a Common Snapping Turtle (Chelydra serpentina) hatchling.
Autor:
- _Ardea_herodias_-Illinois,_USA_-flying-8.jpg: PhotoBobil
- derivative work: Schmiebel (talk)
A Great Blue Heron flying with nesting material in Illinois, USA. There is a colony of about 20 heron nests in trees nearby.
Heronry in Stanley Park, British Columbia






















