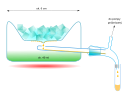
Destylacja cząsteczkowa

Dwie powierzchnie – ogrzewana i chłodzona – znajdują się w przestrzeni o ciśnieniu rzędu 10−5 hPa w odległości zbliżonej do długości średniej drogi swobodnej oddestylowywanego składnika; S – surówka, D – destylat, W – ciecz wyczerpana
Destylacja cząsteczkowa, destylacja molekularna – rodzaj destylacji prowadzonej pod zmniejszonym ciśnieniem, charakteryzująca się stosowaniem wysokiej próżni (10−3–10−7 hPa) oraz bardzo małych odległości między strefą parowania cieczy i strefą skraplania pary, równych lub mniejszych od średniej drogi swobodnej cząsteczek.
W tych warunkach cząsteczki, odparowujące z powierzchni cieczy (bez wrzenia), docierają bezpośrednio do skraplacza. W niesprężystych zderzeniach oddają zimnej powierzchni skraplacza swoją energię kinetyczną i zatrzymują się, tworząc warstewkę destylatu.
Destylacja molekularna jest stosowana do wyodrębniania związków o wysokich temperaturach wrzenia, łatwo ulegających termolizie, np. koncentratów niektórych witamin i aromatów soków owocowych[1][2].
Podstawy fizykochemiczne
Podstawy destylacji molekularnej różnią się od podstaw innych rodzajów destylacji.
W przypadku np. destylacji prostej, równowagowej, ekstrakcyjnej lub rektyfikacji rozdzielane roztwory doprowadza się do wrzenia. W czasie wrzenia para powstaje w całej objętości cieczy, co powoduje jej intensywne mieszanie. Powstaje para o zmieniającym się składzie, co pozwala odbierać frakcje lub pojedyncze składniki o różnych prężnościach pary nasyconej. Skład destylatów i cieczy wyczerpanej może być przewidywany w oparciu o wykresy fazowe równowagi między cieczą i parą.
W przypadku destylacji molekularnej para powstaje wyłącznie na powierzchni. Jej prężność nie osiąga wartości ciśnienia zewnętrznego, więc nie dochodzi do wrzenia. Nie jest też osiągany stan równowagi ciecz–para. Składniki roztworu są rozdzielane w specyficznych warunkach, w których faza gazowa nie spełnia podstawowych kryteriów kinetyczno-molekularnej teorii gazów.
Według tej teorii gaz jest ośrodkiem izotropowym. Składa się z chaotycznie poruszających się cząstek, które oddziałują na siebie poprzez zderzenia sprężyste. Droga, jaką pokonują między zderzeniami (średnia droga swobodna), jest zależna od koncentracji (liczby cząsteczek w metrze sześciennym, n0) oraz tzw. efektywnej średnicy cząsteczek
Wartość średniej drogi swobodnej jest podstawą definicji i klasyfikacji próżni w znaczeniu technicznym. W przypadku tzw. „próżni średniej” (1–10−3 hPa) λ ma wartość 0,1 mm – 10 cm, a w przypadku „próżni wysokiej” (HV; 10−3–10−7 hPa) – λ = 10 cm – 1 km.
W warunkach destylacji molekularnej faza gazowa nad parującą cieczą ma właściwości anizotropowe, ponieważ ruch cząsteczek nie jest chaotyczny. Tylko nieliczne spośród tych, które uwalniają się z powierzchni cieczy, zderzają się z innymi cząsteczkami fazy gazowej i – zmieniając kierunek ruchu – mogą wrócić na tę powierzchnię. Większość cząsteczek dociera bezpośrednio do przeciwległej powierzchni, która jest chłodzona (skraplacz). Tu oddają tu swoją energię kinetyczną i zostają zatrzymane (zderzenia niesprężyste). Sprawia to, że nie wzrasta ciśnienie parcjalne nad parującą cieczą i nie maleje szybkość parowania. Od powierzchni cieczy do skraplacza przepływa ukierunkowany strumień takich cząsteczek, których średnia droga swobodna jest podobna lub większa od odległości między oboma powierzchniami.
Zależność granicznej szybkości parowania ( [g/cm²·s]) od temperatury ( [K]), prężności pary ( [mmHg]) i masy molowej związku ( [g/mol]) wyraża równanie[3]:
Prędkość rzeczywista jest mniejsza, ponieważ równanie nie uwzględnia możliwości powrotu części cząsteczek na parującą powierzchnię (np. parowania z powierzchni kondensacji).
Mechanizm destylacji molekularnej znajduje istotne odbicie w specyficznym składzie destylatów, otrzymywanych w wyniku destylacji mieszanin. W przypadku klasycznej wysokotemperaturowej destylacji mieszaniny trzech związków liczby ich moli (N) mają się do siebie tak, jak odpowiednie prężności pary
W przypadku destylacji molekularnej względne ilości składników w parze są zależne również od masy molowej:
Dzięki tej zależności destylacja molekularna ułatwia destylację związków wielkocząsteczkowych. W niektórych przypadkach jest jedyną możliwością oddestylowania związków o dużych cząsteczkach, które łatwo ulegają termolizie.
Urządzenia do destylacji molekularnej


Aparatura do destylacji molekularnej, stosowana w laboratoriach, np. w czasie wyodrębniania niewielkich ilości produktów syntez organicznych jest zróżnicowana. Przykładem urządzenia, stosowanego do destylacji ok. 40 cm³ roztworu, jest tzw. przyrząd destylacyjny Hickmana[4]. Destylowana ciecz jest umieszczana w naczyniu o wymiarach ok. 6 × 4,5 cm, w którym jest wytwarzana próżnia. Aby wytworzyć odpowiednio wysoką próżnię stosuje się sprzęganie pomp olejowych, rotacyjnych i dyfuzyjnych (zwykle olejowych). W górnej ściance naczynia destylacyjnego znajduje się zagłębienie na mieszaninę chłodzącą. Na ochłodzonej ściance gromadzi się kondensat, który spływa do odbieralnika.
W laboratoriach stosowane są również urządzenia o działaniu ciągłym, w których surówka jest stopniowo dozowana na powierzchnię szklanej nagrzewnicy (np. zasilanej strumieniem ciepłej wody), po której spływa do odbieralnika cieczy wyczerpanej. Cząsteczki uwolnione z cieczy są zatrzymywane na wewnętrznej ściance naczynia próżniowego, w którym znajduje się nagrzewnica. Destylat spływa do odrębnego odbieralnika[6].
Przykładem różnorodnych konstrukcji aparatów o działaniu ciągłym, stosowanych w skali przemysłowej, jest urządzenie z ogrzewanym wirnikiem w formie kielicha. Wewnątrz niego jest umieszczany drugi kielich, o chłodzonych ściankach (np. z płaszczem wodnym). Surówka jest wprowadzana na środek dna kielicha wirującego. Pod wpływem siły odśrodkowej przemieszcza się w kierunku brzegów, a następnie w górę, po nachylonych bocznych ściankach. Tworzy przy tym cienką warstewkę (film), dzięki czemu zwiększa się szybkość parowania (minimalizacja zahamowań, związanych z powolną dyfuzją z wnętrza cieczy do jej powierzchni)[3][5].
Para kondensuje na zewnętrznej ściance zimnego kielicha, po której destylat spływa do otworów wylotowych, z których jest odpompowywany. Odpowiednie użebrowanie umożliwia odbieranie różnych frakcji, z różnych poziomów skraplacza.
Analogiczna zasada, polegająca na rozprowadzaniu filmu cieczy na ruchomej powierzchni, jest wykorzystywana w innych typach urządzeń o działaniu ciągłym. Znane są instalacje, w których film cieczy jest wytwarzany na powierzchni obracającego się walca, położonego poziomo. Walec otacza skraplacz o kształcie cylindrycznym. Para kondensuje na wewnętrznej powierzchni cylindra i spływa do odpowiednio ukształtowanych rynienek[1].
Przypisy
- ↑ a b Anna Dłużewska, Technologia żywności. Podręcznik dla technikum, wyd. 6, część 2, Warszawa: Wydawnictwa Szkolne i Pedagogiczne, 2008, s. 163–164, ISBN 978-83-02-07-976-4.[niewiarygodne źródło?]
- ↑ Leksykon naukowo–techniczny z suplementem, wyd. 4, t. A–O, Warszawa: Wydawnictwa Naukowo-Techniczne, 1989, s. 144, ISBN 83-204-0967-5.
- ↑ a b c Janusz Ciborowski, Podstawy inżynierii chemicznej, Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 620–622.
- ↑ a b Artur I. Vogel, Preparatyka organiczna, wyd. 4, Warszawa: Wydawnictwa Naukowo-Techniczne, 1964, s. 119–121.
- ↑ a b Janusz Ciborowski, Inżynieria chemiczna, wyd. 2, Warszawa: Wydawnictwa Naukowo-Techniczne, 1955, s. 626–630.
- ↑ Badania destylacji – instrukcje, Bydgoszcz: Uniwersytet Technologiczno-Przyrodniczy im. J.J. Śniadeckich, Zakład Systemów Technicznych i Ochrony Środowiska [dostęp 2011-01-08].
Media użyte na tej stronie
Zasady destylacji molekularnej - 2
Zasada destylacji molekularnej
Destylacja molekularna - 3
Destylacja molekularna - 4