Doskonałokostne
| Teleostei[1] | |
| Müller, 1845 | |
| Okres istnienia: [2][3] trias wczesny–dziś | |
 Obraz autorstwa Castelnau, 1856 (z lewa na prawo, z góry do dołu): Fistularia tabacaria, Mylossoma duriventre, Mesonauta acora, Corydoras splendens, Pseudacanthicus spinosus, Acanthurus coeruleus, Stegastes pictus | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Podtyp | |
| Nadgromada | |
| Gromada | |
| Podgromada | |
| Infragromada | doskonałokostne |
Doskonałokostne Teleostei (ze starożytnej greki: teleios, „całkowity” + osteon, „kość”) (stosowane są różne nazwy polskie tej grupy ryb: doskonałokostne[4], doskonałokostnoszkieletowe[5], cienkołuskie, ościste, kościste[6], kostnoszkieletowe[7]) – największa podgromada w gromadzie ryb promieniopłetwych, obok przejściowców i parafiletycznych kostnochrzęstnych. Obejmuje 96% wszystkich ryb. Ta zróżnicowana grupa powstała w triasie. Zróżnicowała się na 40 rzędów i 448 rodzin. Dotychczas opisano ponad 26 000 gatunków. Zalicza się do niej wstęgor królewski osiągający 7,5 m i więcej oraz samogłów ważący ponad 2 tony z jednej strony, a z drugiej maleńki samiec żabnicy Photocorynus spiniceps, mierzący 6,2 mm długości. Doskonałokostne mogą mieć umożliwiający szybkość kształt torpedy, mogą być spłaszczone wertykalnie lub horyzontalnie, albo też wydłużone w kształcie walca, lub też przybierać tak wyspecjalizowane kształty jak żabnicokształtne czy pławikoniki. Dominują w morzach na wszystkich szerokościach geograficznych. Zamieszkują głębie oceaniczne, estuaria, rzeki, jeziora i nawet bagna.
Różnica między doskonałokostnymi a innymi rybami kostnymi leży głównie w kościach ich aparatu gębowego. Doskonałokostne dysponują ruchomą kością przedszczękową i odpowiadającymi jej modyfikacjami w mięśniach poruszających szczęką, co umożliwia im kinezę (wysuwanie szczęki i żuchwy do przodu). Jest to wielka zaleta ich budowy ciała, jako że umożliwia doskonałokostnym chwytać zdobycz i wciągać ją do ust. U bardziej zaawansowanych ewolucyjnie taksonów powiększona kość przedszczękowa stanowi główną kość dźwigającą zęby, a kość szczękowa, przymocowana do żuchwy, działa na zasadzie dźwigni, popychając i pociągając kość przedszczękową przy otwieraniu i zamykaniu ust. Inne kości leżące dalej służą miażdżeniu i połykaniu pokarmu. Inna różnica polega na prawie równej wielkości górnych i dolnych płatów płetwy ogonowej. Kręgosłup kończy się w trzonie ogonowym, co odróżnia tę grupę od innych ryb, u których kręgosłup wchodzi do górnego płata płetwy ogonowej.
Doskonałokostne wykształciły zakres strategii reprodukcyjnych. U większości z nich występuje zapłodnienie zewnętrzne: samica składa jaja, a samiec zapładnia je, po czym rozwijają się larwy, bez żadnego udziału rodziców. Spora część doskonałokostnych to hermafrodyci, rozpoczynający życie jako samice i na pewnym jego etapie przekształcający się w samce, u kilku gatunków proces przebiega w drugą stronę. Niewielki odsetek rozwinął żyworodność, u niektórych przedstawicieli występuje opieka rodzicielska. Zazwyczaj to samiec opiekuje się gniazdem i wachluje jaja, by zapewnić im odpowiednią ilość tlenu.
Zwierzęta te są ważne dla człowieka. Przez stulecia przedstawiała je sztuka. Przemysł rybny wykorzystuje je jako źródło pokarmu, wędkarze łowią je również dla sportu. Niektóre zwierzęta hoduje się komercyjnie na farmach i znaczenie tych hodowli może w przyszłości rosnąć. Inne trzymane są w akwariach bądź są obiektami badań, zwłaszcza na polach genetyki i biologii rozwoju.
Anatomia
Cechy diagnostyczne doskonałokostnych to ruchoma kość przedszczękowa, wydłużone łuki nerwowe na końcu płetwy ogonowej i nieparzyste płytki zębowe podstawno-skrzelowe[8]. Kość przedszczękowa nie łączy się z mózgoczaszką. Odgrywa rolę w wysuwaniu ust i tworzy okrągły otwór. Obniża to ciśnienie w jamie ustnej, umożliwiając wessanie zdobyczy. Żuchwa i kość szczękowa ciągną w tył, by zamknąć usta i ryba zdolna jest pochwycić zdobycz. Natomiast bliższe sąsiedztwo szczęki i żuchwy zwiększałoby ryzyko wypchnięcia jedzenia z ust. U bardziej zaawansowanych ewolucyjnie doskonałokostnych kość przedszczękowa uległa powiększeniu i nosi zęby, których nie ma już na kości szczękowej. Kość ta popycha kość przedszczękową i żuchwę do przodu. By otworzyć usta, mięsień przywodziciel pociąga w tył szczyt kości szczękowej, popychając żuchwę do przodu. Dodatkowo kość szczękowa ulega niewielkiej rotacji, popychając do przodu wyrostki kostne, blokujące kość przedszczękową[9].
Szczęki gardłowe doskonałokostnych, drugi aparat szczękowy znajdujący się w gardle, buduje 5 łuków skrzelowych, łuków kostnych wspierających skrzela. Pierwsze 3 łuki obejmują pojedynczą łącznicę skrzelową (basibranchiale) otoczoną dwiema kośćmi podskrzelowymi (hypobranchiale), skrzelonośnymi dolnymi (ceratobranchiale), skrzelonośnymi górnymi (epibranchiale) i gardzielowymi górnymi (pharyngobranchial). Pośrodkowe basibranchiale pokrywa płytka zębowa. Czwarty łuk składa się z pary ceratobranchialiów i epibranchialiów, a czasami dodatkowo pharyngobranchiale i basibranchiale. Postawę dolnych szczęk gardłowych tworzą piąte ceratobranchialia, podczas gdy drugie, trzecie i czwarte tworzą podstawę górnych. U bardziej bazalnych doskonałokostnych szczęki gardłowe składają się z wyraźnie odgraniczonych cienkich części uczepionych mózgoczaszki, obręczy barkowej i kości gnykowej. Ich funkcja ograniczona jest jedynie do transportu pokarmu, polega głównie na aktywności dolnej ze szczęk gardłowych. U bardziej zaawansowanych ewolucyjnie doskonałokostnych szczęki gardłowe są silniejsze, a prawe i lewe ceratobranchiale łączą się, tworząc dolną ze szczęk gardłowych, pharyngobranchialia łączą się natomiast, tworząc dużą górną część szczęk gardłowych, połączoną stawowo z mózgoczaszką. Rozwinęły się u nich także mięśnie umożliwiające szczękom gardłowym udział w miażdżeniu pokarmu, a nie tylko w jego transporcie[10].
Płetwa ogonowa doskonałokostnych jest homocerkiczna (oznacza to podobną wielkość górnego i dolnego płata). Kręgosłup kończy się w trzonie ogonowym u podstawy płetwy ogonowej, co odróżnia rzeczony takson od tych grup, u których kręgosłup wstępuje do górnego płata płetwy ogonowej – było tak u większości ryb paleozoicznych. Łuki nerwowe są wydłużone (struktury zwane uroneuralia), zapewniające wsparcie górnemu płatowi płetwy ogonowej[9]. Dodatkowo występują hypuralia, spłaszczone płytki podogonowe położone na tylnym końcu kręgosłupa, zapewniające wsparcie dla promieni płetwy ogonowej[11]. Ogólnie doskonałokostne są szybsze i bardziej giętkie, niż większość bardziej bazalnych ryb kostnych. Budowa ich szkieletu ewoluowała ku większej lekkości. Ich kości są dobrze uwapnione, jednak budowa ich opiera się raczej na rusztowaniu rozpórek, niż na gęstszej istocie gąbczastej, jak u przejściowców (pełnokostnych). Co więcej, żuchwa doskonałokostnych jest zredukowana do trzech kości; budują ją kość zębowa, kość kątowa i kość stawowa[12].
Ewolucja i filogeneza
Doskonałokostne po raz pierwszy jako odrębna grupa wyróżnione zostały przez niemieckiego ichtiologa Müllera w 1845[13]. Ich nazwa naukowa pochodzi z języka starogreckiego od słów teleios, „kompletny” + osteon, „kość”[14]. Müller oparł tę klasyfikację na obecności skostnień międzymięśniowych oraz pewnych cechach tkanek miękkich, które okazały się problematyczne, jako że nie uwzględniono wyróżniających cech kopalnych doskonałokostnych[15]. W 1966 Greenwood et al. zapewnili stabilniejszą klasyfikację[13][16]. Definicja nazwy Teleostei jest jednak kontrowersyjna – niektórzy autorzy używali jej w stosunku do grupy koronowej, a inni do kladu obejmującego wszystkie taksony bliżej spokrewnione z grupą koronową niż z pozostałymi współczesnymi rybami[15].
Starsze skamieliny doskonałokostnych datuje się na późny trias. Wyewoluowały one z ryb przypominających miękławkę z kladu przejściowców. W erach mezozoicznej i kenozoicznej uległy różnicowaniu. Obecnie doskonałokostne obejmują 96% ryb. Poniższy kladogram prezentuje ich pokrewieństwo z innymi rybami[17] i kręgowcami lądowymi, które wyewoluowały z pokrewnej grupy ryb[18][19]. Szacunkowe daty pochodzą z publikacji Near et al., 2012[17].
| Osteichthyes |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Relacje wewnętrzne
Filogeneza doskonałokostnych stanowi przedmiot długiej debaty, która nie doprowadziła do konsensusu co do filogenezy i czasu wyłonienia się głównych grup aż do zastosowania współczesnej analizy kladystycznej bazującej na badaniach DNA. Near et al. (2012) zbadali filogenezę i czas rozdziału wszystkich ważniejszych linii, analizując sekwencje DNA 9 niezwiązanych ze sobą genów u 232 gatunków. Otrzymano wiarygodne wyniki z mocnym wsparciem węzłów, wobec czego wzór rozgałęziania się jest prawdopodobnie poprawny. Skalibrowano również czas rozgałęzień poprzez odniesienie go do zapisu kopalnego[17]. Doskonałokostne podzieliły się na główne klady w następujący sposób, za Near et al.[17][20]:
| Teleostei |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Trendy ewolucyjne

Kilka wczesnych grup, obecnie wymarłych, wyodrębniło się z ich nowopłetwych przodków jeszcze przed powstaniem doskonałokostnych (w rozumieniu Müllera). Zaliczają się doń Pachycormiformes i Aspidorhynchiformes z mezozoiku. Były to ryby o wydłużonych ciałach. Niektóre z nich odfiltrowywały pokarm, inne spożywały większą zdobycz[9].
Najbardziej pierwotne z żyjących doskonałokostnych to elopsopodobne i kostnojęzykopodobne. Pierwsza z wymienionych grup liczy około 800 gatunków. W ich rozwoju występuje liściokształtna larwa zwana leptocefalem, wyspecjalizowana w kierunku środowisk morskich. Wśród nich węgorzokształtne cechują się wydłużonym ciałem, utraciły one obręcze miedniczne i żebra, a pewne elementy ich szczęki uległy połączeniu. 200 gatunków kostnojęzykopodobnych charakteryzuje kość w języku, za którym znajduje się kość podstawnoskrzelowa (basibranchiale). Obie struktury noszą duże zęby, sparowane z zębami kości przyklinowej sklepienia jamy ustnej. Klad Otocephala obejmuje śledziokształtne i otwartopęcherzowe (karpiokształtne, sumokształtne i ich krewni). Śledziokształtne obejmują współcześnie 350 gatunków śledzi i ryb z nimi blisko spokrewnionych. Grupę tą charakteryzują szczególne łuski brzuszne i odmienne ułożenie łusek hypuralnych. U większości gatunków pęcherz pławny rozpościera się do puszki mózgowej i odgrywa rolę w słuchu. Otwartopęcherzowe obejmują większość ryb słodkowodnych. Rozwinęły one unikalne adaptacje[9]. Należy doń aparat Webera, złożony z kości łączących pęcherz pławny z uchem wewnętrznym. Usprawnia to słuch, jako że fala dźwiękowa wprawia pęcherz w wibracje, które łańcuch kości przekazuje do ucha wewnętrznego. Rozwinęły także system alarmowania chemicznego. Kiedy dany osobnik dozna urazu, alarmująca substancja wydostaje się do wody, ostrzegając pobliskie ryby[21].
Większość gatunków doskonałokostnych należy do kladu Euteleostei; obejmuje on 17 419 gatunków zaliczanych do 2935 rodzajów i 346 rodzin. Wspólne cechy Euteleostei obejmują podobieństwa w rozwoju zarodkowym struktur kostnych i chrzęstnych ulokowanych pomiędzy głową a płetwą grzbietową (kości supraneuralne), wyrostek na kości steguralnej (leżącej obok łuków kręgowych ogona) oraz pośrodkowe chrząstki ogonowe znajdujące się pomiędzy hypuraliami a podstawą ogona. Dwie główne grupy Euteleostei to Protacanthopterygii, obejmujące ryby takie jak łosoś, szczupak czy stynka[22], i Neoteleostei, gdzie należy większość Euteleostei. Ich zaawansowaną ewolucyjnie cechą jest mięsień kontrolujący szczęki gardłowe, miażdżące pokarm. W tej grupie kolcopłetwe mają kolczastą płetwę grzbietową – kolec znajduje się na przedzie płetwy o dalszych miękkich promieniach. Rzeczona płetwa ułatwia poruszanie się[23], może też odgrywać rolę w obronie. Acanthomorpha wykształciły łuski ktenoidalne (w przeciwieństwie do łusek cykloidalnych innych grup), zęby kości przedszczękowej i większe adaptacje do szybszego pływania[9].
Płetwa tłuszczowa, obecna u ponad 6000 gatunków doskonałokostnych, uważana jest często za twór powstały tylko w jednej linii, który następnie wielokrotnie zanikł w różnych liniach z uwagi na ograniczoną funkcję, jaką pełni. Jednak badanie z 2014 przeczy temu poglądowi, sugerując, że płetwa tłuszczowa powstawała w wyniku konwergencji. U kąsaczokształtnych płetwa tłuszczowa rozwija się z wyrostka po redukcji larwalnego fałdu tłuszczowego, natomiast u łososiokształtnych wydaje się stanowić pozostałość tego fałdu[24].
Zmienność
Wyróżnia się ponad 26 000 gatunków doskonałokostnych, umieszczanych w około 40 rzędach i 448 rodzinach[25]. Zaliczane doń ryby spotykane są w prawie każdym wodnym środowisku. Wyspecjalizowały się do żywienia się na różne sposoby jako mięsożercy, roślinożercy, filtratorzy i pasożyty[26]. Najdłuższym znanym ich przedstawicielem jest wstęgor królewski, mierzący 7,6 m długości i więcej[27], wydaje się jednak karłem przy wymarłym Leedsichthys – u którego długość jednego z okazów szacowana jest na 27,6 m[28], inne na 8-16,5 m[29]. Za najcięższego z doskonałokostnych uważa się samogłowa. Okaz znaleziony w 2003 oszacowano na 2,3 tony[30]. Najmniejszy w pełni dojrzały osobnik to samiec żabnicokształtnej Photocorynus spiniceps, mogący mierzyć tylko 6,2 mm, choć samica tego gatunku jest dużo większa – osiąga 50 mm[27]. Schindleria brevipinguis jest najmniejszą i najlżejszą dorosłą rybą i najmniejszym kręgowcem świata. Samica mierzy 8,4 mm, a samiec 7 mm[31].

Ryby otwartych wód mają zazwyczaj opływowy kształt ciała, przypominający torpedę. Minimalizuje to turbulencje, gdy przedzierają się przez wodę. Mieszkańcy raf żyją w złożonym, względnie ciasnym podwodnym krajobrazie. Dla nich manewrowość jest ważniejsza od prędkości i wiele z nich rozwinęło ciała optymalizujące zrywu i zmian kierunku. Wiele ma ciała spłaszczone bocznie, co pozwala im zagłębiać się w szczeliny i przepływać przez wąskie przejścia. Niektóre wykorzystują do lokomocji swe płetwy piersiowe, inne wykonują faliste ruchy płetwami grzbietowymi i odbytowymi[32]. Niektóre wykształciły struktury skórne służące kamuflażowi. Chaetodermis penicilligerus jest prawie niewidoczny wśród wodorostów, które przypomina. Scorpaenopsis oxycephala ukryty czai się na dnie morskim, gotowy do zaskoczenia zdobyczy. Inne, jak Chaetodon capistratus, mają przypominające oczy plamy, straszące bądź mylące napastnika. Z kolei Pterois wykształcił ubarwienie ostrzegawcze, informujące, że zwierzę jest toksyczne czy też ma jadowite kolce[33].
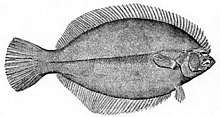
Flądrokształtne to ryby denne, żywiące się na dnie morza. Wykazują większą asymetrię niż jakikolwiek inny kręgowiec. Ich larwy są dwubocznie symetryczne, jednak przechodzą przeobrażenie, w trakcie którego jedno oko migruje na drugą stronę głowy i jednocześnie zaczynają one pływać na jednym boku. Przynosi to taką korzyść, że leżąc na dnie morza, mają obydwa oczy na górze, co zapewnia im szerokie pole widzenia. Górny bok jest zazwyczaj plamisty lub marmurkowany, dolny bok natomiast blady[34].
Istnieją pasożytnicze doskonałokostne. Podnawkowate zmodyfikowały swe płetwy grzbietowe z wytworzeniem dużych przyssawek, dzięki którym czepiają się gospodarzy, do których należą walenie, Chelonioidea, rekiny, płaszczki, ale jest to raczej komensalizm, niż pasożytnictwo, zarówno podnawka, jak i gospodarz korzystają na usuwaniu ektopasożytów i złuszczającej się skóry[35]. Większą szkodę wyrządzają Vandelliinae, które wpływają do komór skrzeli ryb i żywią się ich krwią i innymi tkankami[36]. Simenchelys parasitica, zazwyczaj padlinożerca, czasami wbija się w ciało ryb. Znajdowano go w sercu ostronosa atlantyckiego[37].

Niektóre gatunki, jak strętwa, wytwarzają silne prądy elektryczne, wystarczające do oszołomienia zdobyczy. Jeszcze inne, jak Gymnotiformes, generują słabe, zmienne pole elektryczne, umożliwiające im wykrywanie zdobyczy. Pływają one tak, by go nie zakłócić. Prądy te wytwarzane są przez zmodyfikowane mięśnie bądź neurony[21].
Rozmieszczenie geograficzne
Doskonałokostne spotykane są w większości środowisk wodnych, włączając w to ciepłe i zimne morza, wody słodkie stojące i płynące, a nawet, jak w przypadku Cyprinodon macularius, izolowane i czasem gorące i bardzo zasolone zbiorniki wodne pustyń[38][39]. Ich różnorodność zmniejsza się na wysokich szerokościach geograficznych. W Ziemi Franciszka Józefa, do 82°N, pokrywa lodowa i wody chłodniejsze od 0 °C przez dużą część roku ograniczają liczbę gatunków; 75% z tych, które tam żyją, to endemity Arktyki[40].
Z głównych grup doskonałokostnych elopsopodobne, śledziopodobne i Percomorpha zasiedlają cały świat, występując głównie w morzach. Otwartopęcherzowe i kostnojęzykopodobne też zamieszkują cały świat, ale głównie wody słodkie, kostnojęzykopodobne głównie w tropikach. Aterynokształtne występują w wodach słonych i słodkich całego świata, ale przy powierzchni wody. Dla odmiany szczupakokształtne ograniczone są do wód słodkich półkuli północnej, zaś łososiokształtne spotyka się w wodach słodkich w strefach umiarkowanych obu półkul, niektóre gatunki migrują również do i z mórz. Pseudokolcopłetwe to ryby półkuli północnej, słodko- jak i słonowodne[39].
Niektóre doskonałokostne migrują. Pewne ryby słodkowodne przemieszczają się w systemach rzecznych w cyklu rocznym. Inne gatunki są anadromiczne, spędzają życie w morzu i migrują do wód lądowych, gdzie składają ikrę. Wymienia się tu różne łososiowate czy też skalnika prążkowanego. Inne, jak węgorze, odwrotnie – są katadromiczne[41]. Słodkowodny węgorz europejski przemierza Ocean Atlantycki, by rozmnażać się wśród pływających wodorostów Morza Sargasowego. Dorosły węgorz składa tutaj ikrę i umiera. Rozwijające się z jaj młode Prąd Zatokowy zabiera w kierunku Europy. Przybywają tam jako maleńkie ryby i wpływają do estuariów, a dalej płyną w górę rzek, przezwyciężając przeszkody na drodze do rzek i stawów, w których spędzają swe dorosłe życie[42]. Doskonałokostne żyją także na bagnach. Na przykład w australijskim Leanyer Swamp odnotowano obecność młodocianych osobników 38 gatunków ryb z 24 rodzin[43].
Doskonałokostne takie jak Salmo trutta i Diptychus maculatus spotykane są w górskich jeziorach Kaszmiru na wysokości 3819 m nad poziomem morza[44]. Doskonałokostne występują również w ekstremalnych głębiach oceanów. Pseudoliparis amblystomopsis widziano na głębokości 7700 m, a spokrewniony z nim, nienazwany jeszcze gatunek odnotowano na głębokości 8145 m[45][46].
Fizjologia
Oddychanie
Jak u większości ryb, u doskonałokostnych oddychanie oparte jest na wymianie gazowej na powierzchni skrzeli z wodą połykaną przez usta i pompowaną przez skrzela. Oprócz pęcherza pławnego, zawierającego niewielką ilość powietrza, ciało nie dysponuje rezerwami tlenu, a respiracja musi trwać przez całe życie zwierzęcia. Niektóre doskonałokostne zamieszkują siedliska o niskiej dostępności tlenu, jak wody stojący czy wilgotne błota. Rozwinęły one dodatkowe tkanki lub narządy wspierające wymianę gazową[47].
Kilka rodzajów Teleostei niezależnie od siebie wykształciło zdolność oddychania powietrzem atmosferycznym. Niektóre prowadzą ziemno-wodny tryb życia. Pewne ślizgowate wychodzą na ląd, by żerować, a słodkowodne węgorze potrafią pochłaniać tlen przez swą wilgotną skórę. Oxudercinae opuszczają wodę na znaczne okresy, wymieniając gazy przez skórę i błonę śluzową jamy ustnej i gardła. Synbranchidae mają podobne, wysoce unaczynione wyściółki jamy ustnej. Mogą opuszczać wodę na całe dnie i przechodzić w stan estywacji w błocie[48]. Błędnikowce rozwinęły dodatkową strukturę oddechową zwaną narządem błędnikowym na pierwszym łuku skrzelowym. Służy ona wymianie gazowej w powietrzu. Podobnie długowąsowate wykształciły narząd nadskrzelowy. Inni przedstawiciele sumokształtnych, jak zbrojnikowate, potrafią oddychać powietrzem trzymanym w przewodzie pokarmowym[49].
Zmysły
Teleostei mają wysoce rozwinięte narządy zmysłów. Prawie wszystkie ryby dzienne widzą barwy przynajmniej tak dobrze, jak przeciętny człowiek. Wiele z nich posiada także chemoreceptory odpowiadające za wyostrzone zmysły smaku i węchu. Większość ryb ma receptory tworzące linię boczną, wyczuwającą delikatne prądy i wibracje. Rozpoznają w ten sposób ruchy pobliskich ryb lub zdobyczy[50]. Dźwięki słyszą na wiele różnych sposobów. Wykorzystują do tego linię boczną, pęcherz pławny, a niektóre gatunki także aparat Webera. Orientują się dzięki punktom orientacyjnym, mogą wykorzystywać mapy mentalne budowane na licznych punktach orientacyjnych czy symbolach. Badania w labiryntach wskazują na posiadanie przez ryby pamięci przestrzennej, koniecznej dla stworzenia mapy mentalnej[51].
Osmoregulacja
Skóra doskonałokostnych jest w dużym stopniu nieprzepuszczalna dla wody. Główny kontakt ciała ryby ze środowiskiem zewnętrznym odbywa się na powierzchni skrzeli. W wodach słodkich Teleostei przyjmują wodę przez skrzela na drodze osmozy, podczas gdy w wodzie morskiej ją tracą. Rozpuszczone w wodzie sole mineralne tracone są przez skrzela w wodzie słodkiej, a przyjmowane w słonej. Stornia (flądra) spędza większość swego życia w morzu, ale często migruje do estuariów i rzek. W morzu przez godzinę przyjmuje ilość kationów sodu równoważną 40% wolnego sodu w jej ciele, z czego ¾ przez skrzela, a resztę wraz z wypijaną wodą. Dla odmiany w rzekach wymienia na godzinę zaledwie 2% kationów sodowych swego organizmu. Potrafiąc selektywnie ograniczyć wymianę wody i soli przez dyfuzję, dysponuje mechanizmem transportu aktywnego przez skrzela, eliminującego sól w wodzie morskiej oraz pobierającego ją w wodzie słodkiej[52].
Termoregulacja
Ogólnie ryby są poikilotermiczne – temperatura ich ciała nie różni się od temperatury otoczenia. Pobierają i tracą ciepło przez skórę i wraz z wymianą gazową, zdolne są do regulacji ich krążenia w odpowiedzi na zmiany w temperaturze wody poprzez wzrost lub spadek przepływu krwi przez skrzela. Ciepło metaboliczne powstające w mięśniach lub jelitach jest szybko rozpraszane przez skrzela, krew jest zaś przekierowywana ze skrzeli w razie ekspozycji na zimno[53]. Z uwagi na względną niezdolność do kontrolowania temperatury krwi większość doskonałokostnych może przetrwać jedynie w niewielkim zakresie temperatur wody[54].
Tuńczyki i inne szybko pływające ryby oceaniczne utrzymują swe mięśnie w wyższych od środowiska temperaturach dla skuteczniejszego przemieszczania się[55]. Tuńczyk utrzymuje temperaturę mięśni 10,5 °C lub więcej wyższą od temperatury otoczenia dzięki wymiennikowi przeciwprądowemu, w którym ciepło produkowane w mięśniach i obecne w krwi żylnej ogrzewa krew tętniczą, nim ta dostanie się do mięśni[55][56]. Inną adaptację stanowi zwiększona zawartość mioglobiny w mięśniach, nadająca mięsu tuńczyka czerwonawą barwę[57]. W regionach polarnych lub w głębiach oceanicznych, gdzie temperatura wynosi kilka stopni nad temperaturą topnienia, niektóre duże ryby, jak włócznik, żaglicowate czy tuńczyki, rozwinęły mechanizm ogrzewania mózgu i oczu, zapewniający im znacznie lepsze widzenie, niż ich zimnokrwistej w zupełności zdobyczy[58].
Pęcherz pławny
Ciało doskonałokostnych jest gęstsze od wody, co zmusza rybę do kompensacji tej różnicy. Wiele Teleostei ma pęcherz pławny, który zwiększa ich pływalność poprzez manipulację gazem. Pozwala im to przebywać na danej głębokości, a także obniżać się bądź podnosić w wodzie bez zużytkowania energii na pływanie. U grup bardziej prymitywnych, jak Leuciscina, pęcherz pławny otwiera się do przełyku i rozdwaja na płuco. U ryb szybko pływających często nie występuje – jak u tuńczyka czy makreli. U ryb mających zamknięty pęcherz pławny zawartość gazu kontroluje sieć dziwna, zbudowana z naczyń krwionośnych działających na zasadzie wymiennika przeciwprądowego gazu pomiędzy pęcherzem pławnym i krwią[59]. Chondrostei, takie jak jesiotr, też mają pęcherz pławny, ale wyewoluował on odrębnie: inne Actinopterygii jak amia czy wielopłetwcowate nie mają takiego narządu. Wydaje się więc, że pęcherz pławny pojawił się dwukrotnie. Pęcherz pławny doskonałokostnych stanowi w stosunku do pęcherza pławnego tamtych ryb homoplazję[60].
Poruszanie się

Typowy doskonałokostny cechuje się opływowym kształtem ciała umożliwiającym mu szybkie pływanie. Przemieszcza się za pomocą bocznych wygięć tylnej części tułowia i ogona, odpychających ciało od wody[61]. Od tego sposobu poruszania się istnieje wiele wyjątków, zwłaszcza kiedy szybkość nie odgrywa pierwszorzędnej roli. Wśród skał i raf koralowych pożądaną cechą okazuje się zwrotność[62]. Węgorzokształtne przemieszczają się poprzez ruchy całego ciała. Żyjący wśród traw morskich i glonów Hippocampus przybrał postawę pionową i porusza się dzięki trzepotaniu płetwami piersiowymi. Blisko spokrewnione Syngnathinae poruszają się dzięki falowaniu wydłużonej płetwy grzbietowej. Babkowate podskakują nad podłożem, podpierając się i rozpędzając płetwami piersiowymi[63]. Oxudercinae przemieszczają się w mniej więcej podobny sposób na lądzie[64]. Niektórym gatunkom przyssawka miednicy pozwala na wspinaczkę. Lentipes concolor wspina się na wodospady podczas migracji[63]. Kurek czerwony dysponuje trzema wolnymi promieniami płetw piersiowych, spełniającymi funkcje czuciowe, ale także umożliwiającymi mu chód po podłożu[65]. Ptaszorowate wzbijają się w powietrze i mogą szybować na powiększonych płetwach piersiowych setki metrów[66].
Rozmnażanie
U większości doskonałokostnych występują jajorodność i zapłodnienie zewnętrzne. Komórki jajowe i plemniki trafiają do wody, gdzie przechodzą zapłodnienie. Zapłodnienie wewnętrzne występuje u 500-600 gatunków Teleostei, będąc bardziej charakterystyczne dla Chondrichthyes i wielu czworonogów. W takim wypadku samiec inseminuje samicę za pomocą narządu kopulacyjnego[67]. Rzadziej niż raz na milion zapłodnionych zewnętrznie jaj przeżywa aż do stadium dojrzałej ryby. Znacznie większą szansę przetrwania ma potomstwo około tuzina rodzin żyworodnych, u których jaja zapładniane są wewnętrznie i rozwijają się dalej w cele matki. Niektóre z tych gatunków, w tym ryby akwariowe z rodziny piękniczkowatych, są jajożyworodne; jajo zaopatrzone jest w pęcherzyk żółtkowy, który odżywia rozwijający się zarodek. Gdy jego zapas się wyczerpie, z jaja wykluwa się larwa, która wydostaje się do wody. Inne gatunki, jak przedstawiciele żyworódkowatych, są w pełni żyworodne. Ich rozwijający się zarodek odżywiany jest przez krew matki poprzez strukturę przypominającą łożysko rozwijającą się w macicy. Kilka gatunków praktykuje oofagię. Można tu wymienić Nomorhamphus ebrardtii. Niezapłodnionymi jajami matki żywią się w macicy rozwijające się larwy. Wewnątrzmaciczny kanibalizm odnotowano u niektórych półdziobcowatych[68]
Doskonałokostne stosują dwie główne strategie rozrodcze. Osobniki gatunków semelparycznych rozmnażają się raz w życiu i umierają z powodu zmian fizjologicznych towarzyszących reprodukcji, prowadzących do śmierci[69]. Dobrze znany przykład stanowią łososiowate Oncorhynchus. Wylęgają się w wodzie słodkiej, po czym migrują do morza, gdzie spędzają do czterech lat. Po ich upłynięciu wracają na miejsce swego przyjścia na świat, gdzie odbywają tarło i giną. Semelparyczność opisywano także u pewnych węgorzokształtnych i stynkowatych. Jednakże większość doskonałokostnych jest iteroparycznych. Dorosłe osobniki mogą rozmnażać się wielokrotnie w ciągu życia[70].
Determinacja płci

88% gatunków Teleostei jest rozdzielnopłciowych. Oznacza to, że dany osobnik jest przez całe dorosłe życie albo samcem, albo samicą. Jego płeć może być determinowana genetycznie, jak u ptaków czy ssaków, bądź środowiskowo, jak u gadów. U niektórych doskonałokostnych swoją rolę odgrywają oba te czynniki[71]. Genetyczna determinacja płci doskonałokostnych zachodzić może trojako. W przypadku jednoczynnikowej determinacji o płci decydować może pojedynczy locus. U Teleostei występują też systemy determinacji płci XY i ZW. Niektóre gatunki, jak zmienniak plamisty, stosują oba systemy i samiec może mieć zestaw chromosomów płciowych XY lub ZZ zależnie od populacji[72].
Wieloczynnikowa determinacja płci występuje u licznych gatunków neotropikalnych. Obejmuje oba systemy XY i ZW. Pociąga za sobą rearanżacje chromosomów płci i autosomów. Przykładowo Apareiodon affinis stosuje wieloczynnikowy system ZW, w którym samicę charakteryzuje ZW1W2, a samca ZZ. Hoplias malabaricus ma wieloczynnikowy system XY, w którym samica ma chromosomy X1X1X2X2, samic zaś X1X2Y.[73]. Pewne doskonałokostne, jak danio pręgowany, mają system wieloczynnikowy, w którym kilka genów odgrywa rolę w determinacji płci[74]. Środowiskową determinację płci udokumentowano u przynajmniej 70 gatunków doskonałokostnych. Głównym czynnikiem środowiskowym wpływającym na płeć jest temperatura, ale płeć ustalać mogą również pH, tempo wzrostu, zagęszczenie i środowisko społeczne. Menidia menidia odbywający tarło w chłodniejszych wodach wyda na świat więcej samic, w cieplejszych zaś więcej samców[75].
Hermafrodytyzm
Pewne doskonałokostne są hermafrodytami. Zjawisko to może przybierać dwie formy: symultaniczną i sekwencyjną. W pierwszym przypadku plemniki i jaja obecne są razem w gonadach. Symultaniczny hermafrodytyzm występuje zazwyczaj u gatunków zamieszkujących głębie oceaniczne, gdzie potencjalni partnerzy rozrodczy są rzadko rozmieszczeni[76][77]. Samozapłodnienie występuje rzadko i odnotowano je tylko u dwóch gatunków: Kryptolebias marmoratus i Kryptolebias hermaphroditus[77]. W hermafrodytyzmie sekwencyjnym dany osobnik może funkcjonować jako przedstawiciel jednej płci na wczesnym etapie swego dorosłego życia, a w dalszym jego ciągu zmienić płeć. Zaliczają się tu skarusowate, wargaczowate, strzępielowate, płaskogłowowate, prażmowate i Phosichthyidae[76].
W przypadku protandrii osobnik zaczyna życie jako samiec, po czym staje się samicą. Odwrotne zjawisko nazywa się protogynią i jest częstsze. Zamiana płci odbywa się w różnych sytuacjach. Samiec wargatka sanitarnika posiada harem złożony z do 10 samic. Jeśli usunie się go, największa i najbardziej dominująca z samic zaczyna zachowywać się po męsku i w końcu pojawiają się u niej jądra. Po jej usunięciu kolejna samica zajmuje jej miejsce. U Anthias squamipinnis osobniki gromadzą się w większe grupy, w którym samice znacznie przewyższają liczebnością samce. Jeśli z grupy usunie się pewną liczbę samców, ta sama liczba samic zmienia płeć i zastępuje je. U Amphiprioninae osobniki żyją w grupach, w których rozmnażają się tylko dwie największe ryby, największy samiec i największa samica. Jeśli samica zginie, samiec zmienia płeć, a następny największy samiec zajmuje jego miejsce[78].
U głębinowych żabnicokształtnych z podrzędu Ceratioidei o wiele mniejszy od samicy samiec na stałe przyczepia się do jej ciała, stając się właściwie produkującym nasienie wyrostkiem. Tworzą razem jednostkę semihermafrodytyczną[79].
Taktyki rozrodcze
Doskonałokostne stosują kilka różnych systemów rozrodczych. U niektórych gatunków występuje promiskuityzm. I samce, i samice kojarzą się u nich z wieloma partnerami, nie ma ewidentnych wyborów partnera. Stan taki odnotowano u śledzi oceanicznych, pawich oczek, Epinephelus striatus, Dascyllus melanurus, pielęgnicowatych czy Clepticus parrae. Poligamia, w której jedna z płci ma wielu partnerów, może przybierać wiele form. Poliandria polega na rozrodzie jednej dojrzałej samicy z wieloma samcami, ograniczającymi swój rozród tylko do niej. Stanowi ona rzadkość u doskonałokostnych i u ryb w ogólności. Spotyka się ją u Amphiprioninae. Dodatkowo może występować w pewnym stopniu u żabnicokształtnych, wśród których niektóre samice mają więcej niż jednego przyczepionego do ich ciała samca. Poligynia, polegająca na rozrodzie jednego samca z wieloma samicami, jest znacznie częstsza. Opisywano ją u Cottoidea, bassowatych, garbikowatych (oprócz Amphiprioninae) i pielęgnicowatych, u których wiele samic może odwiedzać terytorialnego samca, który strzeże jaj i młodych oraz opiekuje się nimi. Poligynia może także wiązać się z posiadaniem przez samca haremu złożonego z kilku samic, co występuje u mieszkańców raf koralowych, jak garbikowate, wargaczowate, skarusowate, pokolcowate, rogatnicowate i Malacanthidae[70].
Zachowanie typu lek, w którym samce urządzają pokazy przed samicami, odnotowano przynajmniej u jednego gatunku, Cyrtocara eucinostomus. Podobne do tego systemy rozrodu odnotowano u kilku innych gatunków. U gatunków monogamicznych samce i samice tworzą pary i rozmnażają się tylko ze sobą. Monogamia cechuje sumikowate, wiele chetonikowatych, Hippocampus i kilka innych gatunków[70]. Zaloty odgrywają u doskonałokostnych rolę w rozpoznawaniu osobników własnego gatunku, zacieśnianiu więzi między partnerami, zajmowaniu miejsc tarła oraz synchronizacji wydalania gamet. Obejmują one zmianę koloru, wydawanie dźwięków i pokazy wizualne (prostowanie płetw, szybkie pływanie, wyskoki). Często zachowuje się tak samiec. Jednak samica też może podejmować takie zachowania, by przezwyciężyć terytorialnego samca, który inaczej zdobyłby nad nią przewagę[80].
Niektóre gatunki rozwinęły dymorfizm płciowy. Polega on na tym, że osobniki jednej płci, zazwyczaj samce, rozwijają drugorzędowe cechy płciowe zwiększające ich szanse na sukces rozrodczy. Samiec Coryphaena ma większą i bardziej tępą głowę, niż samica. U kilku gatunków karpiowatych samiec w okresie godowym wykształca opuchniętą głowę i niewielkie guzki[81]. Samiec Bolbometopon muricatum posiada rozwinięte czoło z grzebieniem kostnym, używa go w zrytualizowanych walkach na głowy[82]. Dymorfizm może obejmować także różnice barwne. Znowuż to samiec jest zazwyczaj jaskrawiej ubarwiony. U niektórych karpieńcokształtnych, tęczankowatych i wargaczowatych ubarwienie takie utrzymuje się stale, natomiast u niektórych karpiowatych, ciernikowatych, niektórych okoniowatych i bassowatych kolory zmieniają się wraz z porą roku. Rzeczone ubarwienie może łatwo rzucać się w oczy drapieżnikom, jednak korzyść wynikająca z rozrodu może przekraczać zagrożenie ze strony drapieżników[81].
Samce niezdolne do zdobycia samicy uciekają się do innych sposobów osiągania sukcesu rozrodczego. U takich bassowatych jak bass niebieski większe, starsze samce, którym udało się zdobyć samicę, budują gniazdo dla zapładnianych przez siebie jaj. Mniejsze samce satelickie naśladują zachowanie samic i ich ubarwienie, by dostać się do gniazda i zapłodnić jaja. Jeszcze inne samce czają się w pobliżu gniazda, by pośpiesznie popędzić doń i zapładniać w biegu. Samce te są jeszcze mniejsze od satelickich. Samce takie występują również u Oncorhynchus, u którego mniejsze samce nie mogące zdobyć pozycji u samic mkną, gdy duży, dominujący osobnik właśnie zapładnia ikrę[83].
Tarliska i opieka rodzicielska

Teleostei mogą trzeć się w toni wodnej bądź na dnie. Ten pierwszy przypadek ogranicza się w większości do raf koralowych; ryby pędzą w kierunku powierzchni, uwalniając gamety. Wydaje się to chronić jaja przed drapieżnikami i umożliwia im rozprzestrzenianie się z prądem. Jednak potomstwo nie otrzymuje opieki rodzicielskiej. Ryby trące się w toni wodnej częściej niż te wybierające podłoże czynią to grupowo. Ryby trące się na dnie często dokonują rozrodu w gniazdach, szczelinach skalnych czy jamach. Niektóre z jaj mogą przyczepiać się do różnego rodzaju podłoża, jak skały, rośliny, drewno czy muszle[84].
Wśród doskonałokostnych jajorodnych 79% nie zapewnia opieki rodzicielskiej[85]. Jeśli już, to znacznie częściej potomstwem zajmuje się samiec[85][86]. Opieka ojca powstała na zasadzie egzaptacji z samczego terytorializmu[87][88]. Niezwykłym przykładem opieki matczynej jest Symphysodon, zapewniający składniki odżywcze rozwijającym się młodym w śluzie[89]. Pewne gatunki Teleostei trzymają jaja bądź młode przyczepione do swych ciał. Jaja ariusowatych, apogonowatych, Opistognathidae i innych (ryby określane mianem pyszczaków) inkubują się w jamach ustnych. U niektórych afrykańskich pielęgnicowatych w jamie ustnej odbywa się zapłodnienie. U gatunków takich jak Bujurquina vittata młode po wykluciu się są wysiadywane, w czym mogą uczestniczyć oboje rodzice. Czas wypuszczenia młodych zależy od gatunku. Niektóre pyszczaki wypuszczają młode zaraz po wykluciu się, podczas gdy inne trzymają jeszcze osobniki młodociane. Oprócz przetrzymywania w jamie ustnej niektóre doskonałokostne wykształciły struktury do przenoszenia młodych. Samiec Kurtus ma na czole kostny haczyk do przenoszenia zapłodnionych jaj. Pozostają one na haku aż do wyklucia się. U koników morskich samiec dysponuje kieszenią rozrodczą, w której samica umieszcza zapłodnione jaja. Pozostają one w kieszeni, nim staną się wolno pływającymi młodymi. Samica Aspredinidae ma z kolei na brzuchu struktury, do których przyczepiają się jaja[90].
U niektórych gatunków wykazujących opiekę rodzicielską młode z poprzedniego tarła mogą zostać z rodzicami i nieść im pomoc w opiec nad swym nowym rodzeństwem. Obserwowano takie zjawisko u około 19 gatunków pielęgnicowatych z jeziora Tanganika. Biorą udział w czyszczeniu i wachlowaniu jaj oraz larw, czyszczeniu zagłębienia, w którym odbywa się rozród, oraz bronią terytorium. Cechują się zredukowanym tempem wzrostu, ale otrzymują ochronę przed drapieżnikami. Wśród doskonałokostnych występuje też pasożytnictwo rozrodcze. Niektóre Leuciscinae mogą trzeć się w gniazdach samogłowowatych, jak też należących do Leuciscinae innych gatunków. Giętkoząb cętkowany znany jest ze składania jaj na podłożu, kiedy pyszczaki pielęgnicowate zbierają swoje i młode giętkozęby zjadają larwy pielęgnicowatych. U niektórych rodzin doskonałokostnych rozwinął się kanibalizm synowski, którego ewolucyjna rola polega na możliwości przetrwania głodu[91].
Wzrost i rozwój
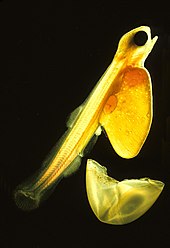
Życie Teleostei przebiega w czterech etapach: jajo, larwa, osobnik młodociany i dorosły. Może się ono zacząć w pelagialu bądź demersalu (w pobliżu dna). Większość morskich doskonałokostnych ma jaja pelagiczne, przezroczyste i wyporne, w cienkiej otoczce. Polegają one na prądach oceanicznych w rozprzestrzenianiu się, a rodzice nie opiekują się nimi. Po wykluciu się planktoniczna larwa nie potrafi jeszcze pływać. Dysponuje pęcherzykiem żółtkowym zapewniającym jej pokarm. Większość gatunków słodkowodnych składa jaja demersalne, grube, pigmentowane, względnie ciężkie i zdolne do przyczepienia się do podłoża. W przeciwieństwie do swych pelagicznych odpowiedników wylęgające się z nich larwy potrafią pływać i odżywiać się zaraz po opuszczeniu jaja[76]. Larwy doskonałokostnych często w ogóle nie przypominające osobników dorosłych, zwłaszcza u gatunków morskich. Niektóre larwy uznawano wręcz za osobne gatunki. Larwy cechuje znaczna umieralność. Większość z nich umiera z głodu bądź na skutek drapieżnictwa w pierwszym tygodniu swego życia. Ze wzrostem umieralność spada, nabywają większej tolerancji i wrażliwości fizjologicznej, zdolności ekologicznych i behawioralnych[92].
Osobniki młodociane wyglądają podobnie do form dorosłych. W pełni rozwinięte są już szkielet osiowy, narządy wewnętrzne, łuski, pigmentacja i płetwy. Przejście z etapy larwy do etapy osobnika młodocianego może być proste i krótkie, jak u garbikowatych. U innych gatunków, jak u łososia, Holocentrinae, babkowatych i flądrokształtnych jest to proces bardziej złożony, trwający kilka tygodni[93]. Jako dorosłe osobniki doskonałokostne zdolne są do tworzenia gamet i rozrodu. Jak wiele ryb, rosną one przez całe życie. Długość życia zależy od gatunku. Niektóre ryby łowne jak okoń pospolity czy bass wielkogębowy żyją do 25 lat. Istnieją też gatunki żyjące ponad 100 lat[94].
Ławice
Wiele doskonałokostnych tworzy ławice, co u różnych gatunków spełnia różne funkcje. Czasami jest to adaptacja przeciwdziałająca drapieżnictwu, poprawiająca ich wykrywanie. Często w grupie wydajniej zdobyć pokarm, pojedyncza ryba optymalizuje swą strategię, dołączając do ławicy bądź ją opuszczając. Gdy zauważony zostanie drapieżnik, jego potencjalna zdobycz odpowiada defensywnie kolektywnym zachowaniem, jak zsynchronizowane ruchy ławicy. Jej reakcja nie ogranicza się tylko do ukrycia się bądź ucieczki, występuje też na przykład rozdrobnienie ławicy i ponowne jej zebranie się. Ponadto ryby gromadzą się w celach rozrodczych[95].
Relacje z człowiekiem
Ekonomia
Teleostei są na różne sposoby ważne z ekonomicznego punktu widzenia. Chwyta się je dla pożywienia na całym świecie. Niewielka liczba gatunków, w tym śledzi, dorsz atlantycki, Pollachius sp., sardela europejska, tuńczyk pospolity i makrela atlantycka zapewniają ludzkości miliony ton pożywienia każdego roku. Natomiast wiele innych gatunków ryb poławia się w skromniejszych ilościach[96]. Doskonałokostne stanowią też większą część ryb poławianych sportowo[97]. Łowienie komercyjne i rekreacyjne zapewnia pracę milionom ludzi[98].
Niewielka liczba gatunków produktywnych obejmująca karpia, łososia[99], tilapię i sumokształtne hodowana jest na komercyjnych farmach, produkujących miliony ton bogatego w białku pokarmu rocznie. Specjaliści FAO przewidują ostry wzrost produkcji, do 2030 62% zjadanych przez człowieka ryb ma pochodzić z farm[100].
Ryby zjada się świeże bądź zachowuje tradycyjnymi metodami, obejmującymi kombinacje suszenia, dymienia, solenia i fermentacji[101]. Współczesne metody obejmują zamrażanie, suszenie na zimno i obróbkę cieplną (także podczas konserwacji). Z zamrożonych ryb czyni się filety, paluszki rybne oraz ciasto rybne. Ryby służą też za dodatek do pożywienia na farmach rybnych i innych zwierząt. Olej rybi robiony jest z wątroby, bogaty zwłaszcza w witaminy A i D, bądź z ciał ryb oleistych jak sardynka czy śledź, służy do suplementacji witamin i leczenia ich niedoborów[102].
Niektóre mniejsze i bardziej kolorowe gatunki służą jako okazy akwariowe i zwierzęta domowe. Zębaczowate wykorzystał przemysł skórzany. Z ryb wytwarza się też karuk[97].
Wędkarstwo
Również dla wędkarzy doskonałokostne, jako znakomita większość występujących na świecie ryb, są niezwykle ważne. Wędkarstwo zaczyna się od ryby, jednak dla osób uprawiających ten sport liczy się ona inaczej niż dla rybaka – dla wędkarzy nie jest towarem, lecz jako zdobycz – przede wszystkim potwierdzeniem opanowanej sztuki[103]. Coraz częściej wędkarze wypuszczają złowione ryby[104]. Z ekonomicznego punktu widzenia z wędkarstwem wiąże się przede wszystkim przemysł wyrobu sprzętu, często zaawansowanego technologicznie[105] (np. nowoczesne włókna węglowe produkowane z udziałem nanotechnologii do wyrobu blanków wędzisk i rotorów kołowrotków[106]) oraz gałąź turystyczna gospodarki. W krajach, gdzie stoi ona na wysokim poziomie (np. w Szwecji), odgrywa dość istotną rolę w gospodarce krajowej jako ważny rodzaj turystyki[107]. Także w Polsce podejmowane są inicjatywy mające na celu propagowanie tego sportu[108]. Doskonałokostne są poławiane wszystkimi metodami dozwolonymi przez prawo (przepisy te w Polsce reguluje Ustawa o rybactwie śródlądowym z 18 IV 1985 r.[109]) oraz etykę wędkarską, np[110]: drapieżne szczupaki na spinning[111] lub trolling, leszcze i karpie metodą gruntową (w tym na feeder) i spławik, turboty na surfcasting czy lipienie na muchę. Wszystko to wpływa na dużą różnorodność tego sportu, która zwiększa jego popularność[110].
Wpływ na pogłowie
Działania człowieka wpłynęły na pogłowie wiele gatunków doskonałokostnych poprzez nadmierne połowy[112], zanieczyszczenie środowiska i globalne ocieplenie. Wśród wielu odnotowanych przypadków przełowienie spowodowało całkowitą zapaść nowofundlandzkiej populacji dorsza atlantyckiego w 1992, w efekcie czego Kanada nieodwołalnie zaprzestała połowu. Niektóre wymarcia z komercyjnego punktu widzenia nie oznaczają jednak rzeczywistego wymarcia gatunku[113]. Zanieczyszczenie, zwłaszcza rzek i terenów przybrzeżnych, szkodzą rybom, gdy ścieki, pestycydy i herbicydy dostają się do wody. Wiele trucizn, jak metale ciężkie, chlorowcopochodne i karbaminiany, zakłócają rozród ryb doskonałokostnych, często przez zaburzenie ich układu endokrynnego. W przypadku płoci zanieczyszczenie rzek powoduje powstawanie osobników hermafrodytycznych, których gonady zawierają komórki wytwarzające gamety męskie (spermatogonia) i żeńskie oogonia). Jako że zaburzenia endokrynne dotykają także ludzi, doskonałokostne służą jako wskaźnik obecności takich substancji w wodzie. Zanieczyszczenie wód doprowadziło do lokalnych wymierań populacji doskonałokostnych w wielu jeziorach północnej Europy w II połowie XX wieku[114].
Efekty zmian klimatycznych na Teleostei mogą być silne i złożone. Przykładowo zwiększone opady zimowe (deszcz, śnieg) mogą szkodzić populacjom ryb słodkowodnych Norwegii, natomiast cieplejsze opady w lecie zwiększać wzrost dorosłych ryb[115]. W oceanach Teleostei mogą radzić sobie z ociepleniem tak jak z naturalnymi zmianami w klimacie[116]. Nie jest pewne, jak zakwaszenie oceanów, powodowane zwiększonym stężeniem dwutlenku węgla, wpływa na doskonałokostne[117].
Inne interakcje

Nieliczne gatunki są niebezpieczne dla człowieka. Zalicza się doń węgorz elektryczny i elektryczne sumy Malapteruridae, które mogą porazić prądem. Inne, jak piraniowate czy Sphyraena, dysponują potężnym ugryzieniem i czasami atakują kąpiących się ludzi[97].
Ryżanka japońska i danio pręgowany służą jako modele badawcze w badaniach z dziedziny genetyki i biologii rozwoju. Danio to najczęściej używany w laboratoriach kręgowiec[97], prezentujący genetyką przypominającą ssaczą, małej wielkości, o niewyszukanych wymaganiach środowiskowych, wydaje dużo potomstwa, szybko rośnie i posiada zdolność absorbowania mutagenów dodawanych do wody[118].
W sztuce
Teleostei był często przedstawiane w sztuce, co odzwierciedlało ich rolę ekonomiczną przez przynajmniej 14 tysięcy lat. Często ukazywano je w Starożytnym Egipcie, w Starożytnym Rzymie i Helladzie miały znaczenie mitologiczne. Stały się symbolem chrześcijaństwa. Artyści z Chin i Japonii podobnie wykorzystywali ryby w symbolice. Teleostei pojawiały się często w sztuce renesansu, na obrazach martwej natury osiągających szczyt popularności w Holandii w XVII wieku. W XX stuleciu różnorodni artyści tacy jak Paul Klee, René Magritte, Henri Matisse i Pablo Picasso wykorzystywali przedstawienia ryb do wyrażania radykalnie różnych motywów, od atrakcyjności do przemocy[119]. Zoolog i artysta Ernst Haeckel namalował doskonałokostne i inne zwierzęta w 1904 w Kunstformen der Natur. Haeckel został przekonany przez Goethego i Humboldta, że tworzenie dokładnych przestawień nieznanych form życia, jak tych żyjących w głębinach oceanów, nie tylko pozwala odkryć prawa rządzące ich powstaniem i ewolucją, ale także kładzie nacisk na ukryte fragmenty ich piękna[120].
Rysunek naścienny przedstawiający połów, grobowiec skryby Menna, Teby, Starożytny Egipt, ok. 1422–1411 p.n.e.
Renesans: Ryby, Antonio Tanari, cok. 1610–1630, Willa Medyceuszów, Poggio a Caiano
Mandarin Fish, Bian Shoumin, Dynastia Qing, XVIII wiek
Martwa natura z makrelą, cytrynami i pomidorem, Vincent Van Gogh, 1886
"Teleostei", Ernst Haeckel, 1904. Cztery gatunki, otoczone łuskami
"Ostraciontes", Ernst Haeckel, 1904. 10 doskonałokostnych, w środku Lactoria cornuta
Fish Magic, Paul Klee, olej i akwarela, 1925
Przypisy
- ↑ Teleostei, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ Douglas Palmer: The Marshall Illustrated Encyclopedia of Dinosaurs & Prehistoric animals. Marshall Editions Developments, 1999. ISBN 978-1-84028-152-1.
- ↑ The Paleobiology Database. The Paleobiology Database, 14 June 2013.
- ↑ Kilarski W., 2007: Zarys anatomii i histologii ryb doskonałokostnych. Olsztyn: Instytut Rybactwa Śródlądowego. ISBN 978-83-60111-20-8.
- ↑ Szatańska D., 2007: Ryby : encyklopedia zwierząt. Warszawa: Wydawnictwo Naukowe PWN ISBN 978-83-01-15140-9.
- ↑ Bieńkowska_Wasiluk M., 2012: Gromada Osteichthyes – kostnoszkieletowe. W: Ginter M. (red.) Ryby kopalne. Wyd. Uniw. Warsz., strona 217
- ↑ Szarski H. 1990: Historia zwierząt kręgowych. PWN, strona 75.
- ↑ Patterson, C., Rosen, D.E.. Review of ichthyodectiform and other Mesozoic teleost fishes, and the theory and practice of classifying fossils. „Bulletin of the American Museum of Natural History”. 158 (2), s. 81–172, 1977.
- ↑ a b c d e The Evolution of Fishes After the Devonian. W: Benton, Michael: Vertebrate Palaeontology. Wyd. 3.. John Wiley & Sons, 2005, s. 175–84. ISBN 978-1-4051-4449-0.
- ↑ Vandewalle, P., Parmentier, E., Chardon, M.. The branchial basket in Teleost feeding. „Cybium”. 24 (4), s. 319–42, 2000. ISSN 0399-0974.
- ↑ Moriyama, Y., Takeda, H.. Evolution and development of the homocercal caudal fin in teleosts. „Development, growth and differentiation”. 55 (8), s. 687–98, 2013. DOI: 10.1111/dgd.12088.
- ↑ Bone, Q., Moore, R.: Biology of Fishes. Garland Science, 2008, s. 29. ISBN 978-0-415-37562-7.
- ↑ a b Greenwood, P., Rosen, D., Weitzman, S., Myers, G.. Phyletic studies of teleostean fishes, with a provisional classification of living forms. „Bulletin of the American Museum of Natural History”. 131, s. 339–456, 1966.
- ↑ Teleost. Merriam-Webster. [dostęp 2016-04-20].
- ↑ a b Gloria Arratia. Complexities of early Teleostei and the evolution of particular morphological structures through time. „Copeia”. 103 (4), s. 999–1025, 2015. DOI: 10.1643/CG-14-184. (ang.).
- ↑ Arratia, G.. Basal teleosts and teleostean phylogeny: response to C. Patterson. „Copeia”. 1998 (4), s. 1109–1113, 1998. DOI: 10.2307/1447369. JSTOR: 1447369.
- ↑ a b c d Near, Thomas J.. Resolution of ray-finned fish phylogeny and timing of diversification. „PNAS”. 109 (34), s. 13698–13703, 2012. DOI: 10.1073/pnas.1206625109.
- ↑ Betancur-R, Ricardo et al. The Tree of Life and a New Classification of Bony Fishes. „PLOS Currents Tree of Life”, 2013. DOI: 10.1371/currents.tol.53ba26640df0ccaee75bb165c8c26288. [zarchiwizowane z adresu 2018-02-02].
- ↑ Laurin, M., Reisz, R.R.. A reevaluation of early amniote phylogeny. „Zoological Journal of the Linnean Society”. 113, s. 165–223, 1995. DOI: 10.1111/j.1096-3642.1995.tb00932.x.
- ↑ Vertebrate Diversity: Actinopterygii – ray-finned fishes. University College London. [dostęp 2015-12-03].
- ↑ a b Helfman i in. 2009 ↓, s. 268–74
- ↑ Helfman i in. 2009 ↓, s. 274–76.
- ↑ EG. Drucker, GV. Lauder. Locomotor function of the dorsal fin in teleost fishes: experimental analysis of wake forces in sunfish.. „J Exp Biol”. 204 (Pt 17), s. 2943-58, Sep 2001. PMID: 11551984.
- ↑ Steward, T.A., Smith, W.L., Coates, M.I.. The origins of adipose fins: an analysis of homoplasy and the serial homology of vertebrate appendages. „Proceedings of the Royal Society B”. 281 (1781), s. 20133120, 2014. DOI: 10.1098/rspb.2013.3120.
- ↑ Miller, Stephen, Harley, John P.: Zoology. Wyd. 7. McGraw-Hill, 2007, s. 297.
- ↑ R. L. Dorit, W. F. Walker, R. D. Barnes: Zoology. Saunders College Publishing, 1991, s. 67–69. ISBN 978-0-03-030504-7.
- ↑ a b Guinness World Records 2015. Guinness World Records, 2014, s. 60. ISBN 978-1-908843-70-8.
- ↑ Martill, D.M. Leedsichthys problematicus, a giant filter-feeding teleost from the Jurassic of England and France. „Neues Jahrbuch fur Geologie und Palaontologie”. 11, s. 670–680, 1988.
- ↑ Growth, age and size of the Jurassic pachycormid Leedsichthys problematicus (Osteichthyes: Actinopterygii). W: Arratia, G., Schultze, H. & Wilson, M: Mesozoic Fishes 5 – Global Diversity and Evolution. München: Verlag Dr. Friedrich Pfeil, 2013, s. 145–175. ISBN 978-3-89937-159-8.Sprawdź autora rozdziału:1.
- ↑ Roach, John: World's Heaviest Bony Fish Discovered?. National Geographic News, 13-05-2003. [dostęp 2016-01-09]. [zarchiwizowane z tego adresu (2003-05-17)].
- ↑ Scientists Describe the World's Smallest, Lightest Fish. Scripps Institution of Oceanography, 20 July 2004. [dostęp 2016-04-09]. [zarchiwizowane z tego adresu (5 marca 2016)].
- ↑ Maddock, L., Bone, Q., Rayner, J.M.V.: The Mechanics and Physiology of Animal Swimming. Cambridge University Press, 1994, s. 54–56. ISBN 978-0-521-46078-1.
- ↑ Ross, David A.: The Fisherman's Ocean. Stackpole Books, 2000, s. 136–138. ISBN 978-0-8117-2771-6.
- ↑ Schreiber, Alexander M.. Asymmetric craniofacial remodeling and lateralized behavior in larval flatfish. „Journal of Experimental Biology”. 209, s. 610–621, 2006. DOI: 10.1242/jeb.02056.
- ↑ Jackson, John: How does the Remora develop its sucker?. National History Museum, 30-11-2012. [dostęp 2016-01-02].
- ↑ Combes, Claude: Parasitism: The Ecology and Evolution of Intimate Interactions. University of Chicago Press, 2001, s. 23. ISBN 978-0-226-11446-0.
- ↑ Caira, J.N., Benz, G.W., Borucinska, J., Kohler, N.E.. Pugnose eels, Simenchelys parasiticus (Synaphobranchidae) from the heart of a shortfin mako, Isurus oxyrinchus (Lamnidae). „Environmental Biology of Fishes”. 49, s. 139–144, 1997. DOI: 10.1023/a:1007398609346.
- ↑ Dudek & ICF International (2012). Desert Renewable Energy Conservation Plan (DRECP) Baseline Biology Report. California Energy Commission.
- ↑ a b Actinopterygii – ray-finned fishes. University College, London.
- ↑ N.V. Chernova, A.M. Friedlander, A. Turchik, E. Sala. Franz Josef Land: extreme northern outpost for Arctic fishes. „PeerJ”. 2, s. e692, 2014. DOI: 10.7717/peerj.692. PMID: 25538869. PMCID: PMC4266852.
- ↑ What is an anadromous fish? A catadromous fish?. [w:] Fish FAQ [on-line]. NOAA. [dostęp 2016-01-12]. [zarchiwizowane z tego adresu].
- ↑ Anguilla anguilla (Linnaeus, 1758). [w:] Cultured Aquatic Species Information Programme [on-line]. FAO: Fisheries and Aquaculture Department, 1-01-2004. [dostęp 2016-01-02].
- ↑ Timothy L.O Davis. Temporal changes in the fish fauna entering a tidal swamp system in tropical Australia. „Environmental Biology of Fishes”. 21, s. 161–172, 1988. Springer Link. DOI: 10.1007/BF00004860. (ang.).
- ↑ H.S. Raina, T. Petr: Coldwater Fish and Fisheries in The Indian Himalayas: Lakes and Reservoirs. Food and Agriculture Organization. [dostęp 6 -01-2016].zły zapis daty dostępu
- ↑ Morelle, Rebecca: 'Deepest ever' living fish filmed. BBC News, 7-10-2008. [dostęp 2016-02-05].
- ↑ Morelle, Rebecca: New record for deepest fish. BBC News, 19-12-2014. [dostęp 2016-02-05].
- ↑ Meurant, Gerard: Fish Physiology V10A. Academic Press, 1984, s. 263–. ISBN 978-0-08-058531-4.
- ↑ Liem, Karel F.: Paxton, J.R., Eschmeyer, W.N.: Encyclopedia of Fishes. Academic Press, 1998, s. 173–174. ISBN 0-12-547665-5.
- ↑ Armbruster, Jonathan W.. Modifications of the digestive tract for holding air in loricariid and scoloplacid catfishes. „Copeia”, s. 663–675, 1998. DOI: 10.2307/1447796.
- ↑ James Orr: Fish. Microsoft Encarta 99, 1999. ISBN 0-8114-2346-8.
- ↑ Seraphina Chung. Appropriate maze methodology to study learning in fish. „Journal of Undergraduate Life Sciences”.
- ↑ Bentley, P.J.: Endocrines and Osmoregulation: A Comparative Account in Vertebrates. Springer, 2013, s. 26. ISBN 978-3-662-05014-9.
- ↑ Whittow, G. Causey: Comparative Physiology of Thermoregulation: Special Aspects of Thermoregulation. Academic Press, 2013, s. 223. ISBN 978-1-4832-5743-3.
- ↑ McFarlane, Paul: Warm-blooded fish. [w:] Monthly Bulletin [on-line]. Hamilton and District Aquarium Society, 1-01-1999. [dostęp 2016-01-06]. [zarchiwizowane z tego adresu].
- ↑ a b R. Aidan Martin: Fire in the Belly of the Beast. ReefQuest Centre for Shark Research, 1992. [dostęp 2016-01-06].
- ↑ Tuna: biology of tuna. [w:] Free Encyclopedia [on-line]. [dostęp 2016-01-02].
- ↑ Brown, W. Duane. The concentration of myoglobin and hemoglobin in tuna flesh. „Journal of Food Science”. 27 (1), s. 26–28, 1962. DOI: 10.1111/j.1365-2621.1962.tb00052.x.
- ↑ Fritsches, Kerstin: Warm eyes give deep-sea predators super vision. University of Queensland, 11-01-2005. [dostęp 2016-01-06].
- ↑ K. Kardong: Vertebrates: Comparative anatomy, function, evolution. Wyd. 5th. Boston: McGraw-Hill, 2008. ISBN 0-07-304058-4.
- ↑ Marisa N. Fernandes: Fish Respiration and Environment. CRC Press, 8 January 2007, s. 42. ISBN 978-1-4398-4254-6.
- ↑ Numerical Studies of Hydrodynamics of Fish Locomotion and Schooling by a Vortex Particle Method. ProQuest, 2008, s. 1–4. ISBN 978-1-109-14490-1.
- ↑ Kapoor, B.G., Khanna, Bhavna: Ichthyology Handbook. Springer, 2004, s. 149–151. ISBN 978-3-540-42854-1.
- ↑ a b Patzner, Robert, Van Tassell, James L., Kovacic, Marcelo, Kapoor, B.G.: The Biology of Gobies. CRC Press, 2011, s. 261, 507. ISBN 978-1-4398-6233-9.
- ↑ Pace, C.M.; Gibb A.C. Mudskipper pectoral fin kinematics in aquatic and terrestrial environments. „The Journal of Experimental Biology”. 212, s. 2279–2286, 2009. DOI: 10.1242/jeb.029041. PMID: 19561218.
- ↑ Jamon, M, Renous, S, Gasc, J.P., Bels, V i inni. Evidence of force exchanges during the six-legged walking of the bottom-dwelling fish, Chelidonichthys lucerna. „Journal of Experimental Zoology”. 307 (9), s. 542–547, 2007. DOI: 10.1002/jez.401. PMID: 17620306.
- ↑ Dasilao, J.C., Sasaki, K.. Phylogeny of the flyingfish family Exocoetidae (Teleostei, Beloniformes). „Ichthyological Research”. 45 (4), s. 347–353, 1998. DOI: 10.1007/BF02725187.
- ↑ Wootton i Smith 2014 ↓, s. 56.
- ↑ Springer, Joseph, Holley, Dennis: An Introduction to Zoology. Jones & Bartlett Publishers, 2012, s. 370. ISBN 978-0-7637-5286-6.
- ↑ Wootton i Smith 2014 ↓, s. 55.
- ↑ a b c Helfman i in. 2009 ↓, s. 457
- ↑ Wootton i Smith 2014 ↓, s. 53.
- ↑ Wootton i Smith 2014 ↓, s. 71–80.
- ↑ Wootton i Smith 2014 ↓, s. 81–82.
- ↑ Wootton i Smith 2014 ↓, s. 82–83.
- ↑ Wootton i Smith 2014 ↓, s. 83–85.
- ↑ a b c Laying, E.: Fish Reproduction. [dostęp 2016-01-07].
- ↑ a b Wootton i Smith 2014 ↓, s. 54
- ↑ Helfman i in. 2009 ↓, s. 458.
- ↑ Wooten and Smith pp. 600–601
- ↑ Helfman i in. 2009 ↓, s. 465.
- ↑ a b Helfman i in. 2009 ↓, s. 463
- ↑ Muñoz, R., Zgliczynski, B., Laughlin, J., Teer, B.. Extraordinary aggressive behavior from the giant coral reef fish, Bolbometopon muricatum, in a remote marine reserve. „PLOS ONE”. 7 (6), s. e38120, 2012. DOI: 10.1371/journal.pone.0038120.
- ↑ Helfman i in. 2009 ↓, s. 473.
- ↑ Helfman i in. 2009 ↓, s. 465–68.
- ↑ a b John Reynolds, Nicholas B. Goodwin, Robert P. Freckleton. Evolutionary Transitions in Parental Care and Live Bearing in Vertebrates. „Philosophical Transactions of the Royal Society B: Biological Sciences”. 357 (1419), s. 269–281, 19-03-2002. DOI: 10.1098/rstb.2001.0930. PMID: 11958696. PMCID: PMC1692951.
- ↑ T. H. Clutton-Brock: The Evolution of Parental Care. Princeton, NJ: Princeton University Press, 1991.
- ↑ John Werren, Mart R. Gross, Richard Shine. Paternity and the evolution of male parentage. „Journal of Theoretical Biology”. 82 (4), s. 619–631, 1980. DOI: 10.1016/0022-5193(80)90182-4. [dostęp 2013-09-15].
- ↑ Jeffrey Baylis. The Evolution of Parental Care in Fishes, with reference to Darwin's rule of male sexual selection. „Environmental Biology of Fishes”. 6 (2), s. 223–251, 1981. DOI: 10.1007/BF00002788.
- ↑ Wootton i Smith 2014 ↓, s. 520.
- ↑ Wootton i Smith 2014 ↓, s. 57, 523–30.
- ↑ Helfman i in. 2009 ↓, s. 472–73.
- ↑ Helfman i in. 2009 ↓, s. 146–47
- ↑ Helfman i in. 2009 ↓, s. 149.
- ↑ Helfman i in. 2009 ↓, s. 153–56.
- ↑ Pitcher, Tony J.. Functions of Shoaling Behaviour in Teleosts. „The Behaviour of Teleost Fishes”, s. 294–337, 1986. Springer. DOI: 10.1007/978-1-4684-8261-4_12.
- ↑ Capture production by principal species in 2012. Food and Agriculture Organization. [dostęp 2016-02-10].
- ↑ a b c d S.M. Kisia: Vertebrates: Structures and Functions. CRC Press, 2010, s. 22. ISBN 978-1-4398-4052-8.
- ↑ New Economic Report Finds Commercial and Recreational Saltwater Fishing Generated More Than Two Million Jobs. National Oceanic and Atmospheric Administration. [dostęp 2016-02-10]. [zarchiwizowane z tego adresu (2017-03-13)].
- ↑ Scottish Fish Farm Production Survey 2014. The Scottish Government/Riaghaltas na h-Alba, September 2015. ISBN 978-1-78544-608-5.
- ↑ Fish to 2030 : prospects for fisheries and aquaculture (Report 83177). Food and Agriculture Organization; World Bank Group, 1-12-2013. [dostęp 2016-01-03]. [zarchiwizowane z tego adresu (2-2-2016)].
- ↑ Fish and fish products. Food and Agriculture Organization of the United Nations. [dostęp 2016-04-08].
- ↑ Sajid Maqsood, Prabjeet Singh, Munir Hassan Samoon, Gohar Bilal Wani: Various fish And fish Products Being Produced In Fish Processing Industries And Their Value Addition. Aquafind (Aquatic Fish Database). [dostęp 2016-04-08].
- ↑ Stanisław Stupkiewicz, Wędkarstwo nowoczesne, wyd. Wydanie drugie, Warszawa: Wydawnictwo Alfa, 1992, s.7-15., ISBN 83-7001-735-5.
- ↑ Rekordy Polski w Długości Ryby, wedkarskiswiat.pl [dostęp 2016-12-31] (pol.).
- ↑ FAO: (1964) Modern Fishing Gear Of The World 2 Fishing News Books. Resulting from the first FAO Fishing Gear Congress held in Hamburg in 1957. Download PDF (69MB)
- ↑ Marek Kluczek, Rynek, Andrzej Zieliński (red.), „Wiadomości Wędkarskie”, Warszawa: Wiadomości Wędkarskie, styczeń 2017, s. 43-48, ISSN 0137-8104.
- ↑ Bartosz Szydłowski, Królestwo Szwecji – rynek turystyczny, kwiecień 2014 (pol.).
- ↑ Elżbieta Niedziejko, Turystyka wędkarska na obszarze objętym Lokalną Strategią Rozwoju Obszarów Rybackich (LSROR), 2014 (pol.).
- ↑ Dz.U. z 2018 r. poz. 1476
- ↑ a b Tadeusz Andrzejczyk: Wędkarstwo jeziorowe. PWRiL, Warszawa 1984, Wydanie V, str. 148-167. ISBN 83-09-00498-2
- ↑ Wędkarstwo spinningowe, Metoda spinningowa | porady, metoda – wedkuje.pl, wedkuje.pl [dostęp 2016-04-20] (pol.).
- ↑ Vince, Gaia: How the world's oceans could be running out of fish. BBC, 20-09-2012. [dostęp 2016-05-01].
- ↑ R. Kunzig. Twilight of the Cod. „Discover”, s. 52, 1995. [dostęp 2016-05-01].
- ↑ Robert J. Wootton, Carl Smith: Reproductive Biology of Teleost Fishes. John Wiley & Sons, 2014, s. 123–125. ISBN 978-0-632-05426-8.
- ↑ Martin Kernan, Richard W. Battarbee, Brian R. Moss: Climate Change Impacts on Freshwater Ecosystems. John Wiley & Sons, 2011, s. 93. ISBN 978-1-4443-9127-5.
- ↑ Fisheries Management and Climate Change in the Northeast Atlantic Ocean and the Baltic Sea. Nordic Council of Ministers, 2008, s. 48. ISBN 978-92-893-1777-1.
- ↑ Committee on the Review of the National Ocean Acidification Research and Monitoring Plan, Ocean Studies Board, Division on Earth and Life Studies, National Research Council: Review of the Federal Ocean Acidification Research and Monitoring Plan. National Academies Press, 2013, s. 3. ISBN 978-0-309-30152-7.
- ↑ Five reasons why zebrafish make excellent research models. NC3RS, 10-04-2014. [dostęp 2016-02-15].
- ↑ Peter B. Moyle, Marilyn A. Moyle. Introduction to fish imagery in art. „Environmental Biology of Fishes”. 31 (1), s. 5–23, May 1991. DOI: 10.1007/bf00002153.
- ↑ Robert J. Richards: The Tragic Sense of Ernst Haeckel: His Scientific and Artistic Struggles. University of Chicago. [dostęp 2016-04-30].
Bibliografia
- G. Helfman, B.B. Collette, D.E. Facey, B.W. Bowen: The Diversity of Fishes: Biology, Evolution, and Ecology. Wyd. 2.. Wiley-Blackwell, 2009. ISBN 978-1-4051-2494-2.
- Robert J. Wootton, Carl Smith: Reproductive Biology of Teleost Fishes. Wiley, 2014. ISBN 978-1-118-89139-1.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Gills
Snaggletooth subfamily of dragonfishes ( Astronesthes similus ). Gulf of Mexico.
6-8: Scrawled Cowfish 9: Striped Cowfish 10: Humpback Turretfish
Trout-perch (Percopsis omiscomaycus)
Salmo salar, Atlantic Salmon, Salmoniformes, Salmonidae, Salmoninae, salmon, fish / (crop, levels)
For index to numbers, see here.
- Pegasus chiropterus (Haeckel) = Pegasus laternarius Cuvier, 1816?, side view
- Hippocampus antiquorum (Leach) = Hippocampus hippocampus (Linnaeus, 1758), side view
- Phyllopteryx eques (Günther) = Phycodurus eques (Günther, 1865), top view
- Antennarius tridens (Bleeker) = Antennarius striatus (Shaw, 1794), side view
- Chrysophrys aurata (Cuvier) = Sparus aurata Linnaeus, 1758, scale in top view
- Pagellus erythrinus (Cuvier) = Pagellus erythrinus (Linnaeus, 1758), scale in top view
- Box vulgaris (Cuvier) = Boops boops (Linnaeus, 1758), scale in top view
- Anthias sacer (Schneider) = Anthias anthias (Linnaeus, 1758), scale in top view
- Apogon imberbis (Günther) = Apogon imberbis (Linnaeus, 1758), scale in top view
- Centriscus scolopax (Cuvier) = Macroramphosus scolopax (Linnaeus, 1758), scale in top view
- Hypostomum plecostomum (Cuvier) = Hypostomus plecostomus (Linnaeus, 1758), scale in top view
- Fistularia chinensis (Lacépede) = Aulostomus chinensis (Linnaeus, 1766), scale in top view
- Solea vulgaris (Quensel) = Solea solea (Linnaeus, 1758), scale in top view
- Scarus enneacanthus (Bleeker) = Chlorurus enneacanthus (Lacepède, 1802), scale in top view
- Haemulon elegans (Cuvier) = Haemulon sciurus (Shaw, 1803), scale in top view
- Cantharus vulgaris (Cuvier) = Spondyliosoma cantharus (Linnaeus, 1758), scale in top view
Autor: Internet Archive Book Images, Licencja: No restrictions
Title: Description des reptiles nouveaux ou imparfaitement connus de la collection du Muséum d'histoire naturelle et remarques sur la classification et les caractères des reptiles
Identifier: descriptiondesre00dum (find matches)
Year: 1852 (1850s)
Authors: Duméril, Auguste Henri André, 1812-1870
Subjects: Muséum national d\U+2019\histoire naturelle (France); Reptiles; Reptiles
Publisher: (Paris : Muséum d'histoire naturelle)
Contributing Library: Harvard University, Museum of Comparative Zoology, Ernst Mayr Library
Digitizing Sponsor: Harvard University, Museum of Comparative Zoology, Ernst Mayr Library
View Book Page: Book Viewer
About This Book: Catalog Entry
View All Images: All Images From Book
Click here to view book online to see this illustration in context in a browseable online version of this book.
Text Appearing Before Image:
â¢x > Eâ à =3
Text Appearing After Image:
^ ^ 5j 1 I 5 o
Note About Images
Szczupak pospolity
Fig. 89. The Barramunda (Ceratodus) (From Queensland.)
Autor: User:Haplochromis, Licencja: CC BY-SA 3.0
Aspidorhynchus acustirostris
Zeus faber
Autor: Autor nie został podany w rozpoznawalny automatycznie sposób. Założono, że to Uwe kils (w oparciu o szablon praw autorskich)., Licencja: CC-BY-SA-3.0
atlantic herring (Clupea harengus) for award image by en:User:Uwe Kils
Autor: André-Philippe D. P., Licencja: CC BY-SA 3.0
Pirhana jaws (Serrasalminae family). This specimen is supposed to come from Brazil.
Autor: Bruno de Giusti, Licencja: CC BY-SA 2.5 it
An underwater picture taken in Moofushi Kandu, Maldives, showing predator bluefin trevally sizing up schooling anchovies
Autor: Muñoz RC, Zgliczynski BJ, Laughlin JL, Teer BZ, Licencja: CC0
Sexual dimorphism in Bolbometopon muricatum
Illustrations of Hypomesus pretiosus (surf smelt) and Hypomesus olidus (pond smelt), labelled as California Surf Smelt and Alaska Surf Smelt, respectively.
Selection of paintings of teleost fish by Francis de Laporte de Castelnau from his Expédition dans les parties centrales de l'Amérique du Sud, de Rio de Janeiro à Lima et de Lima au Para sous la direction du Comte Francis de Castelnau, 1856
Autor: Lehtonen T, Svensson P, Wong B, Licencja: CC BY 4.0
Male desert goby (Chlamydogobius eremius) courting a female
Autor: , Licencja: CC BY-SA 3.0
Akwaria hodowlane danio pręgowanego na potrzeby naukowe.
Fathead minnow, (Pimephales promelas), taken from USFWS website -- stated there to be PD
Autor: Abigail Wark, Licencja: CC BY 2.5
Head of a threespine stickleback (Gasterosteus aculeatus) stained with the fluorescent dye DASPEI to reveal clusters of sensory hair cells called neuromasts that make up the lateral line sensory system. Threespine sticklebacks from marine and freshwater habitats have evolved differences in neuromast number and patterning across the body. The genetic architecture underlying the evolution of the lateral line system in these fish was investigated with genetic linkage mapping. Image courtesy of Abigail Wark.
Autor: Nhobgood - Nick Hobgood, Licencja: CC BY-SA 3.0
Purple anemone (Heteractis magnifica) and resident anemonefish (Amphiprion ocellaris) (clownfish) in East Timor.
Lepisosteus osseus
Ijimaia plicatellus
Gonorynchus gonorynchus
Fish Magic. Oil and watercolor varnished. 76.8 x 98.1 cm. The Philadelphia Museum of Art, Philadelphia, PA, USA
Autor: User:Uwe Gille, Licencja: CC-BY-SA-3.0
Swim bladder of a Ruddy (Scardinius erythrophthalmus)
This photograph was alleged to show U.S. servicemen in Laos during the Vietnam War with a captured Mekong Dragon, Phaya Naga, Mekong Naga, or enormously overgrown eel. It was widely circulated in Laos ([1]). The photograph was actually taken in 1996 and shows a giant oarfish (Regalecus glesne) found on the shore of the Pacific Ocean near San Diego, California. This extremely rare specimen was 23 ft (7.0 m) long and weighed 300 lb (140 kg). The original photograph can be seen on page 20 of the April 1997 issue of All Hands.
alepocephalus rostratus
(c) Richard Dorrell, CC BY-SA 2.0
Loch Ainort fish farm The salmon farm is operated by Marine Harvest. On the far shore of the loch, the community of Luib nestles beneath Glas Bheinn Mhòr (on the right) Beinn na Crò, Beinn Dearg Mhòr and Beinn na Caillich (on the left).
Conger conger
Autor: Georges Cuvier, Licencja: CC BY-SA 3.0
Planche N° 105 du livre "Le règne animal distribué d'après son organisation" par Georges Cuvier (Tome 8), seconde édition de 1828, représentant : Polypterus senegalus
Aulopus filamentosus
Fish head parts
Atlantic Sturgeon, Acipenser oxyrhynchus. Scans of artwork commissioned by the Fish and Wildlife Service in the 1970's. Original art is kept at NCTC museum.
Autor: The Interior, Licencja: CC BY 3.0
Video of spawning sockeye salmon in side channels of the Lower Adams River, Roderick Haig-Brown provincial Park, British Columbia.
Autor: Uwe Kils, Licencja: CC-BY-SA-3.0
Salmon egg hatching (Salmo salar) - the Alevin (larva) has grown around the remains of the yolk sac - visible are the arteries spinning around the yolk and little oildrops, also the gut, the spine, the main caudal blood vessel, the bladder and the arcs of the gills. In about 24hrs it will be a fry without yolk sac.
Mandarin Fish, Bian Shoumin, Qing Dynasty, China, Wuxi Antique Store
Taf. V.
Remora, Belize Barrier Reef
Fish Still Life with Stormy Sea, a Dutch Golden Age painting combining maritime painting with the Dutch still life
Cyprinus carpio
Homocercal tail of a Flounder, Paralichthys californicus
- Subject: Flatfishes--Anatomy
- Tag: Fish
Autor: Thesupermat, Licencja: CC BY-SA 3.0
Gymnarque du Nil à l'aquarium tropical de la porte dorée à Paris.
Autor: Paul V. Loiselle, Licencja: CC BY-SA 3.0
Cyprinodon macularius initiation of spawning act
Flying fish shortly after take-off
Autor: Nilsson, M. A.; Churakov, G.; Sommer, M.; Tran, N. V.; Zemann, A.; Brosius, J. R.; Schmitz, J. R., Licencja: CC BY 2.5
Shrew opossum. doi:10.1371/journal.pbio.1000436.g002
Autor: Jaro Nemčok, Licencja: CC BY-SA 3.0
Pregnant seahorse in the New York Aquarium in Brooklyn, NY