|
 | | Cr3+ F− |
|
|
| Ogólne informacje |
| Wzór sumaryczny | CrF3 |
| Masa molowa | 108,99 g/mol |
| Wygląd | krystaliczne, zielone ciało stałe |
| Identyfikacja |
| Numer CAS | 7788-97-8 |
| PubChem | 10154021 |
| SMILES |
|---|
[Cr+2].[F-].[F-].[F-], [Cr+3].[F-].[F-].[F-] |
|
| InChI |
|---|
InChI=1S/Cr.3FH/h;3*1H/q+3;;;/p-3 | FTBATIJJKIIOTP-UHFFFAOYSA-K |
|
|
|
| Niebezpieczeństwa |
|---|
| Karta charakterystyki: dane zewnętrzne firmy Sigma-Aldrich [dostęp 2015-05-08] | | Globalnie zharmonizowany system
klasyfikacji i oznakowania chemikaliów | | Na podstawie podanej karty charakterystyki | | | | Zwroty H | H302+H312+H332, H314, EUH029 | | Zwroty P | P280, P305+P351+P338, P310 | | | Europejskie oznakowanie substancji | | oznakowanie ma znaczenie wyłącznie historyczne | | Na podstawie podanej karty charakterystyki |  | Żrący
(C) |
| | | Zwroty R | R20/21/22, R31, R34 | | Zwroty S | S26, S27, S28, S36/37/39, S45 | | | Numer RTECS | GB6125000 |
|
| Podobne związki |
| Inne aniony | CrCl3 |
| Inne kationy | MnF3, AlF3 |
Jeżeli nie podano inaczej, dane dotyczą
stanu standardowego (25 °C, 1000 hPa) |
Fluorek chromu(III), CrF3 – nieorganiczny związek chemiczny z grupy chlorków, sól kwasu fluorowodorowego i chromu na III stopniu utlenienia.
Właściwości
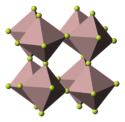
Fluorek chromu(III) jest krystalicznym ciałem stałym o zielonej barwie, nierozpuszczalnym w wodzie i etanolu[2]. Topi się w temperaturze powyżej 1000 °C[1] lub w 1400 °C[2]. Tworzy hydraty zawierające 3–9 cząsteczek wody, przy czym związki o niskiej zawartości wody mają barwę zieloną, a związki wysoko uwodnione są fioletowe[1]. Wszystkie wodziany mają strukturę oktaedryczną. W substancjach zielonych występują cząsteczki CrF3(H2O)3, natomiast substancje fioletowe zawierają jony [Cr(H2O)6]3+, jak np. związek dziewięciowodny, [Cr(H2O)6]F3·3H2O[3].
Otrzymywanie
Bezwodny fluorek chromu(III) można otrzymać podczas ogrzewania chlorku chromu(III) w strumieniu fluorowodoru[4]:
- CrCl3 + 3HF → CrF3 + 3HCl
Na skalę przemysłową uwodniony zielony fluorek chromu(III) otrzymuje się w reakcji uwodnionego tlenku chromu(III) z gorącym kwasem fluorowodorowym[1]:
- Cr2O3 + 6HF + 3H2O → 2CrF3(H2O)3↓
Zastosowanie
Fluorek chromu(III) jest używany w technologiach barwników i pigmentów oraz jako inhibitor korozji[1].
Przypisy
- ↑ a b c d e f g GerdG. Anger GerdG. i inni, Chromium Compounds, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, ISBN 978-3-527-30385-4 (ang.).
- ↑ a b CRC Handbook of Chemistry and Physics, David R.D.R. Lide (red.), wyd. 83, Boca Raton: CRC Press, 2002, s. 4-18, ISBN 978-0-8493-1556-5 .
- ↑ Frank H. Herbstein, Moshe Kapon, George M. Reisner. Crystal structures of chromium(III) fluoride trihydrate and chromium(III) fluoride pentahydrate. Structural chemistry of hydrated transition metal fluorides. Thermal decomposition of chromium(III) fluoride nonahydrate. „Zeitschrift für Kristallographie – Crystalline Materials”. 171 (3–4), s. 209–224, 1985. DOI: 10.1524/zkri.1985.171.3-4.209.
- ↑ W. Kwasnik: Fluorine compounds. W: Handbook of Preparative Inorganic Chemistry. Georg Brauer (red.). New York, London: Academic Press, 1963, s. 257.
Linki zewnętrzne