Grupy ochronne

Grupy ochronne (również: blokujące, protekcyjne, zabezpieczające) – rodzaj ugrupowań chemicznych tymczasowo przyłączanych do wybranych grup funkcyjnych związku wielofunkcyjnego w celu zapobiegania ich dalszym przekształceniom w toku syntezy organicznej[1][2]. O przydatności danej grupy ochronnej decyduje spełnienie następujących warunków[1]:
- jej wprowadzenie powinno zachodzić łatwo i z dużą wydajnością
- reagenty służące do jej wprowadzania powinny być dostępne handlowo i tanie lub być łatwe do otrzymania
- powinna być łatwa do scharakteryzowania chemicznego i nie prowadzić do komplikacji, takich jak wprowadzanie nowych centrów stereogenicznych
- powinna być stabilna podczas chromatografii
- musi być stabilna w jak największej ilości warunków chemicznych
- jej usunięcie powinno zachodzić selektywnie, z dużą wydajnością, w ściśle określonych warunkach
- produkty uboczne powstające w wyniku usunięcia grupy ochronnej powinny być łatwe do odseparowywania od pożądanego produktu oraz substratu
Wykorzystanie grupy ochronnej w toku syntezy dodaje przynajmniej dwa dodatkowe etapy do zaplanowanego ciągu syntetycznego – etap protekcji (zabezpieczania), w którym wybrane ugrupowanie jest dołączane do danej grupy funkcyjnej związku, blokując możliwość ulegania dalszym reakcjom, oraz etap deprotekcji (odbezpieczania), w którym grupa ochronna jest usuwana, przywracając daną grupę funkcyjną do pierwotnej postaci[3].
Rodzaje grup ochronnych
Grupy stosowane do protekcji alkoholi i fenoli
Najpopularniejsze metody zabezpieczania grup hydroksylowych wykorzystują ich przekształcenie w etery, acetale, ketale bądź estry[3].
Wybrane przykłady grup ochronnych alkoholi:
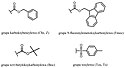
Etery
- eter metylowy (−Me) – jego stosowanie ogranicza się do ochrony grup fenolowych (Ar−OH); może zostać utworzony w wyniku np. reakcji Williamsona; do deprotekcji wymagane są stosunkowo drastyczne warunki, m.in. działanie BCl
3, BBr
3, AlCl
3 lub silnymi kwasami protonowymi, np. HBr lub MeSO
3H[4], - eter benzylowy (−Bn) – usuwany w wyniku hydrogenacji[3][5],
- eter trytylowy (−CPh
3, Tr) oraz jego pochodne, np. dimetoksytrytylowy (DMT) – usuwany za pomocą kwasu[6]; często wykorzystywane w syntezie oligonukleotydów[7], - eter metoksymetylowy (−CH
2OCH
3, MOM) – grupa typu acetalu, usuwana w środowisku silnie kwasowym[8], - etery sililowe, np. trimetylosililowy (−SiMe
3, TMS) lub tert-butylodimetylosililowy (−SiMe
2tBu, TBDMS, TBS) – usuwane selektywnie za pomocą anionu fluorkowego[3][9].
Estry
Estrowe grupy ochronne wprowadzane są w reakcji alkoholi z odpowiednimi chlorkami lub bezwodnikami kwasowymi. Usuwane są przez hydrolizę w środowisku zasadowym. Ich trwałość rośnie wraz z zawadą przestrzenną: Pv > Bz > Ac[10]. Przykłady:
- grupa acetylowa (−C(O)CH
3, Ac) – poza warunkami zasadowymi można ją usunąć przez transestryfikację w warunkach kwasowych w obecności wody lub alkoholu[11], - grupa benzoilowa (−C(O)Ph, Bz)[12],
- grupa piwaloilowa (−C(O)C(CH
3)
3, Piv, Pv) – ze względu na stosunkowo dużą trwałość w warunkach zasadowych do jej usuwania stosuje się również inne warunki, np. redukcję za pomocą (iBu)
2AlH[13].
Grupy stosowane do protekcji amin
Wiele grup ochronnych alkoholi może być również wykorzystane do zabezpieczania grup aminowych, np. grupa acetylowa (Ac), benzylowa (Bn), benzoilowa (Bz)[3]. Pozostałe grupy ochronne amin:
- grupa benzyloksykarbonylowa (Cbz, Z) – może być usuwana na trzy sposoby: (i) redukcja roztwarzanym metalem alkalicznym (np. Na/NH
3), (ii) środowisko kwasowe lub (iii) hydrogenacja[14], - grupa tert-butyloksykarbonylowa (BOC) – często wykorzystywana w syntezie peptydów na fazie stałej (ang. solid phase peptide synthesis, SPPS); usuwana za pomocą mocnego kwasu[15],
- grupa 9-fluorenylometoksykarbonylowa (Fmoc) – wykorzystywana w syntezie peptydów na fazie stałej; usuwana w warunkach bezwodnych za pomocą amin, np. piperydyny, morfoliny, amoniaku lub DBU, zwykle w rozpuszczalnikach polarnych, takich jak acetonitryl lub DMF[16],
- grupy arylosulfonowe, np. fenylosulfonowa (PhSO
2) lub tosylowa (Ts) – bardzo trwałe w większości warunków; usuwane przez redukcję roztwarzanym metalem alkalicznym[17], - grupa ftaloilowa (Phth) – do ochrony pierwszorzędowych amin poprzez utworzenie ftalimidu w reakcji z bezwodnikiem ftalowym; usuwana np. w warunkach zasadowych lub hydrazyną[18].
Grupy stosowane do protekcji kwasów karboksylowych
Zabezpieczanie grupy karboksylowej najczęściej odbywa się poprzez przekształcenie jej w grupę estrową, tworząc następujące ugrupowania[3]:
- estry metylowe,
- estry benzylowe,
- estry tert-butylowe,
- estry sililowe.
Protekcja pozostałych grup funkcyjnych
Grupy karbonylowe są najczęściej blokowane z utworzeniem acetali i ketali[3]. 1,2-Diole mogą zostać zabezpieczone poprzez utworzenie cyklicznego ketalu. Usunięcie takiego rodzaju protekcji zachodzi pod wpływem kwasu[19].
Grupa fosforanowa może być zabezpieczona za pomocą grupy 2-cyjanoetylowej, co jest często wykorzystywane w syntezie oligonukleotydów[7][20].
Ortogonalność grup ochronnych
Grupy protekcyjne, których usunięcie zachodzi w odmiennych warunkach (niezależnie od siebie), nazywa się ortogonalnymi grupami ochronnymi[21].
Przypisy
- ↑ a b Philip J. Kocienski 2005 ↓, Death, Taxes, and Protecting Groups, s. 2.
- ↑ Michael Schelhaas, Herbert Waldmann, Protecting Group Strategies in Organic Synthesis, „Angewandte Chemie International Edition in English”, 35 (18), 1996, s. 2056–2083, DOI: 10.1002/anie.199620561 (ang.).
- ↑ a b c d e f g Jacek Skarżewski, Wprowadzenie do syntezy organicznej, Warszawa–Łódź: Wydawictwo Naukowe PWN, 1999, s. 114–128, ISBN 83-01-12948-4, OCLC 749296768.
- ↑ Philip J. Kocienski 2005 ↓, Methyl Ethers, s. 230–237.
- ↑ Philip J. Kocienski 2005 ↓, Benzyl Ethers (Bn), s. 241–257.
- ↑ Philip J. Kocienski 2005 ↓, Trityl (Tr) Ethers, s. 269–275.
- ↑ a b Sudhir Agrawal (red.), Protocols for Oligonucleotides and Analogs, New Jersey: Humana Press, 1993 (seria Methods in Molecular Biology, t. 20), DOI: 10.1385/0896032817, ISBN 978-0-89603-281-1, OCLC 55638684 (ang.).
- ↑ Philip J. Kocienski 2005 ↓, Methoxymethyl (MOM) Ethers, s. 286–295.
- ↑ Philip J. Kocienski 2005 ↓, Protecting Groups Cleaved by Fluoride Ions, s. 7.
- ↑ Philip J. Kocienski 2005 ↓, Acetate Esters (Ac), s. 323–325.
- ↑ Philip J. Kocienski 2005 ↓, Acetate Esters (Ac), s. 325–330.
- ↑ Philip J. Kocienski 2005 ↓, Benzoate Esters (Bz), s. 330–331.
- ↑ Philip J. Kocienski 2005 ↓, Pivalate Esters (Pv), s. 331–333.
- ↑ Philip J. Kocienski 2005 ↓, Benzyloxycarbonyl (Z or Cbz), s. 512–524.
- ↑ Philip J. Kocienski 2005 ↓, tert-Butoxycarbonyl (Boc), s. 505–512.
- ↑ Philip J. Kocienski 2005 ↓, 9-Fluorenylmethoxycarbonyl (Fmoc), s. 528–534.
- ↑ Philip J. Kocienski 2005 ↓, Arylsulfonyl Derivatives, s. 543–554.
- ↑ Philip J. Kocienski 2005 ↓, Phthaloyl (Phth) and Tetrachlorophthaloyl (TCP), s. 488–495.
- ↑ Philip J. Kocienski 2005 ↓, Acetals, s. 120–160.
- ↑ Álvaro Somoza, Protecting groups for RNA synthesis: an increasing need for selective preparative methods, „Chemical Society Reviews”, 37 (12), 2008, s. 2668, DOI: 10.1039/b809851d (ang.).
- ↑ Protective Groups, Organic Chemistry Portal [dostęp 2022-05-09] (ang.).
Bibliografia
- Philip J. Kocienski, Protecting Groups, wyd. 3, Stuttgart–New York: Georg Thieme Verlag, 2005, ISBN 978-3-13-184173-5.
Media użyte na tej stronie
Autor: Siekiza, Licencja: CC BY-SA 4.0
Struktury wybranych grup ochronnych stosowanych przy protekcji alkoholi.
Autor: Siekiza, Licencja: CC BY-SA 4.0
Przykład zabezpieczonego monomeru stosowanego w syntezie oligonukleotydów
Autor: Siekiza, Licencja: CC BY-SA 4.0
Struktury wybranych grup ochronnych stosowanych do protekcji amin.