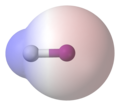
Jodowodór
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | HI | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 127,91 g/mol | ||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwny gaz | ||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||
Jodowodór, HI – nieorganiczny związek chemiczny, połączenie jodu i wodoru. Jest to bezbarwny, nietrwały gaz, silnie dymiący w wilgotnym powietrzu. Jego roztwór wodny to kwas jodowodorowy o silnych właściwościach kwasowych.
Właściwości chemiczne
W stanie gazowym ma silne właściwości korodujące. M.in. bezpośrednio reaguje z wieloma metalami z utworzeniem odpowiednich jodków. Ma właściwości redukujące, w kontakcie z powietrzem utlenia się do wolnego jodu, w wodzie pod wpływem światła również ulega dość szybkiej przemianie w wolny jod. Z kolei z większością rozpuszczalników organicznych reaguje zrywając wiązania C-H z utworzeniem odpowiedniego jodku. Już w temperaturze 180 °C rozkłada się na pierwiastki.
Kwas jodowodorowy
Jodowodór dobrze rozpuszcza się w wodzie (>2,3 kg/dm³ w 10 °C) tworząc kwas jodowodorowy[3]. Jest on jednym z najmocniejszych „kwasów mineralnych” (pKa ∼ −10), silniejszym od kwasu solnego (pKa ∼ −7) i bromowodorowego (pKa ∼ −9)[1]. Nie dorównuje jednak mocą superkwasom i jest nietrwały, w związku z czym należy przechowywać go w ciemności i stopniowo utlenia się na powietrzu. Czysty kwas jest bezbarwny, jednak w praktyce ma on zwykle zabarwienie brązowe od jodu powstającego pod wpływem światła lub tlenu. Jest dostępny handlowo, np. jako roztwór 10% lub 57% (azeotrop); można go też otrzymywać w laboratorium, np. przez rozpuszczenie gazowego HI w wodzie lub redukcję wodnego roztworu jodu siarkowodorem lub elektrochemicznie[3]. Jest kwasem beztlenowym.
Jest stosowany w medycynie, analizie chemicznej i do odkażania.
Kwas jodowodorowy może służyć do otrzymania związków kompleksowych, np.:
Etap pierwszy:
- 2 HI + Cd → CdI2 + H2
Etap drugi:
- 2 KI + CdI2 → K2[CdI4]
Otrzymywanie
Przemysłowa produkcja jodowodoru polega na reakcji jodu z hydrazyną[1]:
- 2 I2 + N2H4 → 4 HI + N2
Jodowodór o wysokiej czystości otrzymuje się przez bezpośrednią syntezę z pierwiastków:
- H2 + I2 → 2 HI
Jodowodór można też uzyskać poprzez hydrolizę trijodku fosforu, który zazwyczaj otrzymuje się in situ wobec katalizatora platynowego:
Inna metoda to działanie siarkowodorem na zawiesinę jodu w wodzie:
- H2S + I2 → 2 HI + S↓
lub w reakcji jodku potasu ze stężonym kwasem fosforowym.
Jodowodór otrzymany w postaci kwasu jodowodorowego można wyizolować przez ogrzanie roztworu.
Przypisy
- ↑ a b c d N. N. Greenwood, A. Earnshaw: Chemistry of the elements. Wyd. 2. Oxford: Butterworth-Heinemann, 1997, s. 809–819. ISBN 978-0-7506-3365-9.
- ↑ a b c CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 4-67, ISBN 978-0-8493-0488-0 (ang.).
- ↑ a b c Pradyot Patnaik: Handbook of Inorganic Chemicals. The McGraw-Hill Companies, 2003, s. 370. ISBN 0-07-049439-8.
- ↑ a b Jodowodór. The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2013-04-07]. (ang.).[niewiarygodne źródło?]
- ↑ a b Jodowodór (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-28].
Media użyte na tej stronie
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
A van der Waals' surface coloured according to charge, superimposed on a ball-and-stick model of the hydrogen iodide molecule, HI. Red represents partially negatively charged regions, blue represents partially positively charged regions, and white represents neutral (uncharged) regions. Created in Accelrys DS Visualizer 1.5, edited with Photoshop Elements 3.0.
The hazard symbol for corrosive substances according to directive 67/548/EWG by the European Chemicals Bureau, now known as the Consumer Products Safety and Quality (CPS&Q) Unit.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Imagen of the length of the molecule of Hydrogen iodide.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gas bottles