Lasówka niebieska
| Setophaga cerulea[1] | |||
| (A. Wilson, 1810) | |||
 Samiec | |||
 Samica | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | lasówka niebieska | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[2] | |||
 | |||
| Zasięg występowania | |||
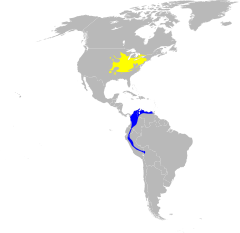 w sezonie lęgowym zimowiska | |||
Lasówka niebieska[3] (Setophaga cerulea) – gatunek małego ptaka z rodziny lasówek (Parulidae). Wędrowny: tereny lęgowe znajdują się we wschodniej Ameryce Północnej, zarówno Kanadzie, jak i USA (80% z nich leży w Appalachach), natomiast zimowiska – głównie na wschodnich stokach Andów. Są to niewielkie ptaki o zaokrąglonej sylwetce, osiągające 12 cm długości i zwykle poniżej 10 g masy. Żywią się bezkręgowcami. Lęgną się w lasach i podczas przelotów oraz żerowania także preferują tereny leśne. Jest to gatunek bliski zagrożenia wyginięciem o spadkowym trendzie liczebności.
Taksonomia
Po raz pierwszy gatunek opisał Alexander Wilson w 1810. Holotyp pochodził z Pensylwanii. Autor nadał nowemu gatunkowi nazwę Sylvia cerulea. Wspomniał, że prawdopodobnie gatunku nie odnotował żaden ówczesny przyrodnik oprócz niego oraz Pealego[4].
Obecnie (2021) Międzynarodowy Komitet Ornitologiczny umieszcza lasówkę niebieską w rodzaju Setophaga i uznaje za gatunek monotypowy[5], podobnie jak i inne autorytety[6][7][8][9]. Wcześniej klasyfikowana była w obrębie Dendroica, lecz według wyników badań filogenetycznych (Lovette i inni, 2010) zarówno lasówka niebieska, jak i niektóre pozostałe lasówki należało zgrupować w Setophaga[10][9].
Filogeneza
Dawniej sądzono, że lasówka niebieska nie ma blisko spokrewnionych gatunków w obrębie rodzaju[11], lub uznawano lasówkę rudogardłą (S. fusca) za najbliżej spokrewniony z niebieską gatunek, co uzasadniano głównie podobieństwami w głosie. Badania filogenetyczne wykazały, że lasówka niebieska to gatunek siostrzany wobec pary gatunków siostrzanych: lasówki obrożnej (S. americana) i oliwkowogrzbietej (S. pitiayumi). Obydwa wcześniej umieszczano w rodzaju Parula[10][9].
Pozycję lasówki niebieskiej w obrębie rodzaju przedstawia poniższy kladogram, stanowiący uproszczoną wersję drzewa filogenetycznego według Barkera i innych (2015):
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Według Barkera i innych (2015) klad S. tigrina+(S. cerulea+(S. americana+S. pitiayumi))[a] wyodrębnił się około 3,61 mln lat temu. Linia rozwojowa lasówki rdzawolicej (S. tigrina) oddzieliła się blisko 3,36 mln lat temu. Następnie koło 3,09 mln lat temu rozeszły się drogi lasówki niebieskiej oraz kladu lasówki obrożnej z oliwkowogrzbietą[12].
Odnotowywano zarówno wewnątrz-, jak i międzyrodzajowe mieszańce lasówek niebieskich:
- z pstroszką (Mniotilta varia)[9][13];
- z lasówką obrożną (S. americana) – początkowo prawdopodobne mieszańce były obserwowane w kilku miejscach. Później (2019) potwierdzono przypuszczenia zarówno klasycznymi metodami, jak i z użyciem badań genetycznych[14];
- z lasówką granatową (S. caerulescens) – udokumentowano karmienie piskląt przez mieszaną parę: samca lasówki niebieskiej i samicy lasówki granatowej. Samo miejsce obserwacji również było nietypowe, ponieważ lasówki granatowe nie gniazdują w Indianie, a jedynie pojawiają się tam na przelotach[15];
- z lasówką niebieskoskrzydłą (Vermivora cyanoptera) – początkowo podejrzewano również lasówkę złotoskrzydłą (V. chrysoptera). Przynależność gatunkową rodziców mieszańca potwierdzono dzięki połączeniu klasycznych sposobów oraz nowoczesnych metod genetycznych. Był to potomek samicy lasówki niebieskiej oraz samca lasówki niebieskoskrzydłej[16].
Morfologia
Długość ciała wynosi około 12 cm, masa ciała – 8,4–10,3 g (n=27)[11]; u osobników na zimowiskach w Kolumbii – 8,86 ± 0,54 g (n=54)[17]. Lasówki niebieskie mają dość zaokrągloną sylwetkę i krótki ogon. Występuje dymorfizm płciowy w upierzeniu. Wymiary szczegółowe podane w milimetrach (przedział lub średnia, ± błąd standardowy) przedstawiono w poniższej tabeli.
| Płeć | n | Dł. skrzydła | n | Dł. ogona | n | Dł. dzioba | n | Dł. skoku | Źródło |
|---|---|---|---|---|---|---|---|---|---|
| samce | 30 | 62–70 | 10 | 41–48 | 10 | 9,4–10,5 | 10 | 15,5–17,0 | [11] |
| samice | 26 | 58–64 | 40–43 | 9,0–10,5 | 15,5–17,0 | ||||
| samce | 23 | 64,5 ± 1,26 | 23 | 42,4 ± 0,25 | 23 | 9,62 ± 0,13 | 23 | 15,7 ± 0,14 | [18] |
| samice | 22 | 62,3 ± 0,29 | 22 | 40,9 ± 0,27 | 22 | 9,56 ± 0,10 | 22 | 14,8 ± 0,20 | |
| samce | 71 | 65–71 | — | [19] | |||||
U samca w szacie godowej głowa i wierzch ciała mają intensywnie ciemnoniebieski (lazurowy) kolor i pokryte są czarnymi paskami. Pokrywy skrzydłowe większe i średnie mają szerokie białe końcówki, które tworzą dwa białe paski skrzydłowe. Wszystkie sterówki oprócz środkowej pary mają białe końcówki. Spód ciała biały; przez pierś przechodzi wąska niebieska przepaska; boki tułowia pokrywają czarne i niebieskie paski. Tęczówka ciemna, dziób czarniawy, nogi od szarych po czarniawe. Poza sezonem lęgowym samce cechują się podobnym upierzeniem, jedynie nieznacznie bardziej matowym, z białą brwią o zmiennej szerokości; przepaska na piersi często jest przerwana[20].
Samica w szacie godowej ma turkusową głowę i wierzch ciała z jasną żółtawą brwią i białymi paskami skrzydłowymi. Na ogonie mają nieco mniej bieli niż samce. Spód ciała białawy z żółtym nalotem na gardle i piersi. Boki tułowia pokrywają niewyraźne szarawe pasy. Poza sezonem lęgowym upierzenie samic jest bardziej zielone z wierzchu i żółtawe od spodu[20]. W szacie spoczynkowej mogą one przypominać lasówki sosnowe (S. pinus), a odróżnić je można dzięki wyraźnej brwi i krótszemu ogonowi[11].
U osobników młodocianych głowa i wierzch ciała są brązowoszare. Pokrywają je delikatne ciemniejsze pasy. Brew jasnożółta. Gardło i spód ciała białawe; po bokach gardła, na piersi i po bokach tułowia widoczny żółtawy nalot. Na gardle i piersi znajdują się wąskie, słabo zaznaczone rdzawobrązowe półksiężyce. Dziób i nogi różowawe. Młode samce (1. zima) podobne są do samic, lecz wyróżnia je bardziej niebieskie upierzenie wierzchu ciała (szczególnie kupra), wyraźniejsze białe paskowanie płaszcza i jaśniejszy spód ciała. Młode samice (1. zima) wierzch ciała mają wyraźnie zieleńszy od dorosłych samic, spód natomiast – bardziej żółty. Młode osobniki podczas 1. lata podobne są do dorosłych danej płci; lotki, pokrywy I-rzędowe, skrzydełko i sterówki mają jednak zielonawe – nie niebieskie – krawędzie[20].
Zasięg występowania
Obszar gniazdowania
Lasówki niebieskie gniazdują w południowo-wschodniej Kanadzie (południowo-wschodnie Ontario, skrajnie południowa część Quebecu) i dalej na południe we wschodniej części USA, aż po północną Alabamę i Wirginię. Ich tereny lęgowe nie obejmują nizin u wybrzeży Oceanu Atlantyckiego oraz Zatoki Meksykańskiej[20]. Około 80% obszaru gniazdowania lasówek niebieskich położone jest w Appalachach[21]. Szczególnie liczne są na wyżynie Cumberland i przyległych terenach[22]. Najważniejsze miejsca gniazdowania znajdują się we wschodnim Tennessee, wschodnim Kentucky, w południowej i zachodniej Wirginii Zachodniej, w południowo-wschodnim Ohio oraz południowo-zachodniej Pensylwanii[23]. Rozmieszczenie lasówek niebieskich jest nierównomierne; są rzadsze między innymi w Illinois, północnej Indianie, zachodnim Tennessee i zachodnim Kentucky[24]. Ogółem występują w 35 stanach, w niektórych tylko na przelotach[22].
Wschodnia granica obszaru gniazdowania lasówek niebieskich przecina Wielkie Równiny, dokładniej wschodnią Dakotę Północną i Południową, Nebraskę, Kansas i Oklahomę. Północna granica biegnie przez Massachusetts, Quebec, Ontario, Michigan, Wisconsin i środkową Minnesotę. Południowa natomiast ciągnie się przez Arkansas, Missisipi, Tennessee, północną Alabamę, Georgię oraz Karolinę Południową[23].
W Kanadzie większość lasówek niebieskich gniazduje w Ontario. W południowo-zachodnim Quebecu populacja lęgowa jest nieliczna, a same stwierdzenia dość rzadkie. W Ontario populacja lęgowa skupia się głównie na dwóch obszarach: w lasach między dolną częścią jeziora Huron i jeziorem Ontario oraz w mieszczącym się bardziej na północy pasie lasów od południowo-wschodniego wybrzeża Georgian Bay na wschód po Frontenac Axis nieopodal wschodniego brzegu jeziora Ontario[24].
Okres przelotów i zimowiska
Lasówki niebieskie zimują w zachodniej Ameryce Południowej, na średnich wysokościach w Andach[23]: od północnej Kolumbii i Wenezueli przez Ekwador na południe po Peru i zachodnią Boliwię[20][25][26]. Obszary gniazdowania i zimowiska dzieli przeciętnie około 4000 km – wędrówki odbywane przez lasówki niebieskie są jednymi z najdłuższych wśród wróblowych[27].
Większość lasówek niebieskich po odbyciu lęgów wylatuje na południe i dociera do wybrzeża Zatoki Meksykańskiej, następnie kieruje się na Jukatan i przez Amerykę Centralną dociera na zimowiska. Nieliczne udają się do Ameryki Południowej przez Florydę i zachodnie Wyspy Karaibskie. Podczas powrotu na tereny lęgowe lasówki niebieskie podążają wzdłuż podobnych tras, lecz bardziej na zachód; większość przekracza Zatokę Meksykańską i podąża wzdłuż doliny Missisipi oraz Appalachów. Jesienią pojawiają się na północy typowego obszaru gniazdowania, wybrzeżu Oceanu Atlantyckiego i na Bermudach. Zalatują też – głównie jesienią – na zachód Ameryki Południowej oraz do kanadyjskich prowincji Nowy Brunszwik i Nowa Szkocja, natomiast zimą – na Trynidad, do wschodniej Wenezueli oraz południowo-wschodniej Brazylii[20].
Pożywienie

Skład pożywienia
Lasówki niebieskie żywią się niemal wyłącznie owadami i innymi bezkręgowcami. Na zimowiskach w Wenezueli obserwowano je podczas sprawdzania kwiatów. Prócz tego zimą zjadają bogate między innymi w tłuszcze wyrostki na nasionach tropikalnych, elajosomy[20]. Do 2016 opublikowano cztery badania, w ramach których sprawdzano skład pożywienia lasówek niebieskich: jedno (2014) uwzględniało skład pokarmu piskląt, a trzy – dorosłych (1924, 1993 i 2006). W 2016 ukazała się praca opisująca zarówno skład diety piskląt, jak i zachowanie dorosłych podczas karmienia[28].
Pierwsza wzmianka o składzie pożywienia dotyczy 4 osobników odłowionych w 1912 w Alabamie, w których żołądkach wśród sztuk zdobyczy 42% stanowiły błonkoskrzydłe (Hymenoptera), 35% – motyle (Lepidoptera), a 23% – chrząszcze, w tym ryjkowce[18]. W kolejnej publikacji przedstawiono wyniki badania zawartości żołądków wróblowych kilku gatunków, w tym 14 lasówek niebieskich, podczas inwazji brudnicy nieparki (Lymantria dispar) w 1986 w Wirginii Zachodniej. Część obszaru badań przeznaczono dla grupy kontrolnej, na pozostałym terenie użyto diflubenzuronu. Łącznie w maju i czerwcu 52% biomasy w żołądkach stanowiły pluskwiaki równoskrzydłe (Homoptera), 37% – motyle (głównie gąsienice), 7% – chrząszcze, a pozostałą część – niewielkie ilości błonkoskrzydłych, muchówek (Diptera), pluskwiaków (Hemiptera), pajęczaków (Araneae) i innych stawonogów. Po zastosowaniu pestycydu lasówki niebieskie jadły więcej, inaczej niż lasówki paskogłowe (Helmitheros vermivorum) i pirangi szkarłatne (Piranga olivacea), u których masa spożywanego pokarmu znacząco zmalała. Lasówki niebieskie w grupie kontrolnej spożywały blisko dwa razy więcej motyli niż pluskwiaków równoskrzydłych, natomiast te na opryskanym obszarze zjadały blisko trzy razy więcej pluskwiaków równoskrzydłych niż motyli. Po miesiącu znów w diecie dominowały motyle; stosunek masy spożytych motyli do pluskwiaków na obszarach kontrolnych był bliski 4,0, a na opryskanym obszarze – 1,41[29][18].
W diecie piskląt przeważają gąsienice[30][28]; szczegółowe badania prowadzono w Indianie między 2011 a 2013[28] oraz w Ohio w 2009 i 2010[30]. Na tle innych stawonogów gąsienice wyróżnia wysoka zawartość tłuszczu oraz bardzo dobra strawność. Około 4% masy ciała gąsienic stanowi oskórek, który w blisko 60% składa się z chityny. Ze względu na problemy z trawieniem tego związku stawonogi pokryte szkieletem zewnętrznym są mniej pożywne[29]. W 2013 w Indianie gąsienice stanowiły 53% sztuk zdobyczy podczas całego sezonu lęgowego, a ich udział w diecie piskląt spadał – na początku sezonu, gdy najwięcej gniazd zawierało właśnie pisklęta, wynosił blisko 83%. Nieco ponad ⅓ gąsienic udało się zidentyfikować co do rodziny; przeważały garbatkowate (Notodontidae), sówkowate (Noctuidae) i miernikowcowate (Geometridae). Lasówki niebieskie wybierały dla potomstwa większą zdobycz, niż przeciętnie występowała w okolicy (około 15 mm vs 6 mm), a skupiały się szczególnie na gąsienicach motyli – ich odsetek w diecie młodych był 3,8 raza większy niż odsetek występowania gąsienic motyli wśród larw okolicznych stawonogów (pod względem liczbowym). Oprócz gąsienic pisklęta otrzymywały między innymi muchówki – zwłaszcza koziułkowate (Tipulidae) – dorosłe motyle i prostoskrzydłe (Orthoptera)[28]. Newell i inni (2014) podczas badań w Ohio rozpoznawali jedynie większą zdobycz. 69% sztuk zdobyczy stanowiły zielonawe larwy, prawdopodobnie gąsienice, 12% – ciemne larwy, 19% – uskrzydlone owady. Nie porównywali składu pokarmu piskląt do rozpowszechnienia poszczególnych typów zdobyczy w otoczeniu[30].
Sposoby pozyskiwania pokarmu
Żerują głównie wysoko w koronach drzew. Niekiedy pokarmu szukają na mniejszych wysokościach, szczególnie w trakcie wędrówek. Swoje zdobycze przeważnie zbierają z powierzchni liści czy innych części drzew. Łapią też owady w krótkich „wypadach”, podobnie jak na przykład muchołówki. Niekiedy zbierają bezkręgowce z danego miejsca podczas unoszenia się w locie tuż obok (ang. hover-gleaning)[20].
Na zimowiskach zarówno pojedyncze osobniki, jak i pary dołączają do wielogatunkowych stad. Sugerowano, że na obszarach zimowania może to być najbardziej typowe zachowanie dla żerujących lasówek niebieskich. Spośród tych obserwowanych w Wenezueli ponad 90% przebywało w wielogatunkowym stadzie[20]. Podczas liczeń transektowych w Ameryce Środkowej w latach 2004–2009 lasówki niebieskie w trakcie wiosennych migracji obserwowane były wyłącznie w wielogatunkowych stadach[27]. Na zimowiskach zachowują swoje preferencje i żerują wysoko w koronach drzew; pod tym względem należą do jednej grupy ekologicznej między innymi z lasówkami rudogardłymi i pirangami pąsowymi (Piranga rubra)[31].
Ekologia i zachowanie
Preferencje środowiskowe
Okres lęgowy
Lasówki niebieskie gniazdują w świetlistych lasach liściastych (rzadziej mieszanych) z dojrzałym drzewostanem i stosunkowo rzadkim podszytem. Często położone są one na terenach podmokłych lub wzdłuż rzek i strumieni. Lasówki chętniej wybierają siedliska zasobne w potencjalne miejsca gniazdowania. W północno-wschodniej części obszaru gniazdowania stosunkowo często lasówki niebieskie gniazdują w lasach wtórnych zajmujących dawne tereny rolnicze[20]. W miejscach gniazdowania muszą znajdować się wysokie i duże drzewa; w Appalachach są to drzewa o średnicy (pierśnicy) co najmniej 40 cm[21]. W Michigan na nizinach, gdzie gniazdują lasówki niebieskie, w drzewostanie dominują: klon srebrzysty (Acer saccharinum), jesiony (Fraxinus) i platan zachodni (Platanus occidentalis), a na wyżynach – buki (Fagus), klony (Acer), dęby (Quercus), orzech czarny (Juglans nigra) i robinia akacjowa (Robinia pseudoacacia)[32].
Minimalna powierzchnia lasu, w którym lasówki niebieskie gniazdują, to 700 ha w stanach położonych na Wschodnim Wybrzeżu i 1600 ha w Tennessee[33]. W Ohio Breeding Bird Atlas zawarto informację, jakoby lasówki niebieskie miały w Ohio preferować połacie lasu o rozmiarze co najmniej 20–30 ha i unikały tych mniejszych niż 8–10 ha[34]; nie wiadomo jednak, jak te dane zostały uzyskane. We wschodnim Ontario ptaki te zajmowały połacie lasu o powierzchni 10 ha, jednak to mało prawdopodobne, by takie izolowane tereny leśne umożliwiały utrzymanie się odpowiednio licznej populacji w Kanadzie ogółem. Brakuje badań dotyczących wymagań środowiskowych lasówek niebieskich w Kanadzie[24]. Badania prowadzone w Indianie wykazały, że na 3 z 5 wyznaczonych obszarów terytoria wykazywały tendencję do przestrzennego „grupowania” się. Oznacza to, że do pewnego stopnia lasówki niebieskie mogą preferować siedliska o powierzchni wystarczająco dużej, by pomieścić kilka terytoriów[35], jednak ta hipoteza jest niewystarczająco potwierdzona[24]. W Appalachach chętniej zajmują terytoria z nagłymi wyniesieniami lub obniżeniami terenu w postaci stromych skarp czy pagórków[21].
Przeloty i zimowiska
Podczas przelotów lasówki niebieskie zatrzymują się na różnych terenach zadrzewionych, choć również chętniej wybierają te z wyższym drzewostanem. Na zimowiskach przebywają głównie w podgórskich lasach porastających wschodnie stoki Andów. Odnotowywane były tam na wysokości od 500 do 2000 m n.p.m. (w Ekwadorze głównie między 500 a 1400 m n.p.m.), czasem na okolicznych nizinach. Prócz podgórskich lasów zimują również w lasach wtórnych oraz na plantacjach kawy w podanym przedziale wysokościowym. Ze względu na utratę pierwotnego drzewostanu współcześnie plantacje kawy mogą być ważnymi miejscami zimowania lasówek niebieskich, jednak temat wymaga więcej badań[20].
Tryb życia i zachowanie

Dzięki swojemu niebieskiemu upierzeniu i zwyczajom lasówki niebieskie są dość trudne w obserwacji i badaniach. Wśród innych przedstawicieli Setophaga wyróżnia je zarówno żerowanie, jak i gniazdowanie dość wysoko w koronach drzew – tam na tle nieba i wśród listowia niełatwo je dostrzec. W porównaniu do innych lasówek odbywają też wędrówki wcześniej i w dalej położone obszary. Zainteresowanie lasówkami niebieskimi wzrosło około roku 2000 i na początku 1. dekady XXI wieku, zarówno pod kątem naukowym, jak i publikacji w masowo dostępnych źródłach. Relacje międzyosobnicze lasówek niebieskich są słabo poznane, badania wymaga też biologia tego gatunku i możliwości ochrony[36]. W okresie lęgowym mogą być agresywne wobec siebie nawzajem – obserwowano samce atakujące się w koronach drzew, na wysokości około 20 m lub wyżej, następnie zwierające się w walce już na ziemi. Podobne potyczki mają miejsce również między samicami oraz parami. Obserwowano też, jak lasówki niebieskie były atakowane przez lasówki złotoskrzydłe i niebieskoskrzydłe[25].
Terytoria
Wielkość terytoriów lasówek niebieskich w Ontario określono w dwóch badaniach. W pierwszym zajmowały one średnio 1,04 ha, ogółem zaś od 0,38 do 2,4 ha (n=18)[37]. Wyniki drugiego badania (nowszego o blisko dekadę) wykazały przeciętnie mniejszą powierzchnię terytoriów – od 0,12 do 2,35 ha, średnio 0,7 ha (n=14)[38]. W Indianie dla 51 terytoriów odnotowano jeszcze niższą średnią: 0,22 ha, ogólny zakres: 0,0108–1,02 ha[39]. W regionie Ozark w północno-zachodnim Arkansas terytoria były stosunkowo duże – 0,33–2,03 ha, średnio 1,14 ha (n=16)[40]. Większość samców, które wracają z zimowisk w te same okolice, zajmuje terytorium oddalone najwyżej o 0,5 km od tego z poprzedniego roku[41]. Lasówki niebieskie najchętniej zakładają terytoria oddalone od gwałtownych przejść między siedliskami różnych typów, na przykład ściany lasu, za którą znajduje się już środowisko innego rodzaju[21]. Ich obecność może sprzyjać drapieżnictwu i pasożytnictwu lęgowemu[24]. W Wirginii Zachodniej na badanym obszarze były tym pospolitsze, im dalej znajdowała się ściana lasu (aż do 340 m)[42]. Terytoria tych lasówek często przylegają jednak do przerw w piętrze koron drzew[43][35][21]. Te mogą zapewniać większą ilość owadów ze względu na cechujące dany wycinek lasu lepsze nasłonecznienie, zawartość składników odżywczych w glebie i jej wyższą wilgotność[44]. Związek wielkości terytoriów z zasobnością lokalnej roślinności w pokarm po raz pierwszy zbadano w Indianie. Analizując ekskrementy pozostawione przez owady ustalono, że na tamtejszych dębach – białym (Quercus alba) i Q. montana – oraz orzesznikach (Carya) dostępne są niemal dwukrotnie większe ilości owadów niż na klonie cukrowym (Acer saccharum). Nie stwierdzono korelacji między wielkością terytoriów a zagęszczeniem orzeszników lub drzew w ogóle. Na mniejszych terytoriach większe było zagęszczenie dębów, natomiast na większych terytoriach – klonów cukrowych[39].
Wędrówki
Lasówki niebieskie podejmują długodystansowe wędrówki. Opuszczają tereny lęgowe od końca lipca, miejscami już na początku września. Na zimowiska docierają co najmniej na początku sierpnia. Zaczynają opuszczać je na początku marca. Na obszary gniazdowania docierają od połowy kwietnia do początku maja, zależnie od szerokości geograficznej[20]. Trasę i przebieg wędrówek badano z użyciem nadajników; w latach 2016–2018 wyposażono w nie 30 samców lasówek niebieskich w Indianie, przy czym odzyskano 4 nadajniki. Przebyty dystans podczas wiosennych i jesiennych wędrówek nie różnił się znacząco, a przebyte trasy (n=8) wynosiły od 4274 do 6807 km. Lasówki zatrzymywały się na dłużej niż dwa dni 1–4 razy. Wędrówki trwały od 37 dni (5372 km, jeden ponad dwudniowy postój; wędrówka wiosenna) do 71 dni (4456 km, cztery ponad dwudniowe postoje; wędrówka jesienna). Choć przebyty dystans był podobny, to wiosenne wędrówki były krótsze: 37–41 dni (n=3) vs 44–71 dni jesienią (n=4)[45].
Lęgi
Sezon lęgowy
Ogółem sezon lęgowy trwa od końca kwietnia do lipca. Okres składania jaj przypada na maj i czerwiec[20]. W Michigan, na północy obszaru gniazdowania, nieliczne osobniki przybywają pod koniec kwietnia. Zazwyczaj lasówki niebieskie na tereny lęgowe przylatują najwcześniej w pierwszym lub drugim tygodniu maja; najwięcej ich powraca do Michigan w połowie maja[32]. We wschodnim Tennessee, bliżej południowej granicy obszaru gniazdowania, lasówki niebieskie pojawiają się od połowy kwietnia. Najwcześniej w tym stanie stwierdzono je 11 kwietnia, a zwykle przybywają jeszcze przed 20 kwietnia[46]. Cały sezon lęgowy w Ontario trwa od 60 do 75 dni[47]; w jednym z badań ze wschodniego Tennessee dwukrotnie było to 66 dni[48], w północno-zachodnim Arkansas 64 dni (od budowy pierwszego gniazda do opierzenia ostatniego pisklęcia)[40].
Samce zwykle przybywają na tereny lęgowe przed samicami, często co najmniej tydzień przed nimi. Niedługo po pojawieniu się samic zaczynają formować się pary[36]. Przez pierwsze kilka dni przyszli partnerzy żerują blisko siebie[37].
Gniazdo i jego lokalizacja
Gniazdo lasówki niebieskiej ma kształt podobny do płytkiej czarki. Budulec stanowią płatki kory, źdźbła traw i łodygi roślin zielnych, wyściółkę natomiast – sierść i delikatne korzonki[20]. Czasami po zewnętrznej stronie gniazda są też umieszczane porosty. Zwykle buduje je tylko samica. Samiec może pomagać w początkowych etapach budowy, szczególnie przy zbieraniu motylich oprzędów i pajęczych nici. Do gniazda mogą zostać wplecione kotki dębów i orzeszników, co w literaturze odnotowano dopiero w 2012[49]. Po wybraniu miejsca na gniazdo interakcje między samcem i samicą stają się rzadsze. Samica sama jest w stanie wybudować gniazdo w 5–6 dni[37][49][46] (według innego źródła typowy czas to 4–7 dni[47]), ogółem trwa to od 2 do 11 dni (n=62)[49]. Większość gniazd jest osłonięta od góry liśćmi drzewa[46]. Osłonę może też stanowić porastające je pnącze, jak winobluszcz pięciolistkowy (Parthenocissus quinquefolia)[50][51].
Wymiary średnie (± błąd standardowy):
- 5 gniazd z Ontario: średnica zewnętrzna – 6,5 + 1,2 cm, średnica wewnętrzna – 5,0 + 0,6 cm, wysokość – 3,3 + 0,7 cm, głębokość – 3,0 + 0,9 cm[37];
- 4 gniazd ze wschodniego Tennessee: średnica zewnętrzna – 6,5 cm (ogółem 6,3–6,8 cm), średnica wewnętrzna – 4,2 cm (ogółem 4,0–4,5 cm), wysokość – 4,2 cm (ogółem 3,8–4,5 mm), głębokość – 2,6 cm (ogółem 2,2–3,0 cm). Sucha masa: 3,24 g (2,50-3,74 g)[46];
- 6 gniazd ze wschodniego Tennessee: dane zostały podane niespójnie, wiadomo między innymi, że średnica wewnętrzna wynosiła 4,57–5,15 cm, a średnia głębokość – 3,03 cm[48];
- 10 gniazd ze wschodniego Tennessee: średnica zewnętrzna – 6,93 ± 0,12 cm, średnica wewnętrzna – 4,92 ± 0,08 cm, wysokość – 4,58 ± 0,21 cm, średnica wewnętrzna – 3,03 ± 0,16 cm[49].
Gniazda z ostatniej serii były przeciętnie większe od tych, których wymiary podano w dotychczasowych badaniach. Według autorów może mieć to związek ze stabilnością gniazd – były umieszczone średnio o 10 m wyżej nad podłożem niż te z poprzedniego badania prowadzonego w Tennessee. Przez to narażone były na silniejsze podmuchy wiatru, a mocniejsza konstrukcja zapewniała im większą stabilność[49]. Gniazdo lasówek niebieskich umieszczone jest od 4[20] do 36 m[46] nad podłożem na gałęzi drzewa. Średnie wysokości gniazda nad podłożem, wysokość samych drzew oraz inne informacje o gniazdowaniu w poszczególnych rejonach kraju przedstawia poniższa tabela.
| Miejsce prowadzenia badań | Najczęściej wybierane drzewo | Śr. wysokość gniazda nad podłożem (m) | n | Śr. średnica (pierśnica) drzewa (cm) | Śr. wysokość drzewa (m) | Śr. odległość gniazda od pnia (m) | Źródło | |
|---|---|---|---|---|---|---|---|---|
| południowo-wschodnie Ontario | klon cukrowy (67%) | 11,8 ± 0,6 | 27 | 40,2 ± 5,1 | 17,7 ± 0,67 | 3,6 ± 0,3 | Oliarnyk i Robertson, 1996[37] | |
| 1 | południowo-zachodnie Michigan | dąb barwierski (50%) | 18,7 ± 2,1 | 6 | 45,5 ± 6,6 | 21,8 ± 2,0 | 3,5 ± 0,6 | Rogers, 2006[50] |
| 2 | robinia akacjowa (57%) | 19,0 ± 1,4 | 12 | 38,1 ± 2,9 | 26,0 ± 1,1 | 3,8 ± 0,5 | ||
| 3 | b.d. | 20,1 ± 0,2 | 18 | 41,9 ± 1,0 | 26,6 ± 4,0 | 4,1 ± 0,2 | ||
| Appalachy, 6 miejsc: po dwa w Wirginii Zachodniej i Tennessee, pozostałe w Ohio i Kentucky | klon cukrowy (% – b.d.) | 19,8 ± 0,3 | 479 | 44,0 ± 0,7 | 29,1 ± 0,5 | 3,8 ± 0,1 | Boves, 2011[52] | |
| 1 | Cumberland Mountains, południowo-wschodnie Appalachy, Tennessee | klon cukrowy (39%) | 18,3 ± 0,8 | 38 | 41,4 ± 1,4 | 25,0 ± 1,7 | 3,5 ± 0,4 | Beachy, 2008[48] |
| 2 | klon cukrowy i czeremcha amerykańska (po 21%) | 15,9 ± 0,8 | 52 | 39,6 ± 2,5 | 23,6 ± 0,9 | 3,3 ± 0,2 (tu: n=51) | Nicholson, 2004[46] | |
| południowo-wschodnie Ohio | dąb biały (60%) | 19,4 ± 0,5 | 113 | 44,2 ± 1,5 | b.d. | 4,4 ± 0,2 | Bakermans, 2008[31] | |
| południowo-środkowa Indiana, w ramach Hardwood Ecosystem Experiment | dąb biały (40%) | 18,9 ± 0,5 | 93 | 44,2 ± 1,6 | 25,8 ± 0,5 | 4,8 ± 0,3 | Newes, 2017[44] | |
| Big Oaks NWR, południowo-wschodnia Indiana | orzech czarny i dąb biały (łącznie 53%) | 18,4 ± 5,1 | 43 | 50,4 ± 25,8 | b.d. | 4,8 ± 2,4 | Roth i Islam, 2008[51] | |
| dwa lasy stanowe (Morgan-Monroe SF i Yellowwood SF), południowo-wschodnia Indiana | dąb biały (46%) | 18,4 ± 1,1 | 22 | 41,9 ± 3,1 | 25,7 ± 1,2 | 4,4 ± 0,9 (tu: n=17) | Wagner i Islam, 2014[53] | |
W Appalachach lasówki niebieskie najchętniej do założenia gniazda wybierają dęby białe, magnolie drzewiaste (Magnolia acuminata) i klony cukrowe. Starają się unikać dębów z podrodzaju Erythrobalanus (ang. red oaks – „czerwone dęby”) oraz klonów czerwonych (A. rubrum)[33].
Jaja
W zniesieniu znajduje się od 2 do 5 jaj[20], przeważnie 3 lub 4[25]. Średnia wielkość zniesienia badana w różnych miejscach wynosiła: Ontario – 3,8 (n=6)[37], wschodnie Tennessee: 3,7 (n=13)[46]. Badanie jaj lasówek niebieskich jest utrudnione ze względu na znaczne wysokości, na jakich mogą znajdować się gniazda[31].
Wymiary średnie dla 50 jaj: 17 na 13 mm; dla 77 jaj z 20 zniesień (zbiory Western Foundation for Vertebrate Zoology): długość – 16,68 mm (z zakresu 15,28–18,93 mm), szerokość – 12,78 mm (z zakresu 11,89–13,59 mm). Skorupa jest brudnobiała, ma barwę nieco szarawą, kremową, czasami zielonawą. Pokrywają ją różnej wielkości plamy w czerwonawych odcieniach brązu, między którymi znajdują się mniejsze płowobrązowe kropki[18].
Wysiadywanie
Wysiadywanie u lasówek niebieskich zazwyczaj trwa najczęściej 11–12 dni[20][37][49], ogółem od 9 do 15 dni[49]. Wysiaduje tylko samica[49][37]. Podczas łagodnej pogody (bez opadów deszczu, najwyżej lekkie podmuchy wiatru) spędza na gnieździe blisko 30 minut, następnie opuszcza je i przez 5–10 minut szuka pożywienia, by znów wrócić do wysiadywania. Taki rytm utrzymuje podczas całego okresu inkubacji[49]. Wyniki innego badania wskazują, że na początkowych etapach inkubacji przeciętnie mniej czasu spędza na gnieździe – niecałe 40 min/h 1. i 2. dnia oraz niecałe 50 min/h 3. i 4. dnia vs powyżej 50 min/h od 5. dnia wzwyż[46]. Sporadycznie otrzymuje pokarm od samca[49][37]. W badaniu prowadzonym we wschodnim Tennessee obserwowano samca karmiącego samicę przynajmniej raz przy 7% spośród monitorowanych gniazd (n=183). To znacząco mniejszy odsetek niż w badaniu Barg i innych (2006)[49], dotyczącym populacji we wschodnim Ontario, podczas którego zaobserwowano karmienie wysiadujących partnerek przez 35% samców[47]. Być może przyczyną tej różnicy jest cieplejszy klimat, dzięki któremu samice – inaczej niż w Ontario – mogą pozwolić sobie na częstsze opuszczanie gniazda, a do tego większa jest dostępność zdobyczy. Oprócz wysiadywania samica lasówki niebieskiej zajmuje się również utrzymaniem gniazda w dobrym stanie – usuwa stawonogi na nie wchodzące, uzupełnia materiał gniazdowy i poprawiania konstrukcję gniazda[49]. Wysiadująca samica porozumiewa się z samcem głosami kontaktowymi w odpowiedzi na jego pieśń[37].
Opieka nad młodymi i ich rozwój
Pisklęta zwykle spędzają w gnieździe 10–11 dni[20][37][47], ogółem od 8 do 13 dni[49]. Opiekę nad młodymi bezpośrednio w gnieździe (obejmującą między innymi ich ogrzewanie) sprawuje wówczas wyłącznie samica. Po raz pierwszy o udziale w tym samca u lasówek niebieskich doniesiono w 2012. Obserwacja dotyczyła jednak ledwie 15-minutowego pobytu samca w gnieździe, a poczyniona została podczas szeroko zakrojonych badań z lat 2008–2010[49]. Samica siedzi na gnieździe szczególnie twardo do trzech pierwszych dni po wykluciu się piskląt. Z czasem coraz częściej siedzi już przy nich lub na krawędzi gniazda[37].
Dostarczaniem pisklętom pożywienia oraz usuwaniem ich odchodów z gniazda zajmują się zarówno samiec, jak i samica[49][37][47][46]; pozbywają się ich przy blisko co 10. wizycie[46]. Udział samca i samicy w karmieniu potomstwa jest zbliżony lub równy[37][47][46][52]. W jednym z badań wśród monitorowanych gniazd były 3 – stanowiące 2% ze wszystkich, w których udało się odchować co najmniej jedno młode – w których samiec w ogóle nie uczestniczył w karmieniu młodych[49]. Barg i inni (2006) odnotowali przeciętnie częstsze dostarczanie pokarmu do gniazd, w których udało się odchować co najmniej jedno młode. Mimo że brakuje bezpośredniego dowodu na związek częstszego karmienia z odniesieniem sukcesu, to różnica na poziomie 1 wizyty/30 minut może długofalowo okazać się znacząca[47].
W dniu opuszczenia gniazda przez młode zarówno rodzice, jak i przyszłe podloty są wyraźnie aktywniejsze oraz głośniejsze. Niektóre dorosłe osobniki dopiero wówczas zaczynają alarmować w związku z obecnością w pobliżu obserwatora[37]. Przemieszczanie się i preferencje środowiskowe podlotów przez pierwsze kilkanaście dni zostały dokładniej poznane dzięki badaniom z użyciem telemetrii. Według ich wyników młode lasówki niebieskie stają się niezależne od rodziców w wieku około 25–28 dni[54] (co mniej więcej pokrywa się z obserwacjami z lat 90. XX wieku z Ontario, gdzie podloty były karmione blisko przez kolejne 2 tygodnie po opuszczeniu gniazda)[37]. 20 podlotów zaopatrzono w nadajniki o masie odpowiadającej 4–5% masy ciała ptaka; kolejny miesiąc przeżyło 9 młodych. Przez pierwsze dwa dni podloty oddalały się od gniazda nie dalej niż na 45 ± 11 m. Od 3. do 6. dnia po opuszczeniu gniazda młode z jednego lęgu zaczynały się rozdzielać i podążać za jednym z rodziców (tak samo często za ojcem, jak za matką). Między 7. a 12. dniem większość (88%) podlotów opuściła już terytorium swojego ojca, oddalając się od gniazda o średnio 305 m. Między 13. a 20. dniem często podloty odwiedzały miejsca, w których badacze w okresie lęgowym nie stwierdzili żadnego śpiewającego (to jest: terytorialnego) samca. Pod koniec okresu monitoringu (około miesiąca, najwyżej 36 dni) podloty przebywały od 1 do 5,3 km od gniazda (średnio 2,4 ± 0,7 km)[54].
Sukces lęgowy, przeżywalność i długość życia
Buehler i inni (2008) prowadzili wieloletnie badania terenowe nad lęgami lasówek niebieskich w kilku stanach. Ustalano dzienne prawdopodobieństwo przeżycia lęgów (DSR), sukces lęgowy oraz produkcję młodych (liczbę podlotów przypadającą na gniazdo z sukcesem), a na podstawie tych danych szacowano plenność. Informacji tych użyto między innymi do utworzenia modelu spadkowego trendu liczebności populacji. Uproszczone wyniki dotyczące sukcesu lęgowego przedstawia poniższa tabela.
| Miejsca prowadzenia badań | Okres | Liczba gniazd | Odsetek gniazd z sukcesem | Liczba młodych na gniazdo z sukcesem | ||||
|---|---|---|---|---|---|---|---|---|
| Łącznie | Utrata lęgu | Zakres | n | Średnia za cały okres | ||||
| wschodnie Ontario (Queen’s University Biological Station) | 1995–2002 | 179 | 95 | 47% | 2,0–3,8 | 8 | 2,8 | |
| Michigan (dwa obszary) | 2003–2006 | 38 | 24 | 37% | 2,0–3,0 | 4 | 2,4 | |
| Równina aluwialna rzeki Missisipi (1 – zachodnie Tennessee, 2 – południowo-wschodnie Arkansas, 3 – zachodnie Tennessee, 4 – łączne dane dla trzech obszarów) | 1 | 1993–2001 | 26 | 16 | 38% | — | 1 | 2,1 |
| 2 | 1992–1999 | 21 | 16 | 24% | 1,8 | |||
| 3 | 1993–2004 | 35 | 25 | 28,5% | 1,9 | |||
| 4 | 1992–2004 | 82 | 57 | 30,5% | 1,8–2,1 | 3 | 1,9 | |
| Cumberland Mountains, południowo-wschodnie Appalachy, Tennessee | 1996–1998, 2005–2006 | 88 | 45 | 49% | 2,4–2,8 | 5 | 2,5 | |
| Big Oaks NWR, południowo-wschodnia Indiana | 2002–2005 | 93 | 71 | 24% | 1,5–2,8 | 4 | 2,3 | |
Poniżej przedstawiono wyniki z pomniejszych, nieskoordynowanych badań.
| Miejsce prowadzenia badań | Okres | Liczba gniazd | Losy lęgów | Odsetek gniazd z sukcesem | Średnia liczba młodych na gniazdo z sukcesem | Źródło | ||
|---|---|---|---|---|---|---|---|---|
| Nieznane | Niepowodzenie | Sukces | ||||||
| południowo-wschodnie Ontario | 1994–1995 | 27 | — | 9 | 18 | 67% | 3,2 | Oliarnyk i Robertson, 1996[37] |
| Pensylwania | 2014–2015 | 40 | — | 16 | maks. 24 | maks. 60% | nie dotyczy | Raybuck i inni, 2017[56] |
| uwaga: autorzy śledzili losy lęgu do osiągnięcia przez młode wieku blisko 7–9 dni, typowa metodologia w innych badaniach zakłada obserwacje do momentu opuszczenia przez nie gniazda (zwykle w wieku 10–11 dni) | ||||||||
| Appalachy, 6 miejsc: po dwa w Wirginii Zachodniej i Tennessee, pozostałe w Ohio i Kentucky | 2008–2010 | 479 | — | 210 | 259 | 68% | na południu obszaru badań: 3,29 na północy obszaru badań: 2,48 | Boves, 2011[52] |
| Cumberland Mountains, południowo-wschodnie Appalachy, Tennessee | 1996–1999 | 52 | 3 | 31 | 19 | min. 37% | min. 2,6 | Nicholson, 2004[46] |
| 2005–2006 | 38 | — | 15 | 23 | 60,5% | Beachy, 2008[48] | ||
| Big Oaks NWR, południowo-wschodnia Indiana | 2002–2003 | 40 (dodatkowe 3 znaleziono puste) | — | 33 | 7 | 17,5% | nie dotyczy | Roth i Islam, 2008[51] |
Przyczyny niepowodzeń
Podczas badań prowadzonych przez Buehlera (2011) niepowodzeniem zakończyło się 210 prób gniazdowania. Nie udało się ustalić przyczyny niepowodzenia w 174 przypadkach; gniazda były wówczas opuszczane nagle i prawdopodobnie za większość strat odpowiadały drapieżniki. Dokładna przyczyna była znana dla 36 lęgów. Większość z nich splądrowały drapieżniki; 15 – nieznanego gatunku, 5 – modrosójki błękitne (Cyanocitta cristata), 1 – wąż, 1 – pręgowiec amerykański (Tamies striatus). Drugą najczęstszą przyczyną utraty lęgu było wygłodzenie lub choroba (6 przypadków). Za resztę strat odpowiadały: 4 – niekorzystne warunki pogodowe, 3 – pasożytnictwo lęgowe ze strony starzyków brunatnogłowych (Molothrus ater), 1 – dzieciobójstwo[55].
Podczas badań w Cumberland Mountains w latach 1996–1999 niepowodzeniem zakończyły się lęgi w 31 z 52 gniazd. Z tego 4 lęgi zostały utracone na etapie budowy gniazda, 5 – składania jaj, 11 – wysiadywania, a 10 – pobytu młodych w gnieździe[46]. Inne badania w tym samym obszarze w latach 2005–2006 obejmowały 38 gniazd, z czego nie powiodły się lęgi w 15; w 13 podczas inkubacji i 2 podczas pobytu piskląt w gnieździe. Dokładnych przyczyn nie ustalono, jednak za większy sukces lęgowy pierwszego roku mogła odpowiadać niewielka liczba wiewiórek szarych (Sciurus carolinensis) – potencjalnych drapieżników – w okolicy. W kolejnym roku, mniej korzystnym dla gniazdujących lasówek, było ich znacznie więcej, prawdopodobnie ze względu na trwający urodzaj orzechów[48].
Raybuck i inni (2020) dzięki zastosowaniu telemetrii mogli dosyć dokładnie ustalić przyczynę śmierci badanych podlotów. Łupem drapieżników padło 9 z nich – 7 młodych do 4. dnia po opuszczeniu gniazda uśmierciły pręgowce amerykańskie, jednego 16–17 dni po opuszczeniu gniazda – krogulec zmienny (Accipiter striatus), ostatniego po 7–8 dniach – nieznany drapieżnik. Jeden podlot dzień po opuszczeniu gniazda został znaleziony 60 m dalej w rzece, przyczyny śmierci nie ustalono[54].
Starzyki brunatnogłowe (Molothrus ater) są stosunkowo częstymi pasożytami lęgowymi lasówek niebieskich[20].
Przeżywalność
Buehler i inni (2008) pomimo wieloletniego zbierania danych z różnych części zasięgu lasówki niebieskiej dysponowali wiarygodnymi danymi jedynie dla populacji z Ontario[55]. Zostały opublikowane cztery lata wcześniej. Przeciętna roczna przeżywalność samców wynosiła około 54% w latach, w których panowały typowe warunki pogodowe. Jednego roku szacunkowo wyniosła blisko 40%, a za zwiększoną śmiertelność odpowiadały nadzwyczaj silne burze śnieżne[57]. Według Buehlera i innych (2008) nie ma podstaw do przypuszczania, jakoby roczna przeżywalność samic w tym samym wieku miałaby być znacząco inna. Na potrzeby opracowywanych modeli założono, że przeżywalność młodych osobników odpowiada około 50% przeżywalności dorosłych, jednak nie było wówczas dokładnych danych o przeżywalności młodych lasówek niebieskich[55]. Takie opublikowali dla małej próby Raybuck i inni (2020)[54]. Drugi artykuł poświęcony przeżywalności dorosłych opublikował Rogers (2013). Dane zebrane w latach 2008–2011 w południowo-zachodnim Michigan wskazują na roczną przeżywalność dorosłych samców na poziomie około 59%. Według oceny autora jest to wynik podobny do uzyskanego przez poprzedni zespół naukowców[41].
Z 20 podlotów wyposażonych w nadajniki udało się ustalić losy 19 (jednego po 16 dniach po opuszczeniu gniazda nie dało się zlokalizować). Wynik nieznacznie różnił się w zależności od przyjętej przez autorów metodologii; śmiertelność w pierwszych kilkunastu dniach po opuszczeniu gniazda wynosiła około 48–49%. Przez pierwsze dwie dekady XXI wieku większość badań nad lasówkami niebieskimi dotyczyła czynników ograniczających liczebność populacji oraz rozwijania wytycznych prowadzenia gospodarki leśnej (z uwzględnieniem gatunkowego składu drzewostanu) tak, by umożliwić gęstsze rozmieszczenie terytoriów oraz zwiększyć sukces lęgowy. W 2020 wiedza na temat sezonu lęgowego tych lasówek była nadal wybrakowana. Szczególnie słabo poznany był okres życia młodych po opierzeniu się; publikacja z tamtego roku jako pierwsza była poświęcona przeżywalności podlotów[54].
Status, zagrożenia i ochrona
IUCN uznaje lasówkę niebieską za gatunek bliski zagrożenia (NT, Near Threatened) od 2019 (stan w 2021). Wcześniej, w latach 2004–2018 była uznawana za gatunek narażony na wyginięcie (VU, Vulnerable), a przed 2004 za gatunek najmniejszej troski. BirdLife International uznaje trend liczebności populacji za spadkowy[26].
Dawniej lasówki niebieskie były jednymi z najpospolitszych przedstawicieli rodziny w dolinach rzek Ohio i Mississippi. Pod koniec pierwszej dekady XX wieku dostrzeżono już spadek liczebności populacji tego gatunku. Zainteresowania jego losem – nie tylko wśród naukowców – szczególnie wzrosło po 2000, kiedy Hamel opublikował przegląd dotychczasowej wiedzy o lasówce niebieskiej i ocenę stanu jej populacji. W 2001 ustanowiono grupę roboczą, Cerulean Warbler Technical Group, której głównym celem było wypracowanie standardów gospodarowania środowiskiem na terenach lęgowych i zimowych[36].
Pod koniec 2021 roku najnowszym amerykańskim programem ochrony gatunku był ten przyjęty w czerwcu 2007 (Cerulean Warbler Conservation Action Plan)[58], natomiast kanadyjskim – opublikowany w październiku 2020 (Recovery Strategy for the Cerulean Warbler (Setophaga cerulea) in Canada)[24].
Trend i liczebność populacji
Według szacunków Partners in Flight w 2020 populacja lasówki niebieskiej składała się z około 530 tysięcy dorosłych osobników[26]. W 2010 liczebność kanadyjskiej populacji szacowano najwyżej na niecałe 1,1 tysiąca osobników (od 433 do 453 par). W 2018 nowe dane Ontario Natural Heritage Information Centre mówiły o około 327 terytorialnych samcach w samym Ontario; ponieważ część z nich może nie mieć partnerki, to wartość ta nie musi odpowiadać 327 parom lęgowym[24].
W 2006 według szacunków FWS liczebność populacji lasówki niebieskiej mogłaby wynosić około 400 tysięcy osobników. Szacunki oparto o dane z Breeding Bird Survey, które wskazywały na przeciętny roczny spadek liczebności na poziomie 3% począwszy od 1966, aż do liczebności rzędu 560 tysięcy w 1995[23]. W 2008 oceniono, że w żadnym z dotychczas badanych miejsc tamtejsza liczebność populacji lasówek niebieskich nie mogła się utrzymać na zbliżonym poziomie. Byłoby to możliwe jedynie w Ontario oraz w Cumberlands Mountains (Tennessee), o ile szacunkowa roczna przeżywalność byłaby nieco zaniżona (o co najmniej 5%), a plenność utrzymywałaby się na dobrym poziomie[55].
Zagrożenia
Tryb życia i biologia rozrodu u lasówek niebieskich czynią potencjalne skutki różnych zagrożeń dotkliwszymi dla populacji, niż by to miało miejsce u innych wróblowych. Plenność jest u nich dość niska jak na ptaka wróblowego. Wielkość lęgu, na który zwykle składają się 3 lub 4 jaja, jest stosunkowo mała, ponadto wyprowadzają jeden lęg w roku (kolejne to wyłącznie lęgi zastępcze). Inne wróblowe mogą wyprowadzać dwa, a przy wyjątkowo sprzyjających warunkach nawet trzy lęgi w roku. Ponadto przeciętna długość trasy wędrówek lasówek niebieskich jest jedną z najwyższych wśród wróblowych, co wystawia je na dodatkowe zagrożenia. Niską plenność musiałaby rekompensować wysoka przeżywalność[55].
Zarówno dla populacji lasówek niebieskich z Kanady, jak i tej z USA głównym zagrożeniem jest przekształcanie lub utrata środowiska ich życia, również na zimowiskach[24][58]. Oprócz samej utraty dogodnych siedlisk problem stanowi ich fragmentacja oraz zniszczenie pierwotnej struktury lasu[58]. W Kanadzie większość populacji zamieszkuje Ontario, gdzie pod koniec 2. dekady XXI wieku żyła nieco ponad ⅓ mieszkańców kraju. Realizacja inwestycji mieszkaniowych, handlowych lub przemysłowych jest drugą najpowszechniejszą przyczyną wylesiania w tamtych rejonach; pierwszą jest rozwój rolnictwa. Współcześnie nie jest to już zagrożenie na dużą skalę, ponieważ wiele połaci lasu, w których żyją lasówki niebieskie, znajduje się na obszarach chronionych[24].
Na zimowiskach również postępuje utrata środowiska życia lasówek niebieskich, w tym na rzecz pastwisk lub upraw bananowców[24]. Tradycyjne plantacje kawy są dogodnymi miejscami zimowania nie tylko dla lasówek niebieskich, jak i innych wędrownych wróblowych. Plantacje z różnych krajów łączy kilka cech: ponad 40% ich powierzchni jest zacienione (przy czym zacienione miejsca zajmuje roślinność o różnej wysokości), występują tam drzewa co najmniej 10 gatunków i obecne są epifity[31]. W 2010 oceniono, że w przyszłości kolejnym zagrożeniem może stać się wówczas już postępujące przekształcanie tradycyjnych plantacji na te prowadzone bardziej intensywnie i przy dużej ekspozycji na promienie słoneczne. Dotychczasowe działania ochronne na zimowiskach były albo rzadkie, albo w ogóle ich nie prowadzono[24].
Uwagi
- ↑ Na kladogramie zaznaczony barwą jasnoniebieską
Przypisy
- ↑ Setophaga cerulea, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ Setophaga cerulea, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Systematyka i nazwy polskie za: P. Mielczarek & M. Kuziemko: Rodzina: Parulidae Wetmore, Friedmann, Lincoln, Miller, AH, Peters, JL, van Rossem, Van Tyne & Zimmer, JT, 1947 (1831) - lasówki - New World wood warblers (wersja: 2021-07-13). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2021-12-10].
- ↑ A. Wilson, American ornithology, or, The natural history of the birds of the United States, t. 2, 1810, s. 141–142.
- ↑ F. Gill, D. Donsker, P. Rasmussen (red.): New World warblers, mitrospingid tanagers. IOC World Bird List (v11.2), 15 lipca 2021. [dostęp 2021-11-24].
- ↑ Chesser i inni, Check-list of North American Birds (online), American Ornithological Society, 2021 [dostęp 2021-11-25].
- ↑ Clements i inni, The eBird/Clements Checklist of Birds of the World: v2019, 2019 [dostęp 2021-11-25].
- ↑ PARULIDAE - New World Wood Warblers1 (18:108), [w:] Edward C. Dickinson & Les Christidis (red.), Howard and Moore Complete Checklist of the birds of the World, wyd. 4, t. 2, 2014 [dostęp 2021-11-27].
- ↑ a b c d Handbook of the Birds of the World and BirdLife International, Handbook of the Birds of the World and BirdLife International digital checklist of the birds of the world. Version 5 | Taxonomic notes, grudzień 2020 [dostęp 2021-11-27].
- ↑ a b I.J. Lovette, J.L. Pérez-Emán, J.P. Sullivan, R.C. Banks, I. Fiorentino, S. Córdoba-Córdoba, M. Echeverry-Galvis, F.K. Barker, K.J. Burns, J. Klicka, S.M. Lanyon & E. Bermingham. A comprehensive multilocus phylogeny for the wood-warblers and a revised classification of the Parulidae (Aves). „Molecular Phylogenetics and Evolution”. 57 (2), s. 753–770, 2010. DOI: 10.1016/j.ympev.2010.07.018.
- ↑ a b c d J. Curson, D. Quinn, D. Beadle, New World warblers, Londyn: A&C Black/Christopher Helm, 1994, s. 152–153, ISBN 978-0-7136-3932-2.
- ↑ F. Keith Barker i inni, New insights into New World biogeography: An integrated view from the phylogeny of blackbirds, cardinals, sparrows, tanagers, warblers, and allies, „The Auk”, 132 (2), 2015, s. 333–348, DOI: 10.1642/AUK-14-110.1, ISSN 0004-8038 (ang.).
- ↑ Kenneth C. Parkes, Still Another Parulid Intergeneric Hybrid (Mniotilta × Dendroica) and Its Taxonomic and Evolutionary Implications, „The Auk”, 95 (4), American Ornithological Society, 1978, s. 682–690, DOI: 10.1093/auk/95.4.682.
- ↑ Ryan J. Trimbath, Andrew W. Jones, Courtney L. Brennan, Evidence for hybridization between Northern Parula (Setophaga americana) and Cerulean Warbler (S. cerulea), „The Wilson Journal of Ornithology”, 131 (3), 2019, s. 615, DOI: 10.1676/18-152, ISSN 1559-4491.
- ↑ Delancey i inni, First confirmed hybrid pairing between a Cerulean Warbler (Setophaga cerulea) and a Black-throated Blue Warbler (Setophaga caerulescens), „The Wilson Journal of Ornithology”, 131 (1), 2019, s. 161–165, DOI: 10.1676/18-21.
- ↑ David P L Toews i inni, Genomic identification of intergeneric hybrids in New World wood-warblers (Aves: Parulidae), „Biological Journal of the Linnean Society”, 131 (1), 2020, s. 183–191, DOI: 10.1093/biolinnean/blaa085, ISSN 0024-4066.
- ↑ Colorado Z. i inni, Patterns of change in body condition in wintering Neotropical-Nearctic migratory birds in shaded plantations in the Andes, „Agroforestry Systems”, 91 (6), 2016, s. 1129–1137, DOI: 10.1007/s10457-016-9989-9.
- ↑ a b c d P.B. Hamel, Cerulean Warbler (Dendroica cerulea), „The Birds of North America (red.: A. Poole & F. Gill)”, 511, Filadelfia 2000.
- ↑ Elisabeth F. Purves i inni, Does white tail patch size indicate quality in male Cerulean Warblers (Setophaga cerulea)?, „The Wilson Journal of Ornithology”, 128 (2), 2016, s. 343–354, DOI: 10.1676/wils-128-02-343-354.1.
- ↑ a b c d e f g h i j k l m n o p q r s Josep del Hoyo, Andrew Elliott, David A. Christie, Handbook of the Birds of the World, t. 15. Weavers to New World Warblers, Barcelona: Lynx Edicions, 2010, s. 732, 759–760, ISBN 978-84-96553-68-2.
- ↑ a b c d e Wood i inni, Management guidelines for enhancing Cerulean Warbler breeding habitat in Appalachian hardwood forests, The Plains, Virginia: American Bird Conservancy, 2013.
- ↑ a b Setophaga cerulea Cerulean Warbler, NatureServe Explorer [dostęp 2021-12-06].
- ↑ a b c d Species of Concern: Cerulean Warbler Dendroica cerulea, U.S. Fish & Wildlife Service, grudzień 2006 [dostęp 2021-11-24].
- ↑ a b c d e f g h i j k Cerulean Warbler (Setophaga cerulea): recovery strategy 2021, [w:] Species at Risk Act (SARA) [online], Government of Canada, 28 października 2020 [dostęp 2021-12-08].
- ↑ a b c Paul B. Hamel, Cerulean Warbler Status Assessment, U.S. Fish and Wildlife Service, kwiecień 2000 [dostęp 2021-11-27].
- ↑ a b c Cerulean Warbler Setophaga cerulea. BirdLife International. [dostęp 2022-01-05].
- ↑ a b Melinda J. Welton i inni, Cerulean Warbler (Setophaga cerulea) spring migration stopover in northern Middle America, „Ornitologia Neotropical”, 23(suppl.), 2012, s. 289–305.
- ↑ a b c d Sasha A. Auer i inni, The diet of Cerulean Warbler (Setophaga cerulea) nestlings and adult nest provisioning behaviors in southern Indiana, „The Wilson Journal of Ornithology”, 128 (3), 2016, s. 573–583, DOI: 10.1676/1559-4491-128.3.573, ISSN 1559-4491 [dostęp 2021-12-02] (ang.).
- ↑ a b Bradley E. Sample, Robert J. Cooper, Robert C. Whitmore, Dietary Shifts among Songbirds from a Diflubenzuron-Treated Forest, „The Condor”, 95 (3), 1993, s. 616–624, DOI: 10.2307/1369605, JSTOR: 1369605.
- ↑ a b c Newell i inni, Foraging behavior of Cerulean Warblers during the breeding and non-breeding seasons: evidence for the breeding currency hypothesis, „Journal of Field Ornithology”, 85 (3), 2014, s. 310–320.
- ↑ a b c d Marja Bakermans, Demography and habitat use of cerulean warblers on breeding and wintering grounds, Ohio State University, 2008.
- ↑ a b Hyde i inni, Special animal abstract for Dendroica cerulea (cerulean warbler), [w:] Michigan Natural Features Inventory [online], Michigan State University Board of Trustees, kwiecień 2009.
- ↑ a b Boves T.J. i inni, Spatial variation in breeding habitat selection by Cerulean Warblers (Setophaga cerulea) throughout the Appalachian Mountains, „The Auk”, 130, 2013, s. 46–59, DOI: 10.1525/auk.2012.12104.
- ↑ Peterjohn, Bruce G. & Daniel L. Rice, The Ohio Breeding Bird Atlas, Columbus: Ohio Department of Natural Resources, 1991, s. 294–295.
- ↑ a b Roth, K.L. & K. Islam, Do Cerulean Warblers (Dendroica cerulea) exhibit clustered territoriality?, „American Midland Naturalist”, 157, 2007, s. 345–355.
- ↑ a b c Buehler, D.A., P.B. Hamel & T. Boves, Cerulean Warbler (Setophaga cerulea), version 1.0, [w:] Birds of the World (red.: A.F. Poole). Cornell Lab of Ornithology, Ithaca, NY, USA [online], 2020 [dostęp 2021-11-27] [zarchiwizowane z adresu 2020-05-08].
- ↑ a b c d e f g h i j k l m n o p q Catherine J. Oliarnyk & Raleigh J. Robertson, Breeding Behavior and Reproductive Success of Cerulean Warblers in Southeastern Ontario, „The Wilson Bulletin”, 108 (4), Wilson Ornithological Society, 1996, s. 673–684.
- ↑ Barg i inni, Describing breeding territories of migratory passerines: suggestions for sampling, choice of estimator, and delineation of core areas, „Journal of Animal Ecology”, 74, 2005, s. 139–149, DOI: 10.1111/j.1365-2656.2004.00906.x.
- ↑ a b Jennifer R. Wagner, Cerulean Warbler Territory Size is Influenced by Prey-Rich Tree Abundance, „Proceedings of the Indiana Academy of Science”, 124 (2), 2015, s. 70–79.
- ↑ a b Jacob L. Wessels & Than J. Boves, Cerulean Warblers in the Ozark region: habitat selection, breeding biology, survival, and space use, „Journal of Field Ornithology”, 92 (1), 2021, DOI: 10.1111/jofo.12358.
- ↑ a b Christopher M. Rogers, Minimum Annual Survival Estimates of Male Cerulean Warblers (Setophaga cerulea) In Southwestern Michigan, „The Wilson Journal of Ornithology”, 125 (2), 2013, s. 370–375, DOI: 10.1676/12-130.1.
- ↑ Wood, P.B., S.B. Bosworth & R. Dettmers, Cerulean Warbler abundance and occurrence relative to large-scale edge and habitat characteristics, „The Condor”, 108 (1), 2006, s. 154–165, DOI: 10.1093/condor/108.1.154.
- ↑ Perkins, K.A. & P.B. Wood, Selection of forest canopy gaps by male Cerulean Warblers in West Virginia, „Wilson Journal of Ornithology”, 126, 2014, s. 288–297.
- ↑ a b Nemes, C.E. & K. Islam, Breeding season microhabitat use by Cerulean Warbler (Setophaga cerulea) in an experimentally-managed forest, „Forest Ecology and Management”, 387, 2017, s. 52–63, DOI: 10.1016/j.foreco.2016.11.008.
- ↑ Delancey i inni, Geolocators reveal migration routes, stopover sites, and nonbreeding dispersion in a population of Cerulean Warblers, „Animal Migration”, 7 (1), 2020, s. 19–26, DOI: 10.1515/ami-2020-0003.
- ↑ a b c d e f g h i j k l m Charles Patrick Nicholson, Ecology of the Cerulean Warbler in the Cumberland Mountains of East Tennessee, University of Tennessee, 2004.
- ↑ a b c d e f g Barg i inni, Within-pair interactions and parental behavior of Cerulean Warblers breeding in eastern Ontario, „Wilson Journal of Ornithology”, 118, 2006, s. 316–325, JSTOR: 20455884.
- ↑ a b c d e Tiffany Ahren Beachy, Cerulean Warbler (Dendroica cerulea) Breeding Ecology and Habitat Selection, Initial Response to Forest Management, and Association with Anthropogenic Disturbances in the Cumberland Mountains of Tennessee, University of Tennessee, 2008.
- ↑ a b c d e f g h i j k l m n o p Boves, Than & Buehler, David, Breeding Biology, Behavior, and Ecology of Setophaga cerulea in the Cumberland Mountains, Tennessee, „Southeastern Naturalist”, 11, 2012, s. 319–330, DOI: 10.1656/058.011.0213.
- ↑ a b C.M. Rogers, Nesting success and breeding biology of Cerulean Warblers in Michigan, „Wilson Journal of Ornithology”, 118, 2006, s. 145–151, DOI: 10.1676/05-032.1.
- ↑ a b c Kirk L. Roth & Kamal Islam, Habitat Selection and Reproductive Success of Cerulean Warblers in Indiana, „The Wilson Journal of Ornithology”, 120 (1), 2008, s. 105–110, JSTOR: 20456110.
- ↑ a b c Than James Boves, Multiple responses by Cerulean Warblers to experimental forest disturbance in the Appalachian Mountains, University of Tennessee, 2011, s. 109, 114, 175–178.
- ↑ Wagner i inni, Nest-Site Selection and Breeding Ecology of the Cerulean Warbler in Southern Indiana, „Northeastern Naturalist”, 4 (21), 2014, s. 515–528, DOI: 10.1656/045.021.0403.
- ↑ a b c d e Douglas W. Raybuck, Jeffery L. Larkin, Scott H. Stoleson & Than J. Boves, Radio-tracking reveals insight into survival and dynamic habitat selection of fledgling Cerulean Warblers, „The Condor”, 122 (1), 2020, DOI: 10.1093/condor/duz063.
- ↑ a b c d e f Buehler i inni, Cerulean Warbler reproduction, survival, and models of population decline, „Journal of Wildlife Management”, 72, 2008, s. 646–653.
- ↑ Douglas W. Raybuck i inni, Mixed effects of geolocators on reproduction and survival of Cerulean Warblers, a canopy-dwelling, long-distance migrant, „The Condor”, 119 (2), 2017, s. 289–297, DOI: 10.1650/CONDOR-16-180.1.
- ↑ Jason Jones i inni, Minimum Estimates of Survival and Population Growth for Cerulean Warblers (Dendroica Cerulea) Breeding in Ontario, Canada, „The Auk”, 121 (1), 2004, s. 15–22, DOI: 10.1093/auk/121.1.15.
- ↑ a b c Cerulean Warbler Conservation Action Plan, USFWS Division of Migratory Bird Management Focal Species Program, 30 czerwca 2007 [dostęp 2021-12-08].
Linki zewnętrzne
- Zdjęcia, nagrania głosów i krótkie filmy. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Bettina Arrigoni, Licencja: CC BY 2.0
Cerulean Warbler (male) | Anahuac NWR-Jackson Prairie Woodlot | TX|2018-04-24|14-51-29.jpg
Jaja lasówki niebieskiej (Setophaga cerulea), ilustracja pochodzi z The warblers of North America (1914). Stanowi fragment tablicy barwnej ukazującej jaja lasówek 12 różnych gatunków.
Autor: ALAN SCHMIERER from southeast AZ, USA, Licencja: CC0
Cerulean Warbler Setophaga cerulea female, Convention Center, South Padre Island, Cameron Co., Texas 02
Autor: Caleb Putnam, Licencja: CC BY 2.0
My personal late date, and right at the location of a territory from summer 2008, so presumably the same individual.
Autor: U.S. Army Environmental Command from Aberdeen Proving Ground, Maryland, United States, Licencja: CC BY 2.0
The variety and integrity of Fort Custer Training Center's habitat, especially wetlands and Prairie Fens, provides an ideal habitat for federally listed and ecologically important species such as the Mitchell’s Satyr Butterfly, the Eastern Box Turtle and the Cerulean Warbler (pictured). Eighty percent of Michigan flora and fauna are present at FCTC, owing to the installation’s unique ecological areas and high quality natural communities. FCTC provides a haven for wildlife and provides the public with access to rare and endangered species they would otherwise not have the opportunity to observe. FCTC is the winner of the FY2009 Secretary of the Army Award for Natural Resources Conservation (Small Team). (Photo by Brenda Keith, Research Biologist, Kalamazoo Nature Center)
Autor: DiaGraphic, Licencja: CC BY 2.0
5-4-15, in Doodletown; one of at least 8 singing males
Autor: Andy Reago, Licencja: CC BY 2.0
Cerulean Warbler Setophaga cerulea female on nest, Lost Valley, Weldon Spring Conservation Area, Missouri.
Autor: Andy Reago & Chrissy McClarren, Licencja: CC BY 2.0
Cerulean Warbler (male)
Autor: Cephas, Licencja: CC BY-SA 3.0
Distribution map of Cerulean Warbler
Autor: Andy Reago & Chrissy McClarren, Licencja: CC BY 2.0
Pair of Cerulean Warblers (Setophaga cerulea) building a nest.
Weldon Springs, California, 2016.















