Niedobór fosforylazy nukleozydów purynowych
| ||
| ICD-10 | D81.5 | |
| OMIM | 613179 | |
| MeSH | C562587 | |
Niedobór fosforylazy nukleozydów purynowych inaczej niedobór PNP – bardzo rzadka, genetycznie uwarunkowana choroba, u podłoża której leży zaburzenie metaboliczne puryn, a klinicznie charakteryzuje się ona: postępującym niedoborem odporności z nawracającymi zakażeniami, zaburzeniem wzrostu, występowaniem schorzeń autoimmunologicznych, chorób nowotworowych oraz zaburzeniami neurologicznymi.
Epidemiologia
Opisano zaledwie kilkadziesiąt przypadków tej wady metabolizmu. Ocenia się, że niedobór fosforylazy nukleozydów purynowych odpowiada za około 4% przypadków ciężkiego, złożonego niedoboru odporności. Nie ma różnic w występowaniu schorzenia między płciami.
Etiopatogeneza
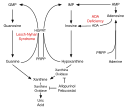
Fosforylaza nukleozydów purynowych (PNP, EC 2.4.2.1) jest enzymem w rezerwowym szlaku syntezy nukleozydów (ang. salvage synthesis), który metabolizuje (deoksy)inozynę do hipoksantyny, a (deoksy)guanozynę do guaniny.
nukleozyd purynowy + ortofosforan zasada purynowa + α-D-pentozo-1-fosforan
Jest białkiem, którego trimer ma masę cząsteczkową ok. 90 kD. Przyczyną niedoboru PNP są mutacje genu PNP, który znajduje się na długim ramieniu chromosomu 14, locus 14q11.2. Występuje w większości tkanek organizmu, ale z największą ekspresją w tkance limfoidalnej. W niedoborze PNP dochodzi do gromadzenia w komórkach toksycznych metabolitów: deoksyguanozyny, deoksyinozyny. Deoksyguanozyna jest metabolizowana do deoksytrójfosforanu guanozyny (dGTP) przez enzym kinazę deoksycytydynową, która jest odpowiedzialna za wiele działań patologicznych, przede wszystkim uszkodzenie limfocytów T[1][2]. Zaproponowano wiele wyjaśnień toksyczności metabolicznej w niedoborze PNP. Uważa się, że podwyższony dGTP stwierdzany w tym schorzeniu hamuje ważny enzym reduktazę rybonukleotydową, a zatem utrudnia podział komórkowy. Obniżone poziomy GTP mogą korelować z dysfunkcją neurologiczną[3].
Dziedziczenie w niedoborze fosforylazy nukleozydów purynowych wykazuje typ autosomalny recesywny.
Objawy
Pacjenci z niedoborem PNP cierpią na nawracające, oportunistyczne infekcje: wirusowe, bakteryjne, grzybicze i pierwotniakowe (Pneumocystis jiroveci), które zwykle rozpoczynają się w 1. roku życia.
U około 2/3 pacjentów występują poważne zaburzenia neurologiczne, takie jak:
- zaburzenia rozwoju psychofizycznego
- upośledzenie umysłowe
- ataksja
- spastyczność/hipotonia
- pobudzenie psychoruchowa
Objawy neurologiczne są różnorodne i niecharakterystyczne, czasem stają się pierwszą przyczyną rozpoczęcia diagnostyki pediatrycznej.
U ok. 1/3 pacjentów dochodzi do rozwoju chorób autoimmunologicznych, takich jak: autoimmunologiczna niedokrwistość hemolityczna, idiopatyczna plamica małopłytkowa i toczeń rumieniowaty układowy.
Najczęstszą przyczyną podjęcia diagnostyki w kierunku niedoboru PNP są nawracające, ciężkie zakażenia lub zaburzenia neurologiczne.
Rokowanie w niedoborze PNP jest złe. Bez leczenia nie jest możliwe przeżycie do trzeciej dekady życia[4][1].
Rozpoznanie
Wszyscy pacjenci mają podwyższony poziom inozyny, deoksyinozyny, guanozyny i deoksyguanozyny we krwi i moczu. Poziom kwasu moczowego we krwi jest zwykle niski. Pacjenci wykazują limfocytopenię B i T (CD4 > CD8), słabą odpowiedź proliferacyjną, ale normalne ilość limfocytów NK. Stwierdza się też panhypogammaglobulinemię, brak jest specyficznych przeciwciał poszczepiennych.
Diagnostyka prenatalna jest obecnie dostępna.
Leczenie
Chociaż w przeszłości próbowano zastosować wiele różnych metod np.: transfuzji krwinek czerwonych i suplementacji diety purynami i pirymidynami, to jedyna szansa na powodzenie leczenia polega na wczesnym wykryciu choroby i zastosowaniu przeszczepu szpiku kostnego. W świetle złych rokowań związanych z rozpoznaniem niedoboru PNP, należy rozważyć przeszczepienie szpiku kostnego u wszystkich pacjentów. Choć po przeszczepie szpiku stan immunologiczny ulega zdecydowanej poprawie, zwykle nie dotyczy zaburzeń neurologicznych. Nadzieje wiąże się z ulepszonymi w przyszłości formami leczenia, takimi jak np. terapia genowa.
Zobacz też
- niedobór deaminazy adenozynowej (niedobór ADA)
Przypisy
- ↑ a b Alan P Knutsen, Harumi Jyonouchi: Purine Nucleoside Phosphorylase Deficiency (ang.). eMedicine. [dostęp 2018-05-19].
- ↑ Agnieszka Jurecka: Wrodzone wady metabolizmu puryn i pirymidyn (pol.). Postępy biochemii. [dostęp 2018-05-19].
- ↑ HA. Simmonds, LD. Fairbanks, GS. Morris, G. Morgan i inni. Central nervous system dysfunction and erythrocyte guanosine triphosphate depletion in purine nucleoside phosphorylase deficiency.. „Arch Dis Child”. 62 (4), s. 385-91, Apr 1987. PMID: 2439024.
- ↑ Eyal GRUNEBAUM: Purine nucleoside phosphorylase deficiency (ang.). Orphanet. [dostęp 2018-05-19].
Linki zewnętrzne
- Niedobór fosforylazy nukleozydów purynowych w serwisie internetowym Genetics Home Reference (ang.)
- Niedobór fosforylazy nukleozydów purynowych w serwisie Orphanet.
- Niedobór fosforylazy nukleozydów purynowych w bazie Online Mendelian Inheritance in Man (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.(c) Zachary P. Christensen, CC BY-SA 4.0
Purine salvage pathway illustrating enzymes effected by Lesch-Nyhan syndrome, ADA deficiency, febuxostat, and allopurinol