Pajęczaki
| Arachnida[1] | |
| Lamarck, 1801 | |
| Okres istnienia: sylur–dziś | |
 Ilustracja różnych pajęczaków z Kunstformen der Natur Ernsta Haeckela | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Podtyp | |
| Nadgromada | |
| Gromada | pajęczaki |
Pajęczaki (Arachnida) – gromada stawonogów z podtypu szczękoczułkopodobnych i nadgromady szczękoczułkowców. Obejmuje około 112 tysięcy opisanych gatunków współczesnych, ale ich faktyczna liczba przekraczać może milion. Ponadto znanych jest około 2 tysięcy gatunków wymarłych. Ciało mają podzielone na dwie tagmy prosomę i opistosomę lub na dwie pseudotagmy gnatosomę i idiosomę. Dwie przednie pary przydatków to szczękoczułki i nogogłaszczki. Odnóży krocznych są 4 pary, rzadko mniej. Większość zasiedla lądy, rzadko są wtórnie słodko- lub słonowodne. Zamieszkują rozmaite siedliska i przyjmują różne strategie pokarmowe. Rozwój pozazarodkowy może mieć charakter epimorfozy lub metamorfozy. Liczne gatunki mają duże znaczenie dla człowieka, zarówno pozytywne (drapieżniki, destruenci) jak i negatywne (szkodniki upraw, pasiek i produktów spożywczych, pasożyty, wektory patogenów, źródła alergenów, zwierzęta jadowite).
Morfologia
Przedstawiciele pajęczaków osiągają rozmiary od 0,08 mm w przypadku niektórych roztoczy[2] do blisko metra długości u wymarłych Brontoscorpio anglicus i Praearcturus gigas[3], a wśród współczesnych do 23 cm długości ciała u skorpiona Heterometrus swammerdami[4] i do 25 cm rozpiętości odnóży u niektórych ptaszników[5]. Masa ciała u form współczesnych dochodzi do 50 g u skorpiona cesarskiego[6]. Kształt ciała może być różny: od wydłużonego po workowaty[7]. Ciało typowo składa się z dwóch tagm: prosomy i opistosomy[a] (zwanych też głowotułowiem i odwłokiem[9])[7], jednak u roztoczy podział na pierwotne tagmy często zanika, a zamiast niego pojawiają się nieodpowiadające segmentacji pseudotagmy: gnatosoma i idiosoma, a w wyniku dalszych modyfikacji: proterosoma i hysterosoma[2].
Prosoma
Prosoma powstaje w rozwoju zarodkowym przez zlanie się somitu ocznego (akronu) z sześcioma segmentami pozaocznymi[10][11][12]. Somit oczny mieć może od 1[9] do 12 par oczu prostych[6], natomiast brak u pajęczaków oczu złożonych. Podobnie jak u innych szczękoczułkowców brak jest czułków i żuwaczek, za to pierwszy z somitów pozaocznych dysponuje przydatkami gębowymi w postaci szczękoczułków (chelicer). Zbudowane są one z 1–3 członów, mogą być zwieńczone szczypcami, pazurami, mieć postać sztyletów, igieł lub haków. Na szczękoczułkach uchodzić mogą gruczoły jadowe (np. pająki), gruczoły przędne (zaleszczotki) albo mogą znajdować się na nich aparaty kopulacyjne samców: spermatodaktyl, spermatotrema (żukowce) lub aparat biczykowy (solfugi)[7]. Drugi somit zaoczny zaopatrzony jest w nogogłaszczki[12], które albo są podobne budową do odnóży krocznych i pełnią funkcję zmysłową, albo zakończone są szczypcami i pełnią funkcję chwytną. U zaleszczotków szczypce nogogłaszczków mają ujścia gruczołów jadowych. U samców pająków ostatni człon nogogłaszczków zawiera aparat kopulacyjny w postaci bulbusa[7]. Pozostałe somity prosomy typowo mają po parze odnóży krocznych (łącznie 4 pary)[13]. U roztoczy i kapturców liczba par odnóży może być mniejsza (2–3)[9][7]. Typowo odnóże kroczne buduje 6 członów: biodro, krętarz, udo, rzepka lub kolano, goleń i stopa, jednak mogą się one wtórnie zrastać lub dzielić[7] (maksymalnie jest ich 8[9]). U roztoczy odnóża kroczne mogą być zmodyfikowane do pełnienia innych funkcji, np. chwytnych lub pływnych[2], natomiast u spawęk pierwsza ich para przekształcona jest w narządy zmysłowe analogiczne czułkom[14].
Prosoma zwykle nakryta jest karapaksem, ale jej pierwsze cztery segmenty (cefalosoma[8]) pokryte mogą być propeltidium, a kolejne dwa nienakryte żadną tarczką (solfugi) lub nakryte odpowiednio mezopeltidium i metapeltidium (rozłupnogłowce i głaszczkochody). Spód prosomy może być w całości zakryty biodrami albo może między nimi występować sternum[7].
Opistosoma
Opistosoma może być maksymalnie 12-segmentowa (w rozwoju zarodkowych 13-segmentowa[6]), przy czym u wielu grup segmentacja jest wtórnie zatarta[9][13]. W pierwotnym planie budowy dzieli się na 7-segmentową mezosomę (zwaną też przedodwłokiem[9]) i 5-segmentową metasomę (zwaną też zaodwłokiem[9]). Taki podział zachowuje się np. u skorpionów. Powszechna jest jednak tendencja do redukcji liczby segmentów, w tym częsty jest całkowity zanik metasomy. Na mezosomie brak jest odnóży lokomocyjnych, za to występować mogą ich zmodyfikowane wersje w postaci narządów oddechowych (płucotchawki, worki płucne), zmysłowych (grzebienie[6]), płciowych (wieczko płciowe[6]) lub przędnych (kądziołki)[11][9]. Na metasomie odnóży zawsze brak[7]. Opistosomę u skorpionów wieńczy telson z kolcem jadowym[6], a u rozłupnogłowców i biczykoodwłokowców biczyk homologiczny z owym telsonem[15][16].
Pseudotagmy
U roztoczy podział na prosomę i opistosomę zastąpiony jest tym na pseudotagmy: gnatosomę i idiosomę, przy czym narządy gębowe leżą na tej pierwszej, ale oczy i mózg w tej drugiej[2]. U dręczy idiosoma często dzieli się bruzdą sejugalną na propodosomę i hysterosomę[17]. Propodosoma łączyć się może z gnatosomą w proterosomę[18]. Gnatosoma u niektórych pasożytniczych Astigmata redukuje się, a nawet całkiem zanika[19]. U Prostigmata idiosoma dzielić się może na aspidosomę, podosomę i opistosomę[20].
Anatomia i fizjologia

Pokrycie ciała i szkielet
Ciało pajęczaków pokryte jest chitynowym oskórkiem, stanowiącym szkielet zewnętrzny. Składa się on z zawierającej dużo wosków i lipidów epikutykuli, zesklerotyzowanej egzokutykuli (brak jej na błonach stawowych i międzysegmentalnych) oraz endokutykuli[9][7]. Pod oskórkiem znajduje się jednowarstwowy, twórczy naskórek, zwany podskórkiem[9]. Egzoszkielet po stronie wewnętrznej ma apodemy służące przyczepowi mięśni. Oprócz egzoszkieletu w prosomie obecny jest szkielet wewnętrzny w postaci endosternitu[7].
Układ nerwowy

Układ nerwowy w większości przypadków jest silnie skoncentrowany i wszystkie zwoje nerwowe lub większa ich część zlewają się w jedną masę dookoła przełyku[11]. Najsłabsza koncentracja występuje u skorpionów, ale nawet u nich w podprzełykową część masy nerwowej zlewają się wszystkie zwoje prosomy i cztery pierwsze mezosomy[7]. Mózg składa się z przodomóżdża, śródomóżdża i tyłomóżdża[11]. Przodomóżdże unerwia oczy, śródmóżdże szczękoczułki, zaś tyłomóżdże nogogłaszczki[12][10]. Często w mózgu obecne są odpowiedzialne za kojarzenie ciała grzybkowate, które objętościowo mogą stanowić jego duży fragment[11][7]. Tylna część mózgu łączy się z wegetatywnym układem nerwowym[11].
Zmysły
Szczecinki zmysłowe (włoski czuciowe, sensilla) rozmieszczone są na całym ciele, przy czym najliczniej na szczękoczułkach, nogogłaszczkach i w odsiebnych częściach odnóży krocznych. Mogą one być wrażliwe na drgania (mechanoreceptory), temperaturę (termoreceptory), skład chemiczny (chemoreceptory zapachowe i smakowe) czy wilgotność (higroreceptory). Szczególnym ich przykładem są wyspecjalizowane w wyczuwaniu drgań powietrza mechanoreptory – trichobotria[7]. Receptorem charakterystycznym dla pajęczaków są narządy szczelinowate – występujące pojedynczo lub w grupach (narządy lirowate)[21]. Są one narządami proprioreceptywnymi, co znaczy, że odbierają informacje o napięciu poszczególnych części oskórka – np. stawów[9], ale mogą być też czułe na ruch powietrza i drgania podłoża[7].
Wiele specyficznych narządów zmysłowych znaleźć można wśród roztoczy, np. solenidia, eupatidia[17], organ głaszczkowy, narząd Hallera, tritosternum[22][23] czy organ Claparede'a[24].
Wzrok
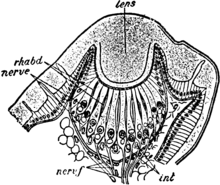
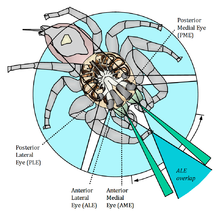
U pajęczaków występują tylko oczy proste o formie pęcherzykowej lub kubkowej (brak oczu złożonych)[9]. Pozbawione są one właściwego aparatu dioptrycznego zbudowanego ze stożków krystalicznych – ich rolę przejmują stożkowate wypustki rogówki[25]. Wyróżnia się oczy boczne i środkowe (główne)[7]. Boczne wyewoluowały z oczu złożonych słonowodnych szczękoczułkowców[26][27] i mają podział na siatkówkę, ciało szkliste, soczewkę i rogówkę[7], a ponadto mogą mieć błonę odblaskową zwiększającą zdolność do odbierania światła[26]. Ich liczba u form współczesnych sięga 5 par, ale u wymarłych Trigonotarbida bywało ich 15, a u niektórych wymarłych skorpionów około 30[27]. Oczy środkowe są strukturami pochodzenia ektodermalnego[26].
U niektórych bezokich roztoczy, np. niektórych kleszczy, spotkać można prostsze fotoreceptory[23].
Układ wewnątrzwydzielniczy
Charakterystycznym dla pajęczaków elementem układu wewnątrzwydzielniczego jest, położony za mózgiem, organ retrocerebralny (Schneidera), odpowiedzialny m.in. za wytwarzanie hormonów linienia i wzrostu[7].
Oddychanie
Skorpiony, biczykoodwłokowce, rozłupnogłowce, tępoodwłokowce i zdecydowana większość pająków oddycha za pomocą płuc książkowych (worków płucnych), leżących w opistosomie w liczbie 1–4 par i będących homologami skrzeli ostrogonów. Składają się one z komory płucnej połączonej przedsionkiem z zamykalną przetchlinką. Ściana komory sfałdowana jest w ciasno upakowane, silnie unaczynione blaszki. Powietrze, przechodząc przez przestrzenie między nimi, oddaje do hemolimfy tlen, a zabiera dwutlenek węgla i usuwa go z organizmu[7][9]. U części pająków blaszki płucne są rurkowato zwinięte tworząc płucotchawki[7].
Kosarze, zaleszczotki, solfugi, kapturce, większość roztoczy i niektóre pająki oddychają tchawkami, przy czym u kosarzy, solfug, niektórych roztoczy i pająków są to tchawki krzewiasto rozgałęzione, u innych roztoczy i pająków tchawki nierozgałęzione, a u większości zaleszczotków i kapturców tchawki sitowe. U pająków tchawki mogą współwystępować z workami płucnymi. Przetchlinki tchawek rozmieszczone bywają bardzo różnie[7].
Głaszczkochody i niektóre roztocze oddychają całą powierzchnią ciała[7].
U tępoodwłokowców i niektórych głaszczkochodów występują wspomagające oddychanie woreczki brzuszne[7].
U niektórych tępoodwłokowców i roztoczy występuje pozwalający na oddychanie pod wodą plastron[7][28]. Wodne pająki wykorzystują w tym celu hydrofobowe owłosienie opistosomy, a niekiedy też specjalne oprzędy[29].
Krążenie
Występuje układ krwionośny otwarty, w którym krąży hemolimfa[11] i którego stopień złożoności zależny jest od typu narządów oddechowych[7]. U grup płucodysznych położone w grzbietowej części opistosomy, w zatoce osierdziowej serce ma kształt rurki poprzebijanej ostiami, ku przodowi przechodzącej w aortę przednią, a bokami w tętnice boczne. Hemolimfa ku przodowi dostaje się przez rozwidloną aortę do brzusznej zatoki prosomalnej, natleniając układ nerwowy i odnóża, a bokami do brzusznej zatoki opistosomalnej, natleniając narządy wewnętrzne. Z tej ostatniej zatoki dostaje się do worków płucnych, gdzie zachodzi oddychanie zewnętrzne, a następnie żyłami płucnymi do zatoki osierdziowej[7]. Największy stopień złożoności występuje u skorpionów, gdzie ostiów jest 7 par, arterii bocznych 9 par, a worków płucnych 4 pary[9][7]. U form prymitywnych serce wykazuje przewężenia zgodne z segmentacją opistosomy[9].
U grup mających tchawki, które są narządami doprowadzającymi tlen do wszystkich tkanek, system naczyń ulega uproszczeniu. U głaszczkochodów i wielu roztoczy zarówno naczynia jak i serce całkiem zanikły, a hemolimfa obmywa ciało dzięki skurczom innych mięśni[9][7].
Układ pokarmowy
Otwór gębowy u wielu grup leży na spodzie prosomy w zagłębieniu zwanym myliosomą, będąc otoczonym biodrami nogogłaszczków i ewentualnie pierwszej lub pierwszej i drugiej pary odnóży. W rozdrabnianiu pokarmu często udział biorą wyrostki tych bioder zwane endytami[11][7]. U kosarzy i skorpionów formują one jamę przedgębową zwaną stomoteką[14]. U innych pajęczaków otwór gębowy leży na wydłużonym rostrum[11][7], przy czym aparat przedgębowy solfug i zaleszczotków zwie się rostrosomą[14]. U roztoczy otwór gębowy leży na szczycie gnatosomy[2].
Z wyjątkiem roztoczy pajęczaki pobierają pokarm płynny, w związku z czym część trawienia jest zewnętrzna. Enzymy, a czasem też jad są wstrzykiwane w pokarm lub jest nimi on oblewany, po czym cząstki stałe odfiltrowywane są na specjalnych szczecinkach. W zasysaniu biorą udział: umięśniona gardziel, przełyk, a w niektórych grupach też żołądek ssący[7][9]. Jelito środkowe jest silnie rozbudowane zachyłkami o funkcji trawiennej i magazynującej pokarm, tworzącymi wątrobotrzustkę[11]. Zachyłki te zajmują zdecydowaną większość objętości opistosomy. Dzięki temu pajęczaki mogą przyjmować pokarm nieregularnie, z długimi przerwami[7][9]. Z kolei występująca u roztoczy gnatosoma umożliwia zjadanie stałych cząstek pokarmowych[2].
Wydalanie i osmoregulacja
Tak jak u innych szczękoczułkowców, występują u pajęczaków gruczoły biodrowe (koksalne), powstałe z przekształconych metanefrydiów i uchodzące w okolicach nasad odnóży krocznych, rzadziej nasad nogogłaszczków, a u roztoczy do kanału podocefalicznego. Pełnią one głównie funkcję osmoregulacyjną. Ponadto u roztoczy udział w osmoregulacji biorą organy pachwinowe i papille genitalne[7].
Z wyjątkiem niektórych roztoczy do tylnej części jelita środkowego otwierają się cewki Malpighiego (pochodzenia endodermalnego). Odpowiadają one za wydalanie guaniny i kwasu moczowego[7].
Niektóre pajęczaki, takie jak roztocze, tracą bardzo mało wody w wyniku parowania, a przy odpowiednio wysokiej wilgotności powietrza mogą wchłaniać wodę z powietrza atmosferycznego[30].
Układ rozrodczy
Pajęczaki są rozdzielnopłciowe, najczęściej z zaznaczonym dymorfizmem płciowym. Układ rozrodczy może być różnorodnie ukształtowany. Jądra i jajniki mogą być parzyste lub nieparzyste, formy workowatej, nitkowatej lub groniastej[7]. Oprócz roztoczy otwór płciowy (gonopor) leży na drugim segmencie opistosomy lub jego odpowiedniku[9]. U niektórych grup brak narządów kopulacyjnych. U kosarzy i niektórych roztoczy występuje właściwy narząd kopulacyjny, w postaci prącia. Pozostałe grupy mają zastępcze narządy kopulacyjne na szczękoczułkach, nogogłaszczkach lub odnóżach krocznych[7].
Biologia i ekologia
Rozród i rozwój
U pajęczaków występuje zapłodnienie wewnętrzne, przy czym plemniki przekazywane są w spermatoforach składanych na podłożu lub zaplemnienie następuje przez kopulację[31]. W pierwszym przypadku samiec może je składać przy samicy lub bez jej obecności. W drugim przypadku nasienie przekazywane może być z bezpośrednio z gonoporu samca do gonoporu samicy, za pośrednictwem prącia (np. kosarze, niektóre roztocze właściwe) lub za pośrednictwem innych narządów kopulacyjnych, znajdujących się na szczękoczułkach (np. solfugi, niektóre roztocze), nogogłaszczkach (pająki) lub stopach odnóży lokomocyjnych (np. kapturce i wodopójki). Nierzadko zaplemnienie poprzedzone jest zachowaniami godowymi, np. tańcami[7]. Nasienie często wymaga kapacytacji[31][32]. W wielu przypadkach samica ma możliwość przechowywania nasienia w spermatece przez długi czas i wykorzystania go do zapłodnienia dopiero w sprzyjających warunkach[32].
Jaja są najczęściej centrolecytalne, rzadziej telolecytalne lub oligolecytalne[7]. Bruzdkowanie jaj ma różny przebieg w poszczególnych grupach, np. u skorpionów częściowe tarczowe, a u pająków częściowe powierzchniowe[9]. Oprócz gatunków jajorodnych występują żyworodne, w tym odżywiające zarodki w macicy[9][6].
U pajęczaków spotyka się różne formy troski rodzicielskiej: pilnowanie, maskowanie lub noszenie ze sobą jaj, a nawet noszenie i karmienie młodych[7][33][6].
Rozwój pozazarodkowy może mieć charakter epimorfozy lub metamorfozy ze stadiami larwalnymi i nimfalnymi, a u Opilioacarida i niektórych roztoczy właściwych także z nieaktywnym stadium prelarwalnym[7][2]. U pasożytów wielożywicielowych pojawiać się mogą złożone cykle życiowe[23].
Pokarm
Pajęczaki przyjmują rozmaite strategie pokarmowe. Można wśród nich znaleźć fitofagi (np. fitofagi ssące i indukujące galasy[20]), mykofagi, drapieżniki, wszystkożerców, saprofagi, detrytusożerców, komensale, ekto- i endopasożyty (w tym hematofagi[23], mukofagi[20] i dermatofagi[19])[11][2][9]. Największą różnorodność pobieranego pokarmu spotyka się wśród roztoczy, podczas gdy pozostałe pajęczaki to drapieżniki, a rzadziej wszystkożercy lub padlinożercy[7]. Pajęczaki często odgrywają kluczowe role w ekosystemach, np. mechowce mogą pożerać około połowy biomasy odkładającej się rocznie na dnie lasów[18].
Występowanie i różnorodność
Do 2011 roku opisano ponad 110,6 tysiąca współczesnych gatunków pajęczaków, w tym 54,5 tysiąca roztoczy oraz 42,5 tysiąca pająków[34]. Ich faktyczna liczba jest jednak znacznie większa – współczesną faunę samych roztoczy szacuje się na około miliona gatunków[2]. Ponadto znane są liczne gatunki wymarłe; do 2008 roku opisano ich 1593[35].
Pajęczaki rozprzestrzenione są we wszystkich krainach zoogeograficznych, sięgając również za oba koła podbiegunowe[2]. Zamieszkują głównie lądy, przy czym spotkać je można od pustyń po tundrę i do 6000 m n.p.m. w Himalajach[17]. Rzadziej są wtórnie słodkowodne (np. wodopójki, topik) lub wtórnie słonowodne (niektóre roztocze właściwe, w tym Bathyhalacarus quadricornis spotykany nawet na 7000 m. p.p.m.[17]). Drobne pająki i roztocze wchodzą w skład aeroplanktonu i mogą być unoszone na dużych wysokościach[36][37].
Systematyka i filogeneza
Takson ten wprowadzony został w 1801 roku przez Lamarcka w Systême des Animaux sans Vertébrés pod nazwą Arachnides, przy czym autor włączył doń także kikutnice i wije[38]. Współcześnie pajęczaki umieszcza się wraz z wielkorakami, ostrogonami i innymi taksonami wymarłymi w nadgromadzie szczękoczułkowców, a te zaś wraz z kikutnicami w podtypie szczękoczułkopodobnych[11][8]. Jeszcze szerzej definiuje się pajęczakokształtne, obejmujące też m.in. trylobity[8].
We współczesnych[b] systemach dzieli się pajęczaki na 14 rzędów o ustalonym monofiletyzmie[39][40]:
- Amblypygi Thorell, 1883 – tępoodwłokowce
- Araneae Clerck, 1757 – pająki
- †Haptopoda Pocock, 1911
- Opiliones Sundevall, 1833 – kosarze
- Palpigradi Thorell, 1888 – głaszczkochody
- †Phalangiotarbi Haase, 1890
- Pseudoscorpiones de Geer, 1778 – zaleszczotki
- Ricinulei Thorell, 1876 – kapturce
- Schizomida Petrunkevitch, 1945 – rozłupnogłowce
- Scorpiones C.L. Koch, 1851 – skorpiony
- Solifugae Sundevall, 1833 – solfugi
- Thelyphonida Latreille, 1804 – biczykoodwłokowce
- †Trigonotarbida Petrunkevitch, 1949
- †Uraraneida Selden & Shear, 2008
oraz roztocze (Acari Leach, 1817), które są przypuszczalnie difiletyczne, mogą mieć różną rangę (od rzędu[11] do podgromady[41]) i być rozdzielane na dwa (nad)rzędy[39]:
- Parasitiformes Leach, 1815 (syn. Anactinotrichida) – dręcze
- Acariformes Zakhvatkin, 1952 (syn. Actinotrichida) – roztocze właściwe
i/albo na 6 rzędów[40]:
- Opilioacarida Zakhvatkin, 1952
- Holothyrida Thon, 1905
- Ixodida Leach, 1815 – kleszcze
- Mesostigmata G. Canestrini, 1891 – żukowce
- Trombidiformes Reuter, 1909
- Scarcoptiformes Reuter, 1909
Relacje pomiędzy wymienionymi rzędami jak i monofiletyzm pajęczaków jako całości jest przedmiotem debat[42]. W drugiej połowie XX wieku zamiast lub obok pajęczaków w randze gromad pojawiały się takie taksony jak: Acaromorpha[43], Apatellata[44], Cryptognomae[44], Dromopoda[11][45], Epimera[44], Opillonidea[44], Micrura[11][45], Scorpionidea[44], Scorpionomorpha[43] czy Solifugomorpha[43]. Współcześnie kwestia monofiletyzmu pajęczaków rozbija się o pozycję ostrogonów[42]. W 2013 Lamsdell na podstawie analizy filogenetycznej obejmującej liczne taksony wymarłe znacząco zrewidował systematykę szczękoczułkowców, redefiniując Xiphosura i Xiphosurida (oba taksony nazywane są w polskojęzycznej literaturze ostrogonami[9][11]). Według niej pajęczaki stanowią grupę siostrzaną dla wielkoraków, tworząc z nimi klad Sclerophorata, który to z Chasmataspidida tworzy klad Dekatriata. Natomiast Offacolus zajmuje pozycję bazalną wśród szczękoczułkowców, których pozostała część określona została jako klad Prosomapoda[8]. Jednak według niektórych analiz molekularnych np. Pepato i Klimova z 2015 oraz Ballesterosa i Sharmy z 2019 ostrogony zagnieżdżają się w drzewie rodowym pajęczaków, np. w tym drugim badaniu tworząc klad z kapturcami i solfugami[46]. Relacje między rzędami pajęczaków pozostają niepewne[39][42]. Najstabilniejszym wynikiem analiz molekularnych i morfologicznych XXI wieku jest łączenie pająków, tępoodwłokowców, biczykoodwłokowców, rozłupnogłowców, Uraraneida i Haptopoda w klad Tetrapulmonata (np. wyniki Shultza z 2007[14], Pepato i innych z 2010[47], Regiera i innych z 2010[48], Rehma i innych z 2012[49], Sharmy i innych z 2014[50], Ballesterosa i Sharmy z 2019[46]). Dość powszechnie analizy molekularne rozpoznają w roztoczach takson difiletyczny, złożony z nietworzących jednego kladu Parasitiformes i Acariformes (np. wyniki Shultza z 2007[14], Dabert i innych z 2010[51], Pepato i innych z 2010[47], Pepato i Klimova z 2015[52], Garwooda i Dunlopa z 2014[53], Ballesterosa i Sharmy z 2019[46]).
Znaczenie gospodarcze
Drapieżne pajęczaki ograniczają liczebność wielu szkodliwych stawonogów, nierzadko będąc ich głównymi wrogami[9][20]. Liczne roztocze z grupy mechowców i Prostigmata stanowią główny element mezofauny glebowej i ściółkowej[20][18], zwłaszcza w lasach, np. na 1 m² drzewostanu sosnowego może występować 683 600 roztoczy[54], a mechowce mogą pożerać około połowy biomasy odkładającej się rocznie na dnie lasów[18]. Odgrywają więc kluczową rolę w podtrzymywaniu żyzności gleby, zwłaszcza w ekosystemach zmienionych przez gospodarkę ludzką[9][54].
Fitofagiczne roztocze z grupy Prostigmata są szkodnikami roślin uprawnych. Należą tu m.in. szpeciele, przędziorki, Tenuipalpidae, Penthaleidae. Wśród roztoczy znaleźć można również wrogów tych szkodników, jak np. dobroczynkowate, Tydeidae, niektóre Stigmaeidae i różnopazurkowce[20].
W hodowlach pieczarek jako szkodnika notuje się Tarsonemus myceliophagus[20].
Ważnymi szkodnikami magazynowymi są niektóre rozkruszkowate (np. rozkruszek mączny). Niszczyć mogą nie tylko ziarna i produkty zbożowe, ale też przetwory mleczne, suszone warzywa i owoce, mięso i jego przetwory, tkaniny naturalne i wyroby ze skóry[19]. Do ich wrogów należy Cheyletus eruditus z rodziny sierposzy[20].
Przędzę pajęczą wykorzystuje się w bioinżynierii, przy czym jej białka produkowane są do tych celów przez organizmy transgeniczne. Jej potencjalne zastosowania obejmują liny, nici chirurgiczne, spadochrony, kamizelki kuloodporne, biodegradowalne opakowania, sztuczne ścięgna i wiele innych[55].

Niektóre pajęczaki bywają spożywane przez ludzi, np. w Kambodży za przysmak uchodzą smażone ptaszniki[56], a w niektórych rejonach Chinach jada się smażone skorpiony[57].
Znaczenie medyczne i weterynaryjne
Jady
Użądlenia przez skorpiony mają duże znaczenie medyczne, zwłaszcza w słabiej rozwiniętych krajach strefy tropikalnej i subtropikalnej. Corocznie odnotowuje się ich około 1,2 miliona, z których zależnie od źródła od 0,27 do 3% ma skutki śmiertelne[58][59]. Przykładowo w Brazylii w 2011 odnotowano 57 933 wstrzyknięć jadu z których 91 było śmiertelnych[59], w Meksyku notuje się około 1000 przypadków śmiertelnych rocznie, a w Stanach Zjednoczonych odnotowano zaledwie 4 przypadki śmiertelne w okresie 11 lat[58].
Ukąszenia przez pająki mają mniejsze znaczenie; w ciągu całego XX wieku wiarygodnie odnotowano tylko około 100 przypadków śmiertelnych[60]. Duże znaczenie medyczne mają według WHO tylko przedstawiciele 4 rodzajów: Loxosceles, Phoneutria, Latrodectus i Atrax[59]. Spośród gatunków występujących naturalnie w Polsce konsekwencje zdrowotne odnotowywano tylko w przypadku ukąszenia kolczaka zbrojnego[61], jednak przedstawiciele niebezpiecznego rodzaju Phoneutria są często zawlekani z transportami towarów, zwłaszcza bananów[62].
Składniki jadów pajęczaków znajdują rozmaite zastosowania medyczne. Badano je pod kątem wykorzystania w terapii np. arytmii[63], choroby Alzheimera[64], udaru mózgu[65], zaburzeń erekcji[66] czy guza mózgu[67]. Potencjalnie służyć mogą zwalczaniu infekcji wirusowych, bakteryjnych i grzybiczych[67]. Ponadto peptydy z jadów pająków wykorzystane mogą być do stworzenia przyjaznych środowisku insektycydów[68].
Pasożyty i wektory

Żerowanie pasożytów wywołuje u żywicieli liczne negatywne skutki zdrowotne. Największe znaczenie mają tu roztocze: kleszczy, Astigmata i Prostigmata[23][19][20].
Substancje zawarte w ślinie kleszczowatych wywoływać mogą u ludzi, psów, bydła i owiec paraliż kleszczowy[69][70][71][72]. Ponadto kleszczowate są drugimi najważniejszymi wektorami chorób odzwierzęcych ludzi po komarowatych[59]. Przenoszą patogeny boreliozy[73], kleszczowego zapalenia mózgu[74], babeszjoz[23], gorączki plamistej, tularemii[75] i wielu innych chorób (zobacz: znaczenie medyczne i weterynaryjne kleszczowatych, choroby odkleszczowe).
Gatunki z rodzin Sarcoptidae i Psoroptidae żerując w naskórku wywołują dermatozy ludzi, bydła i innych ssaków domowych. Przykładem jest świerzbowiec ludzki wywołujący świerzb. Ponad 330 gatunków Psoroptida pasożytuje na drobiu i innych ptakach hodowlanych. Wywołują one duże straty, a niektóre Epidermoptidae potrafią uśmiercić cały inwentarz masowych ferm drobiu[19].
Spośród Prostigmata na ludziach i ssakach domowych żerują m.in. nużeńce oraz larwy swędzików i Leeuwenhoekiidae[20].
Kilka gatunków roztoczy pasożytujących na pszczole miodnej wywoływać może duże szkody w pasiekach, np. świdraczek pszczeli i dręcz pszczeli[22][20]. Wrogiem tego drugiego jest zaleszczotek książkowy – również pajęczak[76].
Alergeny
Liczni przedstawiciele grupy Astigmata wywołują alergie u ludzi i innych zwierząt[19][77]. Największe znaczenie mają roztocze kurzu domowego z rodziny Pyroglyphidae (np. skórożarłoczek skryty) należące do najczęstszych przyczyn atopowego nieżytu nosa i atopowej astmy oskrzelowej. Czynnikami alergizującymi są ich odchody, martwe ciała, wylinki i wydzieliny[77].
W kulturze

Pajęczaki, zwłaszcza pająki i skorpiony, pojawiają się w wierzeniach i opowieściach licznych kultur, co najmniej od czasów starożytnych[78]. Sumeryjską boginię Uttu przedstawiano jako pajęczycę przędącą swą sieć[79]. Już w okresie państwa nowobabilońskiego Chaldejczycy skorpionem nazwali jeden ze znaków zodiaków[80]. Skorpion był symbolem Sekret – jednej z najstarszych bogiń Starożytnego Egiptu[81]. W mitologii greckiej i rzymskiej pojawia się postać Arachne – mistrzyni tkactwa, która skończyła pod postacią pająka[82]. Pająki przedstawiane były w sztuce różnych kultur prekolumbijskich, np. w geoglifie kultury Nazca[83], na ceramice kultury Mochica[84]. Według kosmogonii północnoamerykańskiego ludu Hopi świat utkany został boginię-pajęczycę Kokyangwuti[85]. Bogini-pajęczyca Na'ashjé'ii Asdzáá jako opiekunka ludzkości występuje w wierzeniach Nawahów[86]. Pająk jest stwórcą wszechświata według tradycyjnych wierzeń niektórych mieszkańców Oceanii; według ludów z Kiribati nazywa się on Nareau[87], a według ludów z Nauru i Mikronezji – Areop-Enap[88]. W kulturach Afryki oraz zachodniej, środkowej i południowej Azji skorpiony pojawiają się jako symbole zła, sił do walki z nim lub ludzkiej seksualności. Są częstym motywem w sztuce islamu[89]. Umieszczanie motywu skorpiona na kilimie ma chronić przed jego użądleniem[90]. Pająki w różnych kulturach symbolizować mogą cierpliwość (ze względu na polowanie z zasadzki) jak szelmostwo czy złośliwość (ze względu na jadowitość)[91]. Istotną częścią folkloru ludów Afryki Zachodniej i Karaibów są opowieści o Anansi – szachraju pod postacią pająka[92]. Postać pająka-szachraja pojawia się też w opowieściach północnoamerykańskich Dakotów[93]. W mitach japońskich postać pająka ma yōkai: Tsuchigumo[94].
Uwagi
Przypisy
- ↑ Arachnida, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b c d e f g h i j Czesław Błaszak: Rząd: roztocze – Acari. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ W. David Sissom: Systematics, Biogeography and Paleontology. W: Gary A. Polis: Biology of Scorpions. Stanford, Kalifornia: Stanford University Press, 1990.
- ↑ Manny Rubio: Scorpions: Everything About Purchase, Care, Feeding, and Housing. Barron's, 2000, s. 26–27. ISBN 978-0-7641-1224-9.
- ↑ Herbert W. Levi, Lorna R. Levi: Spiders and their Kin. Golden Press, 2001, s. 20, 44. ISBN 1-58238-156-9.
- ↑ a b c d e f g h Marek Żabka: Rząd: skorpiony – Scorpionida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an Czesław Błaszak: Gromada: pajęczaki – Arachnida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 51-63. ISBN 978-83-01-17447-7.
- ↑ a b c d e James C. Lamsdell. Revised systematics of Palaeozoic 'horseshoe crabs' and the myth of monophyletic Xiphosura. „Zoological Journal of the Linnean Society”. 167 (1), s. 1–27, 2013. DOI: 10.1111/j.1096-3642.2012.00874.x. ISSN 0024-4082.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y Czesław Jura: Bezkręgowce. Podstawy morfologii funkcjonalne, systematyki i filogenezy. Wyd. 3. Warszawa: PWN, 2005, s. 488-531.
- ↑ a b Ortega-Hernández, Javier; Janssen, Ralf; Budd, Graham E.. Origin and evolution of the panarthropod head – A palaeobiological and developmental perspective. „Arthropod Structure & Development. Evolution of Segmentation”. 46 (3), s. 354–379, 2017. DOI: 10.1016/j.asd.2016.10.011. ISSN 1467-8039.
- ↑ a b c d e f g h i j k l m n o p Czesław Błaszak: Podtyp: szczękoczułkopodobne – Cheliceromorpha; Nadgromada: szczękoczułkowce – Chelicerata. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 24-36. ISBN 978-83-01-17447-7.
- ↑ a b c Jason A. Dunlop, James C. Lamsdell. Segmentation and tagmosis in Chelicerata. „Arthropod Structure & Development.”. 46 (3), s. 395–418, 2017. DOI: 10.1016/j.asd.2016.05.002. ISSN 1467-8039.
- ↑ a b Jason A. Dunlop. Pycnogonid affinities: a review. „Journal of Zoological Systematics and Evolutionary Research”. 43 (1), s. 8-21, 2005. Blackwell Verlag. DOI: 10.1111/j.1439-0469.2004.00284.x.
- ↑ a b c d e J.W. Shultz. A phylogenetic analysis of the arachnid orders based on morphological characters. „Zoological Journal of the Linnean Society”. 150 (2), s. 221–265, 2007. DOI: 10.1111/j.1096-3642.2007.00284.x.
- ↑ Marek Żabka: Rząd: biczykoodwłokowce – Thelyphonida (Uropygi). W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 69-71. ISBN 978-83-01-17447-7.
- ↑ Marek Żabka: Rząd: rozłupnogłowce – Schizomida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 71-73. ISBN 978-83-01-17447-7.
- ↑ a b c d Jacek Dabert: Podrząd: Actinotrichida (Acariformes). W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 173-182. ISBN 978-83-01-17447-7.
- ↑ a b c d Ziemowit Olszanowski: Kohorta: mechowce – Oribatida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b c d e f Jacek Dabert: Kohorta: Astigmata. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b c d e f g h i j k Andrzej Kaźmierski: Kohorta: Prostigmata. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ J.W.S. Pringle. The function of the lyriform organs of arachnids. „Journal of Experimental Biology”. 32. s. 270–278 (ang.).
- ↑ a b Czesław Błaszak: Podrząd: Anactinotrichida (Parasitiformes). W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 129-135. ISBN 978-83-01-17447-7.
- ↑ a b c d e f Krzysztof Siuda: Kohorta: kleszcze — Ixodida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 153-173. ISBN 978-83-01-16568-0.
- ↑ Małgorzata Lochynska: Przydatność taksonomiczna cech morfologicznych stadiów młodocianych mechowców z podrodziny Crotoniinae Thorell, 1876 (Acari, Oribatida, Camisiidae). Rozprawa doktorska wykonana w Zakładzie Taksonomii i Ekologii Zwierząt, Wydział Biologii, Uniwersytet im. Adama Mickiewicza pod kierunkiem dra hab. Ziemowita Olszanowskiego. TOM I. Poznań: 2010.
- ↑ Gerhard Scholtz, Andreas Staude, Jason A. Dunlop. Trilobite compound eyes with crystalline cones and rhabdoms show mandibulate affinities. „Nature Communications”. 10 (2503), 2019.
- ↑ a b c Robert D. Barnes: Invertebrate Zoology. Philadephia: Holt-Saunders International, 1982, s. 596–604. ISBN 0-03-056747-5.
- ↑ a b Sebastian T. Miether, Jason A. Dunlop. Lateral eye evolution in the arachnids. „Arachnology”. 17 (2), s. 103-119, 2016. DOI: 10.13156/arac.2006.17.2.103.
- ↑ Marek Żabka: Rząd: tępoodwłokowce – Amblypygi. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 73-77. ISBN 978-83-01-17447-7.
- ↑ Marek Żabka: Rząd: pająki – Araneae. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 77-98. ISBN 978-83-01-17447-7.
- ↑ Knut Schmidt-Nielsen: Fizjologia zwierząt. Adaptacja do środowiska. Wyd. piąte. Warszawa: Wydawnictwo Naukowe PWN, 2008, s. 414–418. ISBN 978-83-01-15349-6.
- ↑ a b Wojciech Witalicki: Spermatogeneza, budowa plemników i filogeneza Cheliceromorpha. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b Susan G. Brown. Mating behavior of the golden-orb-weaving spider, Nephila clavipes: II. Sperm capacitation, sperm competition, and fecundity. „Journal of Comparative Psychology”. 99 (2), s. 167-175, 1985. DOI: 10.1037/0735-7036.99.2.167.
- ↑ Czesław Błaszak, Bożena Sikora: Rząd: zaleszczotki – Pseudoscorpionida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 108-115. ISBN 978-83-01-17447-7.
- ↑ Nigel E. Stork. How Many Species of Insects and Other Terrestrial Arthropods Are There on Earth?. „Annual Review of Entomology”. 63 (1), s. 31–45, 2018). DOI: 10.1146/annurev-ento-020117-043348.
- ↑ Jason A. Dunlop, David Penney, O. Erik Tetlie, Lyall I. Anderson. How many species of fossil arachnids are there?. „Journal of Arachnology”. 36 (2), s. 267-272, 2008. DOI: 10.1636/CH07-89.1.
- ↑ Camillo Cusimano, Bruno Massa, Michelangelo Morganti. Importance of meteorological variables for aeroplankton dispersal in an urban environment. „Italian Journal of Zoology”. 83 (2). s. 1-7. DOI: 10.1080/11250003.2016.1171915.
- ↑ P.A. Glick. The distribution of insects, spiders and mites in the air. „Technical Bulletin”. 673, 1939. U.S. Department of Agriculture.
- ↑ J.B.P.A. Lamarck: Systême des Animaux sans Vertébrés. Paris: Lamarck and Deterville, 1801.
- ↑ a b c Richard J. Howard, Gregory D. Edgecombe, David A. Legg, Davide Pisani, Jesus Lozano-Fernandez. Exploring the evolution and terrestrialization of scorpions (Arachnida: Scorpiones) with rocks and clocks. „Organisms Diversity & Evolution”. 19, s. 71–86, 2019.
- ↑ a b Zhi-Qiang Zhang, Phylum Arthropoda von Siebold, 184, „Zootaxa”, 3148, 2011 (Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness), s. 192–194 [dostęp 2020-01-02].
- ↑ Classification of Subclass Acari: Fundamentals of Applied Acarology. Springer, 2016, s. 63-71.Sprawdź autora:1.
- ↑ a b c Gonzalo Giribet, Gregory Edgecombe: The Invertebrate Tree of Life. Princeton University Press, 2020. ISBN 978-0-691-17025-1.
- ↑ a b c Wsiewołod Borysewicz Dubinin. New system of superclass Chelicerata. „Bull. Soc. Mosc. Erp. Nat.”. 62, s. 25-33, 1957.
- ↑ a b c d e Leendert van der Hammen. A new classification of Chelicerata. „Zool. Meded., Leiden”. 51, 1977.
- ↑ a b Jeffrey W. Shultz. Evolutionary morphology and phylogeny of Arachnida. „Cladistics”. 6 (1), s. 1–38, 1990. DOI: 10.1111/j.1096-0031.1990.tb00523.x.
- ↑ a b c Jesús A Ballesteros, Prashant P Sharma. A critical appraisal of the placement of Xiphosura (Chelicerata) with account of known sources of phylogenetic error. „Systematic Biology”, 2019. DOI: 10.1093/sysbio/syz011 (ang.).
- ↑ a b Almir R Pepato, Carlos E.F. da Rocha, Jason A Dunlop. Phylogenetic position of the acariform mites: sensitivity to homology assessment under total evidence. „BMC Evolutionary Biology”. 10 (235), 2010.
- ↑ Jerome C. Regier; Jeffrey W. Shultz; Andreas Zwick; April Hussey; Bernard Ball; Regina Wetzer; Joel W. Martin; Clifford W. Cunningham. Arthropod relationships revealed by phylogenomic analysis of nuclear protein-coding sequences. „Nature”. 463 (7284), s. 1079–1083, 2010. DOI: 10.1038/nature08742.
- ↑ Rehm, P.; Pick, C.; Borner, J.; Markl, J.; Burmester, T.. The diversity and evolution of chelicerate hemocyanins. „BMC Evolutionary Biology”. 12 (19), 2012.
- ↑ Sharma, P. P.; Kaluziak, S. T.; Pérez-Porro, A. R.; González, V. L.; Hormiga, G.; Wheeler, W. C.; Giribet, G.. Phylogenomic interrogation of Arachnida reveals systemic conflicts in phylogenetic signal. „Molecular Biology and Evolution”. 31, s. 2963–2984, 2014.
- ↑ Mirosława Dabert, Wojciech Witaliński, Andrzej Kaźmierski, Ziemowit Olszanowsk. Molecular phylogeny of acariform mites (Acari, Arachnida): Strong conflict between phylogenetic signal and long-branch attraction artifacts. „Molecular Phylogenetics and Evolution”. 56 (1), s. 222-41, 2010. DOI: 10.1016/j.ympev.2009.12.020.
- ↑ A.R. Pepato, P.B. Klimov. Origin and higher-level diversification of acariform mites – evidence from nuclear ribosomal genes, extensive taxon sampling, and secondary structure alignment. „BMC Evolutionary Biology”. 15, s. 178, 2015.
- ↑ Russell J. Garwood, Jason A. Dunlop. Three-dimensional reconstruction and the phylogeny of extinct chelicerate orders. „PeerJ”. 2 (e641), 2014. DOI: 10.7717/peerj.641.
- ↑ a b David C. Coleman, D. A. Crossley Jr., Paul F. Hendrix: Fundamentals of Soil Ecology. Wyd. 2. Elsevier Academic Press, 2004.
- ↑ Marek Żabka: Sieci pajęcze i unikalna właściwość przędzy. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 91. ISBN 978-83-01-17447-7.
- ↑ N. Ray: Lonely Planet. Cambodia. Lonely Planet Publications, 2002, s. 308. ISBN 978-1-74059-111-9.
- ↑ Matthew Forney. Scorpions for Breakfast and Snails for Dinner. „The New York Times”, 11-06-2008.
- ↑ a b Cheng, D.; Dattaro, J.A.; Yakobi, R.,: Scorpion Envenomation. W: Medscape [on-line]. [dostęp 2020-01-21].
- ↑ a b c d Francielle A. Cordeiro, Fernanda G. Amorim, Fernando A. P. Anjolette, Eliane C. Arantes. Arachnids of medical importance in Brazil: main active compounds present in scorpion and spider venoms and tick saliva. „J. Venom. Anim. Toxins Incl. Trop. Dis.”. 21, 2015. DOI: 10.1186/s40409-015-0028-5.
- ↑ J.H. Diaz. The Global Epidemiology, Syndromic Classification, Management, and Prevention of Spider Bites. „American Journal of Tropical Medicine and Hygiene”. 71 (2), s. 239–250, 2004. DOI: 10.4269/ajtmh.2004.71.2.0700239.
- ↑ Tanja Varl, Damjan Grenc, Rok Kostanjšek, Miran Brvar. Yellow sac spider (Cheiracanthium punctorium) bites in Slovenia: case series and review. „Wiener klinische Wochenschrift”. 129, s. 630–633, 2017.
- ↑ R. Vetter, S. Hillebrecht. On distinguishing two often-misidentified genera (Cupiennius, Phoneutria) (Araneae: Ctenidae) of large spiders found in Central and South American cargo shipments. „American Entomology”. 54 (2), s. 88–93, 2008.
- ↑ K. Novak. Spider venom helps hearts keep their rhythm. „Nature Medicine”. 7 (155), 2001. DOI: 10.1038/84588.
- ↑ R.J. Lewis, M.L. Garcia. Therapeutic potential of venom peptides. „Nature Reviews Drug Discovery”. 2 (10), s. 790–802, 2003. DOI: 10.1038/nrd1197.
- ↑ O. Bogin. Venom Peptides and their Mimetics as Potential Drugs. „Modulator”. 19, 2005.
- ↑ Andrade, E.; Villanova, F.; Borra, P.. Penile erection induced in vivo by a purified toxin from the Brazilian spider Phoneutria nigriventer. „British Journal of Urology International”. 102 (7), s. 835–837, 2008. DOI: 10.1111/j.1464-410X.2008.07762.x.
- ↑ a b Pir Tariq Shah, Farooq Ali, Noor-Ul-Huda, Sadia Qayyum, Shehzad Ahmed, Kashif Syed Haleem, Isfahan Tauseef, Mujaddad-ur-Rehman, Azam Hayat, Attiya Abdul Malik, Rahdia Ramzan, Ibrar Khan. April Scorpion venom: A poison or a medicine-mini review. „Indian Journal of Geo Marine Sciences”, s. 773-778, 2018. ISSN 47.
- ↑ Monique J. Windley, Volker Herzig, Sławomir A. Dziemborowicz, Margaret C. Hardy, Glenn F. King, and Graham M. Nicholson. Spider-Venom Peptides as Bioinsecticides. „Toxins (Basel)”. 4 (3), s. 191–227, 2012. DOI: 10.3390/toxins4030191.
- ↑ D.E. Sonenshine: Biology of ticks. New York: Oxford University Press, 2014. ISBN 978-0-19-974405-3.
- ↑ R. Gothe, K. Kunze, H. Hoogstraal. The mechanisms of pathogenicity in the tick paralyses. „Journal of Medical Entomology”. 16 (5), s. 357–369, 1979.
- ↑ B.F. Stone. Tick/host interactions for Ixodes holocyclus: role, effects, biosynthesis and nature of its allergenic oral secretions. „Experimental and Applied Acarology”. 7, s. 59–69, 1989. DOI: 10.1007/BF01200453.
- ↑ S.C. Barker. Ticks of Australia. The species that infest domestic animals and humans. „Zootaxa”. 3816, s. 1–144, 2014.
- ↑ H. Hoogstraal. Ticks and spirochetes. „Acta Tropica”. 36 (2), s. 133–136, 1979.
- ↑ Lars Lindquist, Olli Vapalahti. Seminar Tick-borne encephalitis. „The Lancet”. 371 (9627), s. 1861–1871, 2008. DOI: 10.1016/S0140-6736(08)60800-4.
- ↑ K.J. Ryan, C.G. Ray: Sherris Medical Microbiology. McGraw Hill., 2004, s. 488–490. ISBN 0-8385-8529-9.
- ↑ Jakub Jaroński, Rozmowa z profesorem Jerzym Woyke z dręczem pszczelim w tle, „Wolnopszczelarstwo” (1/2018), maj 2018, s. 8, ISSN 2544-9311.
- ↑ a b Krzysztof Solarz: Roztocze kurzowe. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 228. ISBN 978-83-01-17447-7.
- ↑ Gail De Vos: Tales, Rumors, and Gossip: Exploring Contemporary Folk Literature in Grades 7–12. Libraries Unlimited, 1996, s. 186. ISBN 978-1-56308-190-3.
- ↑ Jeremy Black, Anthony Green: Gods, Demons and Symbols of Ancient Mesopotamia: An Illustrated Dictionary. London: The British Museum Press, 1992, s. 182. ISBN 978-0-7141-1705-8.
- ↑ Gary A. Polis: The Biology of Scorpions. Stanford University Press, 1990, s. 462. ISBN 978-0-8047-1249-1.
- ↑ Joshua J. Mark: Serket Definition. W: Ancient History Encyclopedia [on-line]. [dostęp 2020-01-23].
- ↑ Byron Harries. The spinner and the poet: Arachne in Ovid's Metamorphoses. „The Cambridge Classical Journal”. 36, s. 64–82, 1990. DOI: 10.1017/S006867350000523X.
- ↑ Cynthia Stokes Brown: Big History. New York: The New Press, 2007, s. 167. ISBN 978-1-59558-196-9.
- ↑ Katherine Berrin, Larco Museum: The Spirit of Ancient Peru:Treasures from the Museo Arqueológico Rafael Larco Herrera. New York: Thames and Hudson, 1997.
- ↑ Harold Courlander: Harold Hopi Voices Recollections, Traditions, and Narratives of the Hopi Indians. University of New Mexico Press, 1982. ISBN 978-0-8263-0612-8.
- ↑ Jan Knappert: Pacific Mythology. London: HarperCollins, 1992. ISBN 1-85538-133-8.
- ↑ Sarah Bartlett: The mythology bible: the definitive guide to legendary tales. New York: Sterling, 2009, s. 176. ISBN 978-1402770029.
- ↑ Jürgen Wasim Frembgen. The scorpion in Muslim folklore. „Asian Folklore Studies”. 63 (1), s. 95–123, 2004.
- ↑ Güran Erbek: Kilim Catalogue No. 1. May Selçuk A.S., 1998.
- ↑ Jana Garai: The Book of Symbols. New York: Simon & Schuster, 1973. ISBN 978-0-671-21773-0.
- ↑ Donald Haase: The Greenwood Encyclopedia of Folktales and Fairy Tales. Santa Barbara, California: Greenwood Publishing Group, 2008, s. 31. ISBN 978-0-313-33441-2.
- ↑ Marie L. McLaughlin: The 'Wasna' (Pemmican Man) and the Unktomi (Spider). W: Myths and Legends of the Sioux. N.D. Bismarck (red.). Tumbleweed Press, 1974.
- ↑ 岩井宏實: 暮しの中の妖怪たち. 河出書房新社, 2000, s. 156, seria: 河出文庫. ISBN 978-4-309-47396-3.
Media użyte na tej stronie
Redirect arrow, to be used in redirected articles in Wikipedias written from left to right. Without text.
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
- Tegeocranus hericius (Michael) = Protocepheus hericius (Michael, 1887), a type of mite
- Tegeocranus latus (Koch) = Cepheus latus C.L.Koch, 1836, mites
- Tegeocranus cepheiformis (Nicolet) = Cepheus cepheiformis (Nicolet, 1855)
- Leiosoma palmicinctum (Michael) = Tereticepheus palmicinctum (Michael, 1880), a mite
- Phrynus reniformis (Olivier) = Phrynichus reniformis (Linnaeus, 1758) / Phrynichus ceylonicus (C.L.Koch, 1843), a tailless whipscorpion
- Arkys cordiformis (Walckenaer) = Gnolus cordiformis (Nicolet, 1849), an orb-weaver spider
- Gasteracantha cancriformis (Latreille) = Gasteracantha cancriformis (Linnaeus, 1758), orb-weaver spider
- Gasteracantha acrosomoïdes (Koch) = Acrosomoides acrosomoides (O. P.-Cambridge, 1879), a type of orb-weaver spider
- Gasteracantha geminata (Koch) = Gasteracantha geminata (Fabricius, 1798)
- Gasteracantha arcuata (Koch) = Macracantha arcuata (Fabricius, 1793)
- Acrosoma hexacanthum (Hahn) = Gasteracantha cancriformis (Linnaeus, 1758)
- Acrosoma spinosum (Koch) = Micrathena schreibersi (Perty, 1833)
- Acrosoma bifurcatum (Hahn) = Micrathena furcata (Hahn, 1822)
- Oxyopes variegatus (Hahn) (non Latreille, 1806: preoccupied) = Oxyopes ramosus (Martini & Goeze, in Lister, 1778)
- Epeira diadema (Linné) = Araneus diadematus Clerck, 1757
German:
1: Dornkronen-Moosmilbe (Nymphe). 0,6 mm. Europa.
2: Stachelkranz-Moosmilbe (Nymphe). 0,9 mm. Europa.
3: Gefiederte Moosmilbe (Nymphe). 0,62 mm. Europa.
4: Blattgürtel-Moosmilbe (Nymphe). 1,0 mm. Europa.
5: Nierenförmiger Geißelskorpion. Natürliche Größe. Ostindien.
6: Herzförmige Arkysspinne. 2mal vergrößert. Amerika.
7: Krabbenförmige Stachelspinne. 3mal vergrößert. Brasilien.
8: Dreieckige Stachelspinne. 5mal vergrößert. Madagaskar.
9: Doppeldornige Stachelspinne. 3mal vergrößert. Ostindien.
10: Bogendornige Stachelspinne. 2mal vergrößert. Java.
11: Sechsspitzige Stachelspinne. 4mal vergrößert. Brasilien.
12: Dickdornige Stachelspinne. 2mal vergrößert. Südamerika.
13: Zweigabelige Stachelspinne. 4mal vergrößert. Brasilien.
14: Bunte Springspinne. 3mal vergrößert. Deutschland.
15: Fromme Kreuzspinne. 3mal vergrößert. Deutschland.
Full text description (in German):
Autor: Cristina Menta, Licencja: CC BY 3.0
Pseudoscorpion, a typical organism that live in the wood litter
Autor: Jerzy Opioła, Licencja: CC BY-SA 4.0
Phyllocoptes eupadi on leaf on Padus avium.Location: Poland, Kraków, Wzgórza Tynieckie
Autor: Original uploader was Braboowi at en.wikipedia, Licencja: CC-BY-SA-3.0
Sun spider/wind scorpion. Just over 3 inches long (including legs). 9.10.06, Mesa, Az.
Weibchen von Hygrobates fluviatilis
Autor: Bruce Marlin, Licencja: CC BY-SA 2.5
jpeg image, male Hadrobunus grandis, Harvestman: Order Opiliones, Family Sclerosomatidae
Autor: Greg Hume, Licencja: CC BY-SA 3.0
Amblypygi - photo taken at the Cincinnati Zoo and Biological Garden by Greg Hume
De lichaamsbouw van een schorpioen:
Ogen
Kopaanhangsels: Pedipalp, Cheliceer
Borststuk en poten: Tarsus, Tibia, Femur, Coxa
Autor:
- Spider_internal_anatomy.png: John Henry Comstock
- derivative work: Pbroks13 (Ryan Wilson) (talk)
Schemat przekroju strzałkowego ukazującego anatomię samicy pająka dwupłucnego.
Autor: Pristurus, Licencja: CC BY-SA 3.0
Neriene radiata in copula. Taken near Marburg, Hesse, Germany.
(c) D. E. Hill, CC BY 3.0
Diagram of the visual fields of the spider as viewed from above
Diagram of spider book lungs. (1) lung slit, (2) space filled with blood, (3) leaves of the book lung.
Fusion121, took picture myself of captive scorpion
Autor: Acrocynus, Licencja: CC BY-SA 3.0
Mastigoproctus giganteus, Uropygi (Vinegarroon or whip scorpion) female with egg sac
Autor: Pattych, Licencja: CC-BY-SA-3.0
Močická keramika, která se datuje zhruba do roku 300 n. l., zobrazující pavouka
Three kinds of chelicerae
Section through the lateral eye of Euscorpius italicus.
lens, Cuticular lens.
nerv. c, Retinal cells (nerve-end cells).
rhabd, Rhabdomes.
nerv. f, Nerve fibres of the optic nerve.
(After Lankester and Bourne from Parker and Habwell’s Text book of Zoology, Macmillan & Co.)
Autor: Autor nie został podany w rozpoznawalny automatycznie sposób. Założono, że to Phyzome (w oparciu o szablon praw autorskich)., Licencja: CC-BY-SA-3.0
Autor: Navaho, Licencja: CC BY-SA 4.0
Zdjęcie kleszcza wbitego w ludzką skórę.
Autor: Mat Connolley (Matnkat), Licencja: CC BY 2.5
Fried spiders for sale at the market in Skuon, Cambodia
Central Nervous System of Phrynus sp.. br=brain; supraoesophageal ganglion; ce=cauda equina, opistosomal nerve; le=lateral eyes; me=median eyes; nch=cheliceral nerve; np1-np4=nerves of the first to the fourth pairs of legs; npd=pedipalp nerve; seg=suboesophageal ganglion.
Autor: SpiderMum, Licencja: CC BY-SA 4.0
Female spider (Araneus diadematus) defecating. Łódź, Poland, September 2014.
Autor: Gilles San Martin from Namur, Belgium, Licencja: CC BY-SA 2.0
House dust mites (Dermatophagoides pteronyssinus). More information here : news.bbc.co.uk/earth/hi/earth_news/newsid_9290000/9290068...
Scale : mite length = 0.3 mm
Technical settings :
- focus stack of 67 images- microscope objective (Nikon achromatic 10x 160/0.25) on bellow
Life stages of Chaetodactylus krombeini (Astigmata); male not shown; individual LT-SEM photos (excluding phoretic deutonymph photo) by Ron Ochoa and Gary Bauchan, USDA-ARS.
Autor: Chiswick Chap, Licencja: CC BY-SA 4.0
Scorpion kilim motif, for protection from them