Petrelek modry
| Halobaena caerulea[1] | |||
| (Gmelin, 1789) | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | petrelek modry | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[2] | |||
 | |||
| Zasięg występowania | |||
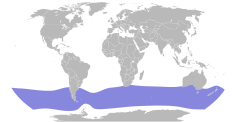 | |||
Petrelek modry[3] (Halobaena caerulea) – gatunek średniej wielkości ptaka z rodziny burzykowatych (Procellariidae), jedyny przedstawiciel rodzaju Halobaena. Gniazduje na subantarktycznych wyspach w południowej części Oceanu Atlantyckiego i Indyjskiego oraz na wyspie Macquarie, która znajduje się na skraju Oceanu Spokojnego. Gniazduje na wyspach między równoleżnikami 40° i 56°S, poza okresem lęgowym dociera dalej na północ i południe (w tym na Ocean Południowy). Nie jest zagrożony wyginięciem.
Taksonomia
Po raz pierwszy zgodnie z zasadami nazewnictwa binominalnego gatunek ten opisał Johann Friedrich Gmelin w 1789 w 13. edycji Systema Naturae. Holotyp pochodził z nieokreślonego miejsca na Oceanie Południowym. Autor nadał gatunkowi nazwę Procellaria caerulea[4].
Obecnie (2022) Międzynarodowy Komitet Ornitologiczny umieszcza petrelka modrego w monotypowym rodzaju Halobaena i nie wyróżnia podgatunków[5], podobnie jak inne autorytety[6][7][8]. Nazwę rodzajową Halobaena można przetłumaczyć jako „krocząca przez morze”; pochodzi od greckich słów ἅλς hals – „morze” oraz βάσκω baino – „iść”, „kroczyć”[9].
Filogeneza
W 2004 ukazały się wyniki badania nad pokrewieństwem w obrębie rodziny burzykowatych (Procellariidae), podczas których wykorzystano sekwencje genu cytochromu b. Według nich petrelek modry stanowi grupę siostrzaną wobec rodzaju Pachyptila. Na drzewie filogenetycznym utworzonym przy użyciu metody największej oszczędności (ang. maximum parsimony) obydwa te taksony miały być blisko spokrewnione z Procellaria. Na innym, wykorzystującym metodę największej wiarygodności (ang. maximum likelihood), okazały się być incertae sedis. Nie udało się wówczas ustalić dobrze pokrewieństwa i kilku innych taksonów[10]. W 2021 opublikowano wyniki badań z użyciem sekwencji wielu genów. Inaczej niż w tych opartych jedynie o gen cytochromu b, te wykazały bliskie pokrewieństwo kladu Halobaena+Pachyptila z Pelecanoides. Pozycję petrelka modrego w obrębie rodziny przedstawia poniższy kladogram będący uproszczonym fragmentem drzewa filogenetycznego całej rodziny burzykowatych[11]:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
W bazie timetree.org w kwietniu 2022 dostępne było tylko jedno badanie[12], którego wyniki określałyby moment oddzielenia się Halobaena od Pachyptila. Według Jetz et al. (2012) miało to miejsce blisko 17,2 mln lat temu[13].
Badanie sekwencji genu cytochromu b oraz mikrosatelitów z 18 loci wykazało brak wyraźnej struktury genetycznej w populacji petrelków modrych. Nie znaleziono jej również u petrelków antarktycznych (Pachyptila desolata) i cienkodziobych (P. belcheri). Zimowiska dwóch subpopulacji petrelka antarktycznego dzieli około 5 tysięcy km, natomiast zimowiska subpopulacji petrelków cienkodziobych i modrych w znacznej części pokrywają się. Brak struktury genetycznej populacji u wszystkich trzech sugeruje, że o jej wytworzeniu się nie decyduje odległość dzieląca subpopulacje[14].
Morfologia
Długość ciała petrelków modrych wynosi 26–32 cm, rozpiętość skrzydeł: 62–71 cm. Masa ciała wynosi około 200 g[15]; przykładowo u 215 osobników z Wyspy Mariona: 163–251 g (średnio 202 ± 17,5 g)[16], u 103 osobników z Wysp Kerguelena: 154–268 g (średnio 198 ± 20 g)[17]. Zmienia się w zależności od kondycji ptaka. Wysiadujące petrelki modre zmieniają swojego partnera zwykle co 8–12 dni. Same wyruszają na morze i zanim wrócą, ich masa ciała może zwiększyć się o blisko 29 g do 63 g – wraz z postępem inkubacji zwiększa się przyrost masy ciała, aż do około 6 g na dobę. Przeciętna masa ciała na początku i na końcu zmiany jest znacząco odmienna na różnych etapach inkubacji[18]. Średnia masa ciała u wymytych na wybrzeża Wiktorii martwych osobników to 128,8 g (n=44, samce i samice)[19].
| Pochodzenie | Płeć | n | Dł. skrzydła | n | Dł. dzioba | n | Dł. ogona | n | Dł. skoku | Źródło |
|---|---|---|---|---|---|---|---|---|---|---|
| Macquarie | nieokreślona | 133 | 205–228 (216,4 ± 0,45) | 133 | 21,9–29,1 (26,1 ± 0,26) | 133 | 81–97 (88,2 ± 0,35) | 133 | 29,5–35,0 (32,6 ± 0,09) | Brothers (1984)[20] |
| Wyspy Księcia Edwarda | 75 | 198–233 (217,2 ± 5,8) | 75 | 22–29,5 (26,6 ± 1,3) | 75 | 88–99 (91,6 ± 3,0) | 75 | 31,3–37,1 (34,5 ± 1,2) | Berruti (w HANZAB, 1990)[15] | |
| Wyspy Księcia Edwarda (Wyspa Mariona) | 175 | 205–228 (217 ± 4,2) | 71 | 25,4–29,4 (27,4 ± 0,9) | 50 | 81,3–97,5 (89,2 ± 3,4) | 50 | 30,3–36,5 (34,0 ± 1,3) | Fugler et al. (1987)[16] | |
| Wiktoria (martwe osobniki wymyte na brzeg) | samce | 19 | 219,4 ± 5,17 | 19 | 27,0 ± 0,88 | 19 | 87,7 ± 3,87 | 19 | 34,3 ± 0,95 | Brown et al. (1986)[19] |
| samice | 22 | 220,4 ± 4,52 | 22 | 26,7 ± 0,75 | 22 | 89,4 ± 4,38 | 22 | 34,2 ± 0,86 |
Petrelek modry jest stosunkowo niewielkim przedstawicielem rodziny, który rozmiarami ciała, sylwetką i proporcjami przypomina petrelki z rodzaju Pachyptila. Cechują go jednak nieco dłuższe i węższe skrzydła, których zewnętrzna część zazwyczaj wydaje się być dłuższa, węższa i ostrzej zakończona[15].
Upierzenie petrelków modrych z wierzchu jest głównie jasne, niebieskoszare, z rozciągającymi się przez wierzch skrzydeł paskami układającymi się w częściowo przerwane „M”. Czarna czapeczka jest wyraźnie widoczna, podobnie jak białe czoło. Ogon prostokątnie zakończony, szary z wąskim popielatym paskiem przedkońcowym oraz białym paskiem końcowym, unikatowym wśród rurkonosych. Spód ciała jest głównie biały, wyróżnia się jedynie niedomknięta ciemna obroża zachodząca na boki piersi. W upierzeniu nie występuje dymorfizm płciowy, nie ma również różnic między dorosłymi i młodymi osobnikami. Sezonowa zmienność upierzenia widoczna jest jedynie w jego zużyciu[15]. Zmienność geograficzna przejawia się w budowie dzioba: petrelki modre z Wysp Kerguelena mają dłuższe i węższe dzioby niż te z dwóch pozostałych badanych populacji. Podobną zależność zaobserwowano u petrelków antarktycznych. Możliwym wyjaśnieniem jest zmienność w składzie pożywienia między populacjami z różnych miejsc gniazdowania[21]. Tęczówka jest ciemnobrązowa, niemal czarna. Dziób ma barwę ciemnoszarą, jedynie jego boczna część zdaje się być nieco fioletowa. Inne opisy mówią o oliwkowoczarnym kolorze z jasną niebieskawą krawędzią tnącą w bocznej części oraz niebieskawej lub różowawej spodniej części nasady żuchwy. Skok oraz wewnętrzne palce są jasnoniebieskie, zewnętrzne palce i dalsza od ciała część błony pławnej – ciemnobrązowe, a pozostała część błony pławnej – różowobrązowa[15].
Pierzenie
Petrelki modre przechodzą pierzenie po odbyciu lęgów, kiedy wyruszą już na morze; w przypadku tych z Wysp Kerguelena zwykle rozpoczyna się w 1. lub 2. tygodniu lutego[22]. Podawany czas jego trwania to 83–131 dni (w populacji z Wysp Księcia Edwarda)[16] i około 10 tygodni (w populacji z Wysp Kerguelena[22]). Pierzenie w obrębie skrzydeł przebiega intensywnie, jednocześnie wymieniane jest 7 lub 8 wewnętrznych lotek I rzędu, odpowiadające im pokrywy I-rzędowe oraz wszystkie pokrywy II-rzędowe większe[23].
Zasięg występowania
Miejsca gniazdowania
Petrelki modre gniazdują głównie na wyspach u wybrzeży południowej Ameryki Południowej położonych po obydwu stronach strefy konwergencji antarktycznej[24]. Wszystkie znane dawniej kolonie mieszczą się między równoleżnikami 47°S a 56–58°S[15][24]. W 2014 odnaleziona została kolonia na wyspie Gough, na szerokości 40°S – około 700 km na północ od dotychczasowej północnej granicy zasięgu gniazdowania. Prawdopodobnie nie powstała wskutek zajmowania nowych terenów, a została przeoczona podczas prac terenowych[24]. Pozostałe kolonie petrelków modrych mieszczą się na pojedynczych wyspach u wybrzeża Chile oraz pięciu grupach wysp lub wyspach. Wszystkie znane miejsca gniazdowania obejmują[15] (dokładne dane dotyczące liczebności znajdują się w sekcji „Status, zagrożenia i ochrona”):
- wyspy u wybrzeży Chile, między innymi Wyspy Diego Ramírez, położone około 110 km na południowy zachód od przylądka Horn. W 2002 zamieszkiwała je największa populacja petrelków modrych, skupiająca około 80% wszystkich osobników tego gatunku[25]. Petrelki modre gniazdują również w archipelagach Wollaston i Hermite[7];
- Wyspy Kerguelena (48°28’–50°S 68°28’–70°35’E). Według szacunkowych danych z 2002 (a opublikowanych w 2006), dotyczących głównie wyspy Mayes, na Wyspach Kerguelena występuje druga pod względem liczebności populacja petrelków modrych[26];
- Wyspy Księcia Edwarda (46°S 37°E) należące do Południowej Afryki. Szacunkowe dane z 2012 (opublikowane w 2017) dotyczące tylko jednej z dwóch wysp (Wyspy Mariona) wskazują, że Wyspy Księcia Edwarda zamieszkuje trzecia pod względem liczebności populacja petrelków modrych[27]. Poprzednie badania nad rozmieszczeniem tych ptaków na Wyspie Mariona prowadzono w latach 80. XX wieku[28] i z danych uzyskanych w 2012 wynika, że w pewnym stopniu zwiększyły swój obszar występowania na wyspie[27];
- Georgia Południowa i Sandwich Południowy; lokalna populacja jest 4. lub 5. najmniejszą ze wszystkich (bez uwzględniania wyspy Gough w porównaniu)[29];
- Wyspy Crozeta; część Francuskich Terytoriów Południowych. Tamtejsza populacja jest 4. lub 5. najmniejszą; ponieważ szacowana liczba par gniazdujących na Georgii Południowej mieści się w dość szerokim przedziale podawanym dla Wysp Crozeta, trudno ocenić, gdzie występuje mniej petrelków modrych. Na Île de la Possession zostały wytępione przez szczury[29];
- Gough (40°S 10°W)[24];
- Macquarie (54°S 158°E), administracyjnie część Tasmanii. Tamtejsza populacja jest najmniej liczna[29]. Nie zajmowała Macquarie cały czas – w 1999 ponownie na wyspie pojawiła się kolonia petrelków modrych, wcześniej gniazdujących niedaleko na przybrzeżnym Green Gorge[30].
Zasięg na morzu i przygodne obserwacje
Niektóre petrelki modre pozostają w okolicy kolonii cały rok. Te wędrujące po oceanie najdalej na południe odnotowywano do strefy występowania paku lodowego[15]. Osobniki w trakcie pierzenia, które prawdopodobnie gniazdowały na Wyspach Diego Ramírez, obserwowano na szerokości 67–71°S i na długości 78–119°W[23]. Petrelki modre gniazdujące na Wyspach Kerguelena i Georgii Południowej podczas pierzenia przebywają na szerokościach 55–65°S i długościach od 20°W do 30°E[23][22]. Najdalej na północ występują głównie do szerokości 30°S, jednak zimą u wybrzeży Peru docierają z Prądem Peruwiańskim w okolice równoleżnika 20°S[15].
Liczba obserwacji na wodach południowej Australii i Nowej Zelandii zaczęła wzrastać w 2. połowie XX wieku i współcześnie prawdopodobnie petrelki modre pojawiają się tam regularnie, być może nawet często[15]. Według innego źródła na nowozelandzkich morzach ptaki te są widywane rzadko, jednak pod koniec zimy i wiosną na brzeg wyrzucane bywają martwe osobniki w dość dużej liczbie. Szczególny był przypadek wymycia na plaże Zatoki Obfitości 13 petrelków modrych pokrytych paliwem w październiku 2011. Doszło wówczas do wycieku paliwa z kontenerowca MV Rena, a odnalezienie petrelków nim oblepionych świadczy o tym, że docierają na wody przybrzeżne Nowej Zelandii[29].
Pożywienie
Sposoby zdobywania pożywienia
Prawdopodobnie głównym sposobem pozyskiwania zdobyczy u petrelków modrych jest łapanie jej tuż spod powierzchni, zarówno w locie, jak i podczas unoszenia się na wodzie. Rzadziej nurkują na kilka sekund[15]. W badaniu prowadzonym na kilku gatunkach gniazdujących na Georgii Południowej średnia głębokość nurkowania petrelków modrych wyniosła 1,85 ± 0,29 m. Na bardzo podobną głębokość przeciętnie nurkowały nurce czarnoskrzydłe. Petrelki antarktyczne nurkowały płycej, natomiast nurce małe – znacznie głębiej od petrelków modrych[31]. Obserwowano petrelki modre podążające za statkami, a czasem za żerującymi delfińcami płaszczowymi (Lissodelphis peronii)[15].
W okresie karmienia młodych petrelki modre wyruszają na morze na zmianę na krótki i długi okres; wśród osobników z Wysp Kerguelena te trwały średnio 1,8 dnia (ogółem 1–4 dni[32][33]) i 7,2 dnia (ogółem 5–8 dni). Tę strategię u petrelków modrych opisano po raz pierwszy w 1994 i nie odnotowano opuszczania nor na „średni” okres. Mimo że po krótszym okresie spędzonym na morzu pisklęta otrzymywały z pożywienia więcej energii w przeliczeniu na czas nieobecności rodzica, to dłuższe pobyty na morzu okazywały się być korzystne. Zasoby energetyczne zgromadzone podczas dłuższych wypraw pozwalają dorosłym petrelkom modrym na odbywanie tych krótszych[32], podczas których zużywają od 1,5 do 2,2 razy więcej energii na jednostkę czasu[33]. Dzięki połączeniu ich obydwu zwiększa się częstotliwość karmienia piskląt: ze średnio 0,28 na 0,43 porcji pokarmu na dobę[32].
Skład pożywienia i jego zmienność
Petrelki modre żywią się głównie morskimi skorupiakami, rybami i głowonogami, okazjonalnie łapią też owady[15] i inną zdobycz. Jej procentowy udział zmienia się w poszczególnych latach i zależnie od miejsca występowania. Zwykle jednak większość biomasy (od co najmniej 50% do ponad 90%) stanowią skorupiaki, drugi z kolei udział mają w niej ryby, a głowonogi stanowią od niecałego procenta do kilkunastu procent[34][35][32][17]. W wyjątkowej sytuacji w diecie mogą niemal nie występować ryby, jednak jest to spowodowane anomaliami klimatycznymi i ma wyraźnie negatywny wpływ na sukces lęgowy[36]. Zazwyczaj obecność oleju (wytwarzanego przez niektóre rurkonose) oraz kryla antarktycznego (Euphausia superba) w treści żołądka świadczy o odbyciu przez petrelki modre dłuższej wyprawy na morze[36].
W poniższej tabeli przedstawiono w uproszczony sposób skład pokarmu petrelków modrych w badaniach prowadzonych w różnym miejscu i czasie. Pod tabelą znajdują się między innymi informacje o udziale w biomasie oleju oraz niezidentyfikowanej materii, a także udziale konkretnych grup organizmów.
| Źródło | Miejsce i okres prowadzenia badań | Liczba próbek | Wiek osobników | Podgrupa | Udział poszczególnych grup organizmów (% świeżej biomasy) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Skorupiaki | Ryby | Głowonogi | Owady | Pozostałe | |||||||
| Obunogi | Szczętki | Głębinowe skorupiaki | |||||||||
| Prince (1980)[34] | Georgia Południowa; XII–III | 156 | — | — | 91,5 | 7,8 | 0,7 | — | — | ||
| Steele i Klages (1986)[35] | Wyspa Mariona; głównie XII–I | 49 | 46 dorosłych, 3 pisklęta | 59,5 | 21,2 | 15,7 | 3,6 | — | |||
| Chaurand i Weimerskirch (1994)[32] | Wyspy Kerguelena | 17 | starsze pisklęta | ST | 27 | 34 | 0 | 14 | 3 | — | |
| LT | 5 | 9 | 12 | 25 | 1 | ||||||
| Ridoux (1994)[37] | Wyspy Crozeta | 33 | dorosłe | — | 60 | 11 | 27 | — | |||
| Cherel et al. (2002)[17] | Wyspy Kerguelena, 3 sezony lęgowe | 105 | dorosłe (nie uwzględniono 333 próbek od piskląt) | S1 | 66,5 | 28,9 | 4,0 | — | 0,6 | ||
| S2 | 52,0 | 44,6 | 3,2 | 0,2 | |||||||
| S3 | 67,7 | 32,0 | 0,2 | 0,1 | |||||||
| razem | 61,4 | 25,8 | 2,5 | 0,3 | |||||||
| Connan et al. (2008)[36] | Wyspy Kerguelena, 1996 i 2000–2002 | 118 | dorosłe | — | 61 | 36 | 3 | — | |||
- Prince (1980): 156 próbek zebranych od grudnia do marca, czyli głównie w okresie lęgowym, na Georgii Południowej. Olej – 38,6%; niezidentyfikowany pokarm – 33,4%; zidentyfikowany pokarm – 28%. Główną zdobycz stanowiły skorupiaki – 91,5%, pozostałą zaś ryby (7,8%) i głowonogi (0,7%). Wśród skorupiaków dominował kryl antarktyczny – 81,9% biomasy, po nim najczęstsze były Thysanoessa macrura (4,0%; podobnie jak kryl należą do Euphausiidae), krewetki Acanthephyra (4,3%), Antarctomysis maxima (3,5%; Mysidae), Hyperoche medusarum (1,9%; Hyperiidae), Calanoides acutus (1,4%; Calanidae). Ryb nie dało się zidentyfikować ze względu na strawienie większości z nich. Głowonóg prawdopodobnie należał do Psychroteuthis[34].
- Steele i Klages (1986): próbki od 49 osobników z Wyspy Mariona (Wyspy Księcia Edwarda), w tym 3 piskląt, zebrane w okresie lęgowym, w większości w grudniu i styczniu. Zidentyfikowaną zdobycz stanowiły (wartości podane wagowo): skorupiaki – 59,5%, ryby – 21,2%, głowonogi – 15,7%, owady – 3,6%; jedna próbka zawierała też mięczaka[35].

- Chaurand i Weimerskirch (1994): 17 próbek od starszych piskląt z Wysp Kerguelena pozyskanych tuż po ich na karmieniu; według założenia autorów odzwierciedlają skład pokarmu młodszych piskląt, ale pozbawienie ich nie niesie już podobnego ryzyka. Skład zawartości żołądka podano osobno dla krótkich i dłuższych wypraw na morze. Zawartą biomasę podzielono na 7 kategorii: 5 grup organizmów oraz olej i niezidentyfikowaną zdobycz. Pod względem wagowym zawartość żołądka po krótkiej i długiej wyprawie stanowiły odpowiednio: obunogi – 27% i 5%; szczętki – 34% i 9%; głębinowe skorupiaki – 0% i 12%; ryby świetlikowate (Myctophidae) – 14% i 25%; kałamarnice – 3% i 1%; olej – 4% i 16%; niezidentyfikowana treść – 17% i 32%[32].
- Ridoux (1994): Zawartość żołądków 33 osobników pozyskana w styczniu, kiedy dorosłe osobniki wracały do kolonii. Około 60% (pod względem wagowym) stanowiły skorupiaki o rozmiarze pośrednim między nektonem a planktonem. Kałamarnice odpowiadały za 27% biomasy, a ryby – 11%[37].
- Cherel et al. (2002): 333 próbki pokarmu dla piskląt oraz 105 próbek pokarmu dorosłych osobników zbieranych przez 3 sezony lęgowe, Wyspy Kerguelena. W pożywieniu dorosłych osobników skorupiaki odpowiadały za 61,4%, ryby – 25,8%, głowonogi – 2,5%, a pozostała zdobycz (głównie osłonice Salpa thompsoni) – 0,3% świeżej masy[17].
- Connan et al. (2008): 118 próbek od 118 osobników z Wysp Kerguelena zebranych w latach 1996 i 2000–2002. Po podzieleniu ich na 8 kategorii (4 różne lata oraz długa lub krótka wyprawa) tylko w jednej dominowały ryby, w pozostałych większość biomasy tworzyły skorupiaki (w 4 przypadkach był to udział powyżej 75%). Wśród ryb najważniejsze były świetlikowate. Autorzy podali skład biomasy w formie wykresów oraz odsetka świeżej masy i odtworzonej: skorupiaki stanowiły 61% i 37%, ryby – 36% i 57%, a kałamarnice – 3% i 2%. Dokładniej rozpisany został skład zdobyczy pod względem liczbowym[36].
Zapotrzebowanie pokarmowe
Weimerskich et al. (2003) określili potrzeby i wydatki energetyczne dorosłych petrelków modrych w okresie karmienia młodych osobno dla krótszych i dłuższych pobytów na morzu (dalej: ST i LT). Dzienne zapotrzebowanie kaloryczne z uwzględnieniem potrzeb pisklęcia wyniosło przeciętnie 422 kJ dla ST i 322 kJ dla LT. Dla własnych potrzeb było to odpowiednio 288 kJ i 257 kJ dziennie. Kaloryczność zdobyczy wynosiła blisko 490 kcal/100 g. ST wiąże się z większym kosztem energetycznym, który w znacznej części pokrywają zgromadzone w organizmie zasoby (co przejawia się w spadku masy ciała). Dzięki temu wartość energetyczna posiłku, który otrzymuje pisklę, w przeliczeniu na dobę jest około dwukrotnie wyższa po ST niż LT[33].
Co najmniej do 2008 roku nie poznano dokładnie składu pożywienia, które dorosłe petrelki modre pozyskują podczas LT wyłącznie na potrzeby własne. Na ogólniejszym poziomie pozwoliło go ustalić zbadanie składu chemicznego oleju w żołądku. Ten gromadzony jest tylko podczas LT, a tworzące go lipidy pochodzą z pokarmu pozyskanego przed tym dla piskląt. Ponad 90% tworzyły triacyloglicerole (TG), estry woskowe (WE) i dialkiloglicerole (DAGE; przeciętnie najmniejszy odsetek we wszystkich 4 latach). Lipidy należące do 5 innych grup albo były niekiedy nieobecne, albo obecne w śladowych ilościach (<3% oleju w żołądku). Wyniki opublikowane w 2008 dotyczyły osobników z Wysp Kerguelena[36]. Wcześniej, w 1976, TG i WE okazały się tworzyć większość oleju w żołądku petrelków modrych z Georgii Południowej[38]. TG i WE pochodzą głównie od ryb z rodziny świetlikowatych. DAGE są stosunkowo rzadkie wśród potencjalnej zdobyczy; ich jedynym poznanym źródłem w Oceanie Południowym mogą być kałamarnice (oprócz nich DAGE występują tylko u niektórych ślimaków)[36].
U Ridoux (1994) średnia masa zwróconych próbek wyniosła 9 ± 6 g[37]. Średnia masa zawartości żołądka po dłuższej wyprawie na morze w badaniu Connana i innych (2008) w poszczególnych latach: od 15,3 ± 6,5 g do 24,3 ± 5,1 g. 49 próbek pochodzących z krótszych wypraw ważyło średnio 14 g (w różnych latach od 8,8 ± 2,3 g do 21,1 ± 5,2 g[36]. Podczas badań, jakie prowadzili Chaurand i Weimerskirch (1994) na populacji z Wysp Kerguelena, ilość pokarmu dostarczanego jednorazowo pisklęciu wynosiła 31–83 g, średnio 62,1 ± 11,1 g (n = 131). Jest to około 36% masy ciała dorosłego osobnika (bez pokarmu dla młodego)[32].
Głos
Do lat 90. XX wieku głos petrelka modrego poznano głównie z doniesień dwóch autorów. Wówczas nie było też wiadomo o różnicach międzyosobniczych, między płciami lub zależnych od miejsca występowania. Na morzu petrelki modre przeważnie milczą. W koloniach są głośne, wołają zarówno z powietrza, jak i nor. Dokładniej opisano kilka odgłosów. Wiadomo o podobnym do gołębiego gruchaniu, rzekomo podobnym do głosu innych petrelków. W norach petrelki modre odzywają się głośnym ćwierkaniem[15].
U burzykowatych wszystkie odgłosy są wrodzone i w przeciwieństwie do wróblowych nie uczą się nowych w ciągu życia. Ich różnorodności i możliwości dopasowywania do różnych sytuacji długo jednak nie doceniano. U samców petrelków modrych, które jeszcze nie znalazły partnerki, występują 3 rodzaje odgłosów. Pierwszy to dźwięki wydawane spontanicznie, bez konkretnego odbiorcy w pobliżu. Drugie skierowane są do samic, trzecie – do samców. Gémard et al. (2021) postawili dwie hipotezy wyjaśniające możliwe różnice między nimi. Według pierwszej zachowana jest ogólna struktura odgłosu, a poszczególne trzy kategorie odróżniają dwie struktury wskazujące na motywacje osobnika. Kolejna hipoteza dotyczy zmienności parametrów odgłosów kierowanych do innych samców: miałyby wskazywać na agresywne lub nieagresywne zamiary, stąd byłyby podobne u samców z partnerką lub bez partnerki. Uzyskano dowody na poparcie obydwu tych hipotez[39].
Ekologia i zachowanie
Preferencje środowiskowe
Petrelki modre występują na morzach strefy subantarktycznej i antarktycznej. Zwykle przebywają nad wodami o temperaturze powierzchni od –2 do 2 °C. Z zimnymi prądami docierają jednak na północ do szerokości około 30°S, a na południe – do strefy występowania paku lodowego. Preferują otwarte wody i starają się unikać pływającego lodu, zbliżają się jedynie do jego krawędzi. Żerują u podstaw gór lodowych. W większej liczbie zbierają się w miejscach występowania ławic kryla blisko powierzchni, chociaż w strefie konwergencji antarktycznej wykazują niewielkie zainteresowanie nimi. Chociaż przeważnie przebywają na morzu, zdarza im się żerować w strefie przybrzeżnej podczas złej pogody – na Wyspach Kerguelena były obserwowane w strefie występowania wielkomorszcza (Macrocystis) oraz na częściowo osłoniętych odcinkach wybrzeża. Petrelki modre mogą pojawiać się w głębi lądu przy silnych wiatrach[15]. Temperatura wody jest najważniejszym czynnikiem wpływającym na rozmieszczenie petrelków modrych, antarktycznych i cienkodziobych. W przypadku petrelka modrego okazała się jedynym istotnym parametrem – inaczej niż u antarktycznych i cienkodziobych nie miało znaczenie stężenie chlorofilu wraz z zasoleniem ani minimalne zachmurzenie (ważne dla petrelków cienkodziobych). Dzięki prowadzonym na Wyspach Kerguelena badaniom z użyciem nadajników ustalono, że petrelki antarktyczne preferują wody o temperaturze powierzchni 10,1–17,5 °C, cienkodziobe: −0,8–5,4 °C, a modre: −1,2–3,0 °C. Dzięki temu przedstawiciele tych gatunków przebywają na morzu na różnych szerokościach geograficznych, nawet gdy gniazdują w jednym miejscu[40]. Na zajmowanie odmiennych nisz ekologicznych wskazują nie tylko lokalizacje z nadajników, ale i proporcje izotopów δ13C oraz δ15C w tkankach[41]. Podczas pierzenia petrelki modre często przesiadują w mocno skupionych grupach na wodzie o temperaturze −0,7–0,9 °C na granicy pływającego lodu[23].
Tereny lęgowe petrelków modrych znajdują się na nizinnych częściach wysp, do około 500 m n.p.m., oraz na przybrzeżnych wysepkach i skałach. Ich gniazda umieszczone są w szczelinach skalnych lub norach wykopanych w suchym podłożu pokrytym niską roślinnością, tworzoną głównie przez rośliny z rodzajów: kotula (Cotula), kolobant (Colobanthus), acena (Acaena) i azorella (Azorella)[15]. Na Gough w okolicy większości nor w roślinności dominował sitowiec Scirpus bicolor i acena Acaena sarmentosa[24]. Zagęszczenie nor jest skorelowane z nachyleniem stoku oraz wilgotnością gleby[25]. Na Wyspie Mariona największe zagęszczenie nor odnotowano na obszarach zdominowanych przez kotule, mniejsze było na tych porośniętych głównie wiechlinami, a kilka razy mniejsze – w zdominowanych przez aceny. Najchętniej petrelki modre wybierają strome nadbrzeżne zbocza; pozwala to skrócić czas potrzebny na dotarcie do gniazd[28].
Tryb życia i zachowanie
Tryb życia petrelków modrych zmienia się wraz z porą roku i towarzyszącymi jej wydarzeniami. Przejawia się to między innymi w proporcjach czasu spędzanego w locie, na żerowaniu i odpoczynku na wodzie. Między końcem sezonu lęgowego i rozpoczęciem kolejnego (od opuszczenia kolonii do powrotu do niej) mija około 30–32 tygodni. Na początku tego okresu, kilka dni po opuszczeniu kolonii, zaczyna się pierzenie. U większości petrelków modrych jest to początek lutego; trwające blisko 10 tygodni pierzenie kończy się w kwietniu[22]. Wcześniejsze dane o dłuższym o kilka tygodni pierzeniu[16] pochodziły jeszcze z okresu, w którym nie prowadzono badań z użyciem telemetrii satelitarnej (pierwsze odbywały się na początku lat 90. XX wieku). Tę w połączeniu z innymi metodami wykorzystali Cherel et al. (2016) do ustalenia między innymi czasu trwania okresu pierzenia i przemieszczania się petrelków modrych, antarktycznych i cienkodziobych w jego trakcie[23]. Kilka miesięcy po zakończeniu pierzenia petrelki modre wracają do kolonii. Większość dociera do nich na początku i w połowie września, nieliczne jeszcze do pierwszych dni października[42][43][16].
Petrelki modre są regularnie obserwowane w grupach 2–3 osobników, zdarzają się również obserwacje kilkuset osobników naraz. Gniazdują w koloniach o dość dużym zagęszczeniu gniazd, jednak niezwracających uwagi. Część nor może mieć więcej niż jedno wejście, niektóre pozostają puste. W koloniach petrelki modre są aktywne głównie nocą, choć odzywają się z wnętrza nor również i za dnia[15]. Podczas pierzenia żerują więcej za dnia, średnio 4,7 vs 3 godziny w nocy. W okresie od ukończenia pierzenia do powrotu do kolonii żerują głównie w nocy, średnio 6,4 godziny vs 4,4 godziny za dnia. Ogółem poza okresem lęgowym spędzają na szukaniu pożywienia około 40–50% doby[22].
Fizjologia, zmysły i nawigacja

Zapach jest szczególnie istotny dla petrelków modrych. Do 2022 wykazano, że dzięki niemu określają cel, do którego zmierzają, rozróżniają nory innych petrelków modrych i petrelków antarktycznych[44], nory własne i należące do innych petrelków modrych[45][46] oraz jaja swoje i innych petrelków modrych. Na 24 samice, które umieszczono u wejścia do tunelu w kształcie litery T, wyboru nie podjęło 7 z nich, a z pozostałych 17 samic do swojego jaja podążyło 14[47]. Nie stwierdzono by w przypadku trafiania do własnych nor, a nie sąsiada swojego gatunku, petrelki modre kierowały się tylko lub głównie kierunkiem. W tunelu w kształcie litery T prowadzącym do jednej z dwóch nor większość osobników (16 z 23; niecałe 70%) kierowała się do właściwego gniazda. Kiedy odnogi tunelu na końcu zamknięto, a więc nie prowadziły do wejść do nory i do petrelka nie docierał ich zapach, większość osobników (17 z 20; około 85%) kierowała się w niewłaściwą stronę. Sugeruje to, że do prawidłowej orientacji przestrzennej ptaki te potrzebują również sygnałów zapachowych[45]. Wcześniej sprawdzano użyteczność węchu przy trafianiu do nor w ciemności poprzez podanie donosowo roztworu siarczanu cynku, który czasowo upośledza funkcjonowanie nabłonka węchowego. Osobniki z grupy kontrolnej otrzymały donosowo sól fizjologiczną. Wszystkie petrelki modre z grupy kontrolnej wróciły do swoich nor, co nie udało się żadnemu osobnikowi z pierwszej grupy[46].
Eksperymenty z wyborem tunelu wiodącego do jednego z dwóch źródeł zapachu – partnera lub obcego petrelka, własnego lub partnera oraz własnego lub obcego petrelka – wykazały, że znaczenie rozpoznawania zapachu swojego lub partnera wykracza poza kierowanie się do własnej nory. Prawdopodobnie sygnały zapachowe mają zastosowanie przy wyborze partnera oraz identyfikacji różnych osobników, jednak ten aspekt życia petrelków modrych nie został jeszcze dobrze poznany[48].
Miejsca potencjalnie obfitujące w pokarm mogą być zlokalizowane między innymi dzięki zapachowi siarczku dimetylu. Jego zwiększone wydzielanie się jest związane z intensywnym żerowaniem zooplanktonu, którym żywi się zdobycz petrelka modrego. Prawdopodobnie zainteresowanie zapachem siarczku dimetylu jest wrodzone. Reakcję na niego sprawdzano na grupie 20 piskląt w wieku, w którym nie mogły one jeszcze opuścić gniazda. Zaoferowano im wybór odnóg tunelu (o kształcie litery Y) prowadzących albo do źródła zapachu glikolu propylenowego, albo rozpuszczonego w nim siarczku dimetylu. 16 z nich (80%) skierowało się do drugiej odnogi. Chociaż zwracanie uwagi na zapach DMS wydaje się być wrodzone, prawdopodobnie po opuszczeniu gniazda już samodzielnie żerujące młode muszą się nauczyć interpretować te sygnały[49]. Na zależnych jeszcze pisklętach sprawdzano również zdolność do rozpoznawania zapachów we śnie – zarówno związanych z pożywieniem, jak i nowych; użyto do tego oleju z wątroby dorsza i alkoholu fenyloetylowego (o różanym zapachu), a podczas próby kontrolnej – wody destylowanej. Do oceny zachowania posłużyły wyniki obserwacji 6 zachowań: kręcenia głową, całym ciałem, dziobania, czyszczenia upierzenia, rozciągania skrzydeł i przejścia pewnego dystansu. Jedynie po rozpyleniu roztworu zawierającego olej z wątroby dorsza pisklęta zaczynały wykazywać zachowania związane z poszukiwaniem, co wskazuje na zdolność rozpoznawania zapachu potencjalnej zdobyczy jeszcze przed opuszczeniem nory. Śpiące pisklęta, którym zaprezentowano wspomniane źródła zapachów, wykazywały nimi zainteresowanie (poprzez popiskiwanie lub kręcenie głową) już w wieku 4–17 dni[50].
Lęgi
Okres lęgowy

Czas przystępowania do lęgów jest podobny we wszystkich miejscach występowania petrelków modrych[16]. Na Wyspach Kerguelena zaczynają wracać do kolonii lęgowych głównie od 4 do 20[42]–21 września. Pojedyncze osobniki pojawiają się tam jeszcze do 6 października[43]. Na Wyspach Księcia Edwarda najmniej petrelków modrych wraca w na początku września, najwięcej – w połowie września, a nieco mniej – pod koniec[16]. Po dotarciu do kolonii na początku sezonu lęgowego petrelki modre nie przystępują od razu do lęgów, ale rozpraszają się na około 1,5 miesiąca. Samce przybywają do kolonii przez dłuższy okres, a tym samym w mniejszych liczbach niż samice. Podobnie ich wyloty na morze przed rozpoczęciem składania jaj (pre-laying exodus) są bardziej rozłożone w czasie, tak jak i powroty. Pobyty poza kolonią trwają dłużej niż u samic – średnio 47,3 ± 3,2 vs 44,1 ± 3,2 dni[42]. Na decyzję o podjęciu rozrodu zarówno u samców, jak i u samic ma wpływ kondycja; doświadczenie w lęgach również jest istotne, chociaż bardziej u samców[43].
Okres składania jaj na Wyspach Księcia Edwarda trwa od co najmniej 19 do 27 października[16] (w innym źródle mowa jest już o końcu września, bez dokładniejszej daty[51]), na Wyspach Kerguelena – od 24 października do 1 listopada[52]. Na Macquarie podczas badań w 1976 pierwsze jaja znaleziono 22 października[20]. Na Wyspach Księcia Edwarda klucie ma miejsce od 4 do 17 grudnia, a opierzanie się młodych i opuszczenie nory – od 25 stycznia do 1 lutego[16]; na Wyspach Kerguelena klucie trwa od 6 do 24 grudnia, opierzanie się młodych – od 6 do 25 lutego[52] (według innego źródła odnoszącego się do Wyspy Mayesa – od 13 stycznia do 7 lutego[35]). Na Gough okres składania jaj jest przesunięty o blisko miesiąc i prawdopodobnie przypada na przełom listopada i grudnia. Podczas prac terenowych nie udało się określić dokładnej daty zniesień, jednak 7 grudnia znaleziono kilka jaj o białej skorupie; musiały być więc złożone niedawno, inaczej byłyby ubrudzone ziemią[24].
Na poniższej osi czasu przedstawiono przybliżony czas trwania poszczególnych etapów lęgów oraz powrotu do nory po przejściu pierzenia[42][16][52][35][24]; każdy z miesięcy podzielono na 6 pentad.
Zaloty
Zaloty wśród burzykowatych, również petrelków modrych, były słabo poznane jeszcze na początku 2. dekady XXI wieku. Ze względu na nocny tryb życia, brak dymorfizmu płciowego oraz istnienie fizycznej bariery między samcami w norach a samicami latającymi nad kolonią to sygnały głosowe wydają się być głównym sposobem na zaimponowanie potencjalnej partnerce. Ich znaczenie badano w populacji z Wysp Kerguelena. Wyniki ukazały się w 2021; w poprzednich latach wykazano już związek między wysokością wydawanych dźwięków a długością i głębokością dzioba. U ptaków żerujących podobnie, jak to czynią petrelki modre, budowa dzioba ma za to związek z wydajnością zdobywania pokarmu. Okazało się, że samice bardziej zainteresowane są samcami odzywającymi się z większą częstotliwością i wyższymi dźwiękami, mimo że takie odgłosy mogą bardziej zwracać uwagę drapieżników[53]. Samiec i samica podczas zalotów długo i żywo odzywają się w duecie, zwykle w norze lub ogólnie na podłożu. Wcześniej samica odpowiada samcowi z powietrza; odgłosy te, wydawane tylko przez samice, w odpowiednim okresie roku stanowią najwyżej 5% wszystkich słyszalnych w nocy[54].
Gniazdo
Petrelki modre gniazdują w norach znajdujących się od 15 do 37 cm pod poziomem gruntu. Tunel prowadzący do komory gniazdowej ma średnicę około 6 cm i długość przeważnie od 0,3 do 1 m (na Wyspach Kerguelena do 2 m)[15]. Sama komora ma przeciętnie 11,5 ± 1,0 cm (8–15 cm) wysokości oraz 15,1 ± 2,1 cm szerokości (12–16 cm; n=10)[16]. Zwykle zawiera jedynie zagłębienie, jednak stare doniesienia z Wysp Kerguelena mówią o włóknach roślinnych, liściach lub gałązkach. W jej wygrzebywaniu uczestniczą obydwa ptaki z pary[15]. Ponieważ wykopanie nory jest dość wymagające, u petrelków modrych pojawił się inny sposób na zdobycie miejsca do gniazdowania. Niektóre samce (przez autorów nazywane „squattersami”) zajmują puste nory. Na Wyspach Kerguelena, gdzie po raz pierwszy zbadano ten zwyczaj, petrelki antarktyczne przystępują do rozrodu około miesiąca po petrelkach modrych. Znacznie łatwiej dostępne są więc nory petrelków antarktycznych. Te jednak często wracają i przepędzają niechcianych lokatorów, stąd petrelki modre chętniej zajmują nory przedstawicieli własnego gatunku, które odróżniają po zapachu[44].
Na Wyspie Mayesa odnotowano przeciętne zagęszczenie nor 0,136 ± 0,026 wejścia na m², a najwyższe – 2,3 wejścia na m². Odsetek zajętych nor wzrastał wraz z ich zagęszczeniem, jednak stabilizował się na poziomie około 0,6 zajętej nory na m²[26]. W latach 80. XX wieku na Wyspie Mariona nory petrelków modrych stwierdzono w 5 z 6 badanych miejsc ze stromymi i pokrytymi roślinnością zboczami. Na wszystkich z nich zagęszczenie nor wynosiło średnio 77 ± 254 na ha (0,0077 ± 0,0254 na m²), a w najgęściej zamieszkałym – 278 na ha (0,0278 na m²)[28]. Na Diego Ramirez na bardziej płaskim obszarach z suchszym podłożem wynosi średnio 2,03 nory na m², a na bardziej stromych o wilgotniejszym podłożu – 1,11 nory na m². Na obszarach tych wykorzystywane do gniazdowania było odpowiednio 85% i 64% nor[25]. Na niektórych wyspach petrelki różnych gatunków gniazdują osobno[28], gdzie indziej tworzą mieszane kolonie. Na Wyspach Kerguelena gniazdują razem z petrelkami cienkodziobymi i antarktycznymi, petrelami białogłowymi (Pterodroma lessonii) i nurzcami Pelecanoides[44].
W norze w okresie wysiadywania jaj występują cykliczne zmiany temperatury w ciągu doby, jednak nie tak znaczne jak poza nią. Na Wyspach Kerguelena przy wahaniach temperatury powietrza od 5 °C do 20 °C w norach w ciągu dnia panuje 8–10 °C, a w nocy – 5–7 °C[55].
Jaja
W zniesieniu petrelków modrych znajduje się jedno jajo. Kształt jest zmienny, choć zwykle bardziej owalny. Skorupa ma nieco ziarnistą powierzchnię o białej barwie, często jednak w trakcie wysiadywania stają się poplamione ziemią[15]. Wymiary 14 jaj z Macquarie: 46,5–52,1 × 35,6–40,1 mm (50,3 ± 0,41 × 37,3 ± 0,28 mm)[20]; 86 jaj z Wysp Księcia Edwarda: 48,0–58,5 × 34,4–40,2 mm (51,6 ± 1,9 × 37,8 ± 1,0 mm)[16].
Składanie jaj w obrębie kolonii jest dobrze zsynchronizowane. W miejscach, gdzie dokładniej poznano fenologię lęgów trwa około 8 dni[15][16][52].
Wysiadywanie
Wysiadywanie trwa od 45 do 52 dni[16][15]. Samiec i samica zmieniają się, jako pierwsza do wysiadywania przystępuje samica. W badaniach odnotowano różną liczbę zmian – niezmiennie 6 dni[18] lub przeciętnie 11 (podano liczbę 9, ponieważ odliczono pierwszą i ostatnią zmianę)[15]. Podawany czas trwania pobytu dorosłego w norze to 8–12 dni (w przypadku 6 zmian)[18], średnio 5 dni w przypadku około 11 zmian oraz 6,8 dnia dla samicy i 8,9 dnia dla samca, liczby zmian nie wspomniano[15].
Temperatura jaja podczas wysiadywania utrzymuje się na poziomie około 32,0 °C, niecałe 8 °C mniej niż wynosi wówczas temperatura ciała dorosłego petrelka[55]. Jaja petrelków modrych są w pewnym stopniu odporne na wychłodzenie. Dzięki temu osobniki, które nie są w stanie efektywnie zmieniać się z partnerem mogą tymczasowo zostawić jajo. Jest to szczególnie przydatne w okresach niedoboru pożywienia. Ważenie dorosłych osobników na różnych etapach inkubacji wykazało, że decyzja o opuszczeniu jaja jest związana ze zużyciem rezerw tłuszczu i spadkiem masy ciała do określonej wartości[18]. Przeważnie pisklę zaczyna kwilić 2 dni przed wykluciem[15].
Opieka nad młodymi i ich rozwój
Od wyklucia do pełnego opierzenia mija od 48 do 60 dni, średnio 53 ± 2,5 dni (n=41)[16]. Pisklęta w pierwszym puchu są niebieskoszare, następnie szare. Mają czarny dziób z dobrze widocznym zębem jajowym, który zwykle odpada w ciągu pierwszego tygodnia życia[15]. Tuż po wykluciu młode ważą około 30–38 g[15][56]. W ciągu kilku godzin zyskują zdolność termoregulacji[15]. Ich masa ciała zwiększa się aż do około 28.–40. dnia życia, w którym przekracza przeciętną masę ciała dorosłego osobnika. Następnie znów zmniejsza się i w momencie opierzenia jest nieznacznie mniejsza niż u dorosłego[57][16][56]. Według Browna (1988) dzienny wydatek energetyczny piskląt w przeliczeniu na masę ciała jest największy niedługo po wykluciu, a następnie do około 20. dnia życia spada do poziomu właściwego dorosłym osobnikom. W badaniu uwzględniono pisklęta trzech gatunków petreli, jednak tylko u młodych petrelków modrych zaobserwowano późniejszy wzrost wydatku energetycznego: od około 28. dnia życia (największa masa ciała) do opierzenia[57].
Częstotliwość karmienia częściowo zależy od etapu odchowu – jest mniejsza w okresie zmniejszania się masy ciała przed opierzeniem[56]. Samce i samice petrelków młodych mają zbliżony udział w karmieniu młodych. Wyruszają na morze na zmianę na krótki i długi okres, bez wypraw „średniej” długości. Zwykle samiec i samica rozmijają się. Rzadko zdarza się otrzymanie pokarmu dwa razy w ciągu jednej nocy (3,1% z n=350). Prawdopodobieństwo spotkania się wówczas samca i samicy jest niewielkie, ponieważ ich wizyty w norze dzieliło średnio 5 godzin, a po dostarczeniu pokarmu pozostawały z młodym najwyżej 65 minut[32]. W okresie, w którym młode zbliżają się już do pełnego opierzenia, ich rodzice przybywają z pokarmem jedynie w całkowitej ciemności. Zostają z potomstwem około 20 minut, później natychmiast wracają na morze[35].
| Miejce prowadzenia badań | Okres | Liczba gniazd | Losy lęgów | Sukces lęgowy | Źródło | ||||
|---|---|---|---|---|---|---|---|---|---|
| Niepowodzenie | Sukces | ||||||||
| Utrata jaja | Utrata pisklęcia | ||||||||
| Wyspa Mariona (1 – Macaroni Bay, 2 – Long Ridge, 3 – Swartkop) | 1 | 2012 | 50 | 9 | 10 | 31 | 54% | 61 ± 6% | Dilley et al. (2017)[51] |
| 2 | 50 | 5 | 10 | 35 | 66% | ||||
| 3 | 50 | 7 | 10 | 33 | 64% | ||||
| Wyspy Kerguelena | 1986–1993 | 585 | 215 | 25,7 do ok. 63% (w różnych latach) | Chastel et al. (1995)[58] | ||||
Status, zagrożenia i ochrona
IUCN uznaje petrelka modrego za gatunek najmniejszej troski (LC, Least Concern) nieprzerwanie od 1988 (stan w 2022). BirdLife International uznaje trend liczebności populacji za prawdopodobnie spadkowy. Wiadomo o spadku liczebności populacji w obrębie części Wysp Kerguelena oraz Wysp Księcia Edwarda; ponieważ tamtejsze populacje są 2. i 3. najliczniejszymi, ten trend liczebności może przekładać się na całkowitą populację[59].
Według BirdLife International w 2004 całkowita populacja petrelka modrego mogła składać się z co najmniej 3 milionów osobników[59]. Sytuacja populacji lęgowej w poszczególnych miejscach gniazdowania jest następująca:
- Wyspy Diego Ramírez
- W 2002 roku szacunkowa liczebność populacji lęgowej wynosiła około 1,35 mln par lęgowych (ogółem między 1,15–1,54 mln)[25].
- Wyspy Kerguelena
- W 1989 Wyspy Kerguelena mogło zamieszkiwać od 100 do 200 tysięcy par lęgowych[52]. W 2002 szacunkowa liczebność populacji lęgowej wynosiła około 142 lub 148 tysięcy par – różnice wynikają z wzięcia pod uwagę lub nie autokorelacji przestrzennej zagęszczenia nor[26].
- Wyspy Księcia Edwarda
- Według szacunkowych danych uzyskanych podczas prac terenowych w 2012 roku na Wyspie Mariona mogło się wówczas znajdować około 214,7 tysiąca nor petrelków modrych. Tamtego roku w okresie, gdy większość lęgów była na etapie wysiadywania jaj, zajętych było około 82% nor (ogółem w ciągu roku od 36% do 98%). Populacja lęgowa na wyspie mogła więc liczyć blisko 145 tysięcy par (95% przedziału ufności: 110–180 tysięcy)[27].
- Wyspy Crozeta
- Od 40 do 180 tysięcy par; co najmniej do 2013 nie pojawiły się inne dane[29].
- Georgia Południowa
- W 1980 na Bird Island gniazdować mogło od 13 do 17 tysięcy par. Zakładając podobne zagęszczenie w odpowiednim środowisku na reszcie wysp tej grupy, populacja lęgowa petrelków modrych składała się z około 70 tysięcy par[60].
- Macquarie
- Niecałe 1000 par (dane sprzed 2013)[29]. W 2007 znanych było 17 miejsc gniazdowania na Macquarie[30].
Przypisy
- ↑ a b Halobaena caerulea, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ Halobaena caerulea, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Systematyka i nazwy polskie za: P. Mielczarek & M. Kuziemko: Rodzina: Procellariidae Leach, 1820 - burzykowate - Petrels & Shearwaters (Wersja: 2021-10-10). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2022-04-25].
- ↑ J.F. Gmelin, Systema naturae per regna tria naturae, wyd. 13, t. 1, cz. 2, s. 560 (łac.).
- ↑ F. Gill, D. Donsker, P. Rasmussen (red.), Petrels, albatrosses, IOC World Bird List (v12.1), 20 stycznia 2022 [dostęp 2022-04-25].
- ↑ Clements i inni, The eBird/Clements Checklist of Birds of the World: v2021, 2021 [dostęp 2022-04-24].
- ↑ a b PROCELLARIIDAE - Petrels and Shearwaters (16:86), [w:] Edward C. Dickinson & Les Christidis (red.), Howard and Moore Complete Checklist of the birds of the World, wyd. 4, t. 2, 2014 [dostęp 2022-04-24].
- ↑ HBW and BirdLife International, Handbook of the Birds of the World and BirdLife International digital checklist of the birds of the world. Version 6, grudzień 2021, s. 107 [dostęp 2022-04-24].
- ↑ James A. Jobling, Helm Dictionary of Scientific Bird Names, Christopher Helm Publishers Ltd, 2009, s. 185, ISBN 1-4081-2501-3.
- ↑ Penhallurick i inni, Analysis of the taxonomy and nomenclature of the Procellariiformes based on complete nucleotide sequences of the mitochondrial cytochrome b gene, „Emu”, 104 (2), 2004, s. 125–147.
- ↑ Andrea Estandía i inni, Substitution Rate Variation in a Robust Procellariiform Seabird Phylogeny is not Solely Explained by Body Mass, Flight Efficiency, Population Size or Life History Traits, „bioRxiv | The preprint server for biology”, 2021, DOI: 10.1101/2021.07.27.453752.
- ↑ S. Kumar, G. Stecher, M. Suleski & S.B. Hedges, TimeTree: a resource for timelines, timetrees, and divergence times, „Molecular Biology and Evolution”, 34, 2017, s. 1812–1819, DOI: 10.1093/molbev/msx116. (baza dostępna pod adresem timetree.org)
- ↑ W. Jetz i inni, The global diversity of birds in space and time, „Nature”, 491 (7424), 2012, s. 444–448, DOI: 10.1038/nature11631, ISSN 0028-0836 [dostęp 2022-04-24] (ang.).
- ↑ Petra Quillfeldt i inni, Does genetic structure reflect differences in non-breeding movements? A case study in small, highly mobile seabirds, „BMC Evolutionary Biology”, 17 (1), 2017, DOI: 10.1186/s12862-017-1008-x, ISSN 1471-2148, PMID: 28679381, PMCID: PMC5499058 (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab S. Marchant & P.J. Higgins (red.), Handbook of Australian, New Zealand & Antarctic Birds, t. 1, Ratites to ducks; Part A, Ratites to petrels, Melbourne: Oxford University Press, 1990, s. 508–515.
- ↑ a b c d e f g h i j k l m n o p S.R. Fugler i inni, Breeding Biology of Blue-Petrels Halobaena caerulea at the Prince Edward Islands, „Emu”, 87, 1987, s. 103–110.
- ↑ a b c d Y. Cherel i inni, Diet and feeding ecology of blue petrels Halobaena caerulea at Iles Kerguelen, Southern Indian Ocean, „Marine Ecology Progress Series”, 228, 2002, s. 283–299, DOI: 10.3354/meps228283, ISSN 0171-8630.
- ↑ a b c d T. Chaurand & H. Weimerskirch, Incubation routine, body mass regulation and egg neglect in the Blue Petrel Halobaena caerulea, „Ibis”, 136, 1994, s. 285–290, DOI: 10.1111/j.1474-919X.1994.tb01097.x.
- ↑ a b R.S. Brown, F.I. Norman, D.W. Eades, Notes on Blue and Kerguelen Petrels Found Beach-washed in Victoria, 1984, „Emu”, 86, 1986, s. 228–238, DOI: 10.1071/MU9860228.
- ↑ a b c N.P. Brothers, Breeding, Distribution and Status of Burrow-nesting Petrels at Maqaurie Island, „Wildlife Research”, 11 (1), 1984, DOI: 10.1071/wr9840113.
- ↑ M.I. Laranjeiro, M. Farré, R.A. Phillips, Variation among species and populations in bill shape and size in three planktivorous petrels, „Marine Biology”, 169 (24), 2022, DOI: 10.1007/s00227-021-04014-7.
- ↑ a b c d e Yves Cherel i inni, Combination of At-Sea Activity, Geolocation and Feather Stable Isotopes Documents Where and When Seabirds Molt, „Frontiers in Ecology and Evolution”, 4, 2016, DOI: 10.3389/fevo.2016.00003, ISSN 2296-701X.
- ↑ a b c d e P. Ryan, J. Lee & F. Bouard, Moult intensity in blue petrels and a key moult site off West Antarctica, „Antarctic Science”, 32 (1), 2020, s. 1–9, DOI: 10.1017/S0954102019000427.
- ↑ a b c d e f g Peter G Ryan i inni, Blue Petrels Halobaena caerulea discovered breeding on Gough Island, „Ostrich”, 86 (1–2), 2015, s. 193–194, DOI: 10.2989/00306525.2015.1005558, ISSN 0030-6525.
- ↑ a b c d Kieran Lawton i inni, An estimate of population sizes of burrowing seabirds at the Diego Ramirez archipelago, Chile, using distance sampling and burrow-scoping, „Polar Biology”, 29 (3), 2006, s. 229–238, DOI: 10.1007/s00300-005-0043-z, ISSN 0722-4060.
- ↑ a b c Christophe Barbraud, Karine Delord, Population census of blue petrels Halobaena caerulea at Mayes Island, Iles Kerguelen, „Antarctic Science”, 18 (2), 2006, s. 199–204, DOI: 10.1017/S095410200600023X, ISSN 0954-1020.
- ↑ a b c Ben J. Dilley i inni, The distribution and abundance of Blue Petrels (Halobaena caerulea) breeding at subantarctic Marion Island, „Emu - Austral Ornithology”, 117 (3), 2017, s. 222–232, DOI: 10.1080/01584197.2017.1298403, ISSN 0158-4197.
- ↑ a b c d M. Schramm, Burrow densities and nest site preferences of petrels (Procellariidae) at the Prince Edwards Islands, „Polar Biology”, 6, 1986, s. 63–70, DOI: 10.1007/BF00258254.
- ↑ a b c d e f C.M. Miskelly, Blue petrel, red. C.M. Miskelly: New Zealand Birds Online, 2013 [dostęp 2022-01-27].
- ↑ a b Sally Bryant & Justine Shaw, Threatened species assessment on Macquarie Island, Voyage 5, kwiecień 2007, s. 16.
- ↑ J. Navarro i inni, Ecological Segregation in Space, Time and Trophic Niche of Sympatric Planktivorous Petrels, „PLoS ONE”, 8 (4), 2013, DOI: 10.1371/journal.pone.0062897.
- ↑ a b c d e f g h T. Chaurand & H. Weimerskirch, The Regular Alternation of Short and Long Foraging Trips in the Blue Petrel Halobaena caerulea: A Previously Undescribed Strategy of Food Provisioning in a Pelagic Seabird, „Journal of Animal Ecology”, 63 (2), 1994, s. 275–282, DOI: 10.2307/5546, JSTOR: 5546.
- ↑ a b c H. Weimerskirch i inni, Foraging efficiency and adjustment of energy expenditure in a pelagic seabird provisioning its chick, „Journal of Animal Ecology”, 72, 2003, s. 500–508, DOI: 10.1046/j.1365-2656.2002.00720.x.
- ↑ a b c P.A. Prince, The food and feeding ecology of Blue petrel (Halobaena caerulea) and Dove prion (Pachyptila desolata), „Journal of Zoology”, 190 (1), 1980, s. 59–76, DOI: 10.1111/j.1469-7998.1980.tb01423.x.
- ↑ a b c d e f W.K. Steele & N.T. Klages, Diet of the blue petrel at sub-Antarctic Marion Island, „African Zoology”, 21 (3), 1986.
- ↑ a b c d e f g M. Connan i inni, Interannual dietary changes and demographic consequences in breeding blue petrels from Kerguelen Islands, „Marine Ecology Progress Series”, 373, 2008, s. 123–135, DOI: 10.3354/meps07723, ISSN 0171-8630 (ang.).
- ↑ a b c V. Ridoux, The diets and dietary segregation of seabirds at the subantarctic Crozet Islands, „Marine Ornithology”, 22, 1994, s. 108–115.
- ↑ A. Clarke, P.A. Prince, The origin of stomach oil in marine birds: analyses of the stomach oil from six species of subantarctic procellariiform birds, „Journal of Experimental Marine Biology and Ecology”, 23, 1976, s. 15–30, DOI: 10.1016/0022-0981(76)90082-4.
- ↑ Charlène Gémard, Victor Planas-Bielsa, Francesco Bonadonna & Thierry Aubin, Contextual variations in calls of two nonoscine birds: the blue petrel Halobaena caerulea and the Antarctic prion Pachyptila desolata, „Behavioral Ecology”, 32, 2021, DOI: 10.1093/beheco/arab020.
- ↑ Petra Quillfeldt i inni, Cool, cold or colder? Spatial segregation of prions and blue petrels is explained by differences in preferred sea surface temperatures, „Biology Letters”, 11 (4), 2015, DOI: 10.1098/rsbl.2014.1090, ISSN 1744-9561, PMID: 25878044, PMCID: PMC4424614 (ang.).
- ↑ Navarro i inni, Spatial distribution and ecological niches of non-breeding planktivorous petrels, „Scientific Reports”, 5, 2015, DOI: 10.1038/srep12164.
- ↑ a b c d P. Quillfeldt P i inni, Niche switching and leapfrog foraging: movement ecology of sympatric petrels during the early breeding season, „Movement Ecology”, 8:23, 2020, DOI: 10.1186/s40462-020-00212-y.
- ↑ a b c Olivier Chastel, Henri Weimerskirch, Pierre Jouventin, Influence of Body Condition on Reproductive Decision and Reproductive Success in the Blue Petrel, „The Auk”, 112 (4), 1995, s. 964–972, DOI: 10.2307/4089027, JSTOR: 4089027.
- ↑ a b c F. Bonadonna & J. Mardon, One House Two Families: Petrel Squatters Get a Sniff of Low-Cost Breeding Opportunities, „Ethology”, 116, 2010, s. 176–182.
- ↑ a b F. Bonadonna, M. Villafane, C. Bajzak & P. Jouventin, Recognition of burrow's olfactory signature in blue petrels, Halobaena caerulea: an efficient discrimination mechanism in the dark, „Animal Behaviour”, 67 (5), 2004.
- ↑ a b F. Bonadonna, J. Spaggiari, H. Weimerskirch, Could osmotaxis explain the ability of blue petrels to return to their burrows at night?, „Journal of Experimental Biology”, 204 (8), 2001.
- ↑ Sarah Leclaire, Vincent Bourret, Francesco Bonadonna, Blue petrels recognize the odor of their egg, „Journal of Experimental Biology”, 220 (17), 2017, DOI: 10.1242/jeb.163899.
- ↑ Mardon i inni, Atypical homing or self-odour avoidance? Blue petrels (Halobaena caerulea) are attracted to their mate’s odour but avoid their own, „Behavioral Ecology and Sociobiology”, 63, 2009, s. 537–542, DOI: 10.1007/s00265-008-0688-z.
- ↑ F. Bonadonna i inni, Evidence that blue petrel, Halobaena caerulea, fledglings can detect and orient to dimethyl sulfide, „Journal of Experimental Biology”, 209 (11), 2006, s. 2165–2169, DOI: 10.1242/jeb.02252.
- ↑ G. Cunningham i inni, Behavioural responses of blue petrel chicks (Halobaena caerulea) to food-related and novel odours in a simple wind tunnel, „Antarctic Science”, 18, 2006, DOI: 10.1017/S0954102006000393.
- ↑ a b B.J. Dilley, S. Schoombie, K. Stevens, Mouse predation affects breeding success of burrow-nesting petrels at sub-Antarctic Marion Island, „Antarctic Science”, 30 (2), 2018, s. 93–104, DOI: 10.1017/S0954102017000487.
- ↑ a b c d e H. Weimerskirch, R. Zotier. & P. Jouventin, The avifauna of the Kerguelen Islands, „Emu”, 89, 1989, s. 15–29, DOI: 10.1071/MU9890015.
- ↑ C. Gémard, T. Aubin, E.L. Reboud, Call rate, fundamental frequency, and syntax determine male-call attractiveness in blue petrels Halobaena caerulea, „Behavioral Ecology and Sociobiology”, 75 (55), 2021, DOI: 10.1007/s00265-021-02989-3.
- ↑ Vincent Bretagnolle, Behavioural affinities of the Blue Petrel Halobaena caerulea, „Ibis”, 132, 1990, s. 102–105, DOI: 10.1111/j.1474-919X.1990.tb01020.x.
- ↑ a b A. Ancel, L. Petter & R. Groscolas, Changes in egg and body temperature indicate triggering of egg desertion at a body mass threshold in fasting incubating blue petrels (Halobaena caerulea), „Journal of Comparative Physiology B”, 168, 1998, s. 533–539, DOI: 10.1007/s003600050174.
- ↑ a b c P. Jouventin i inni, Comparative biology of the burrowing petrels of the Crozet Islands, „Notornis”, 32 (3), 1985.
- ↑ a b C.R. Brown, Energy requirements for growth of Salvin's Prions Pachyptila vittata salvini, Blue Petrels Halobaena caerulea and Great-winged Petrels Pterodroma macroptera, „Ibis”, 130, 1988, s. 527–534, DOI: 10.1111/j.1474-919X.1988.tb02718.x.
- ↑ O. Chastel, H. Weimerskirch & P. Jouventin, Body Condition and Seabird Reproductive Performance: A Study of Three Petrel Species, „Ecology”, 76, 1995, s. 2240–2246, DOI: 10.2307/1941698, JSTOR: 1941698.
- ↑ a b Blue Petrel Halobaena caerulea, BirdLife International [dostęp 2022-04-25].
- ↑ P.A. Prince & J.P. Croxall, Birds of South Georgia: new records and re-evaluation of status, „British Antarctic Survey Bulletin”, 59, 1983, s. 15–27.
Linki zewnętrzne
- Zdjęcia i nagrania audiowizualne. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Auckland Museum Collections from Auckland, Aotearoa New Zealand, Licencja: CC BY 2.0
Taxonomic Name : Halobaena caerulea
Common Name : Blue Petrel
Accession Number : LB261
Part of the birds/land vertebrates collection
For more details visit <a href="https://www.aucklandmuseum.com/collections-research/collections/record/am_naturalsciences-object-133416" rel="noreferrer nofollow">www.aucklandmuseum.com/collections</a> Images released under a CC-BY licence. Auckland Museum 2019Autor: Uwe Kils I am willing to give the image in 1700 resolution to Wikipedia Uwe Kils, Licencja: CC BY-SA 3.0
Antarctic krill Euphausia superba.
Autor: Cephas, Licencja: CC BY-SA 4.0
Range map of Blue Petrel (Halobaena caerulea)
Autor: Christopher Jones, Licencja: CC BY-SA 4.0
A Blue Petrel incubating its egg on Gough Island.
Autor: B.navez, Licencja: CC-BY-SA-3.0
Blue Petrel (Halobaena caerulea) - ornithological survey and ringing campaign on Mayes island - 1999 (Kerguelen Islands)
| To zdjęcie było poddane obróbce cyfrowej i może różnić się od wersji oryginalnej. Zmiany: Cropped. Oryginał można obejrzeć tu: Halobaena caerulea.jpg:
|
Autor: Ed Dunens, Licencja: CC BY 2.0
Blue Petrel photographed at Port Fairy, Victoria, Australia.
Autor: GeSHaFish, Licencja: CC BY-SA 3.0
Blue petrel, 26 November 2009, West Antarctica
Electrona antarctica
Autor: JJ Harrison (https://tiny.jjharrison.com.au/t/JieH9NbS0fOOjZpX), Licencja: CC BY-SA 3.0
Blue Petrel (Halobaena caerulea) , east of the Tasman Peninsula, Tasmania, Australia.
Autor: Didier Descouens, Licencja: CC BY-SA 4.0
Egg of Blue Petrel. Collection of Vincent Bretagnolle / Jacques Perrin de Brichambaut.