Podtlenek węgla
| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny | C3O2 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 68,03 g/mol | ||||||||||||||
| Wygląd | bezbarwny gaz o ostrym zapachu | ||||||||||||||
| Identyfikacja | |||||||||||||||
| Numer CAS | |||||||||||||||
| PubChem | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | |||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||
Podtlenek węgla (C3O2) – organiczny związek chemiczny z grupy tlenków węgla, dibezwodnik kwasu malonowego. W warunkach pokojowych jest trującym gazem[1].
Otrzymywanie
Podtlenek węgla został opisany po raz pierwszy w roku 1873 przez Benjamina Brodiego. Otrzymał go w postaci czerwonobrązowego nalotu na ściankach naczynia, w którym poddawał on działaniu prądu elektrycznego tlenek węgla[2][3]. Nazwę podtlenek węgla nadał mu Marcellin Berthelot[4].
Podtlenek węgla otrzymać można przez odwodnienie kwasu malonowego lub jego estrów za pomocą pięciotlenku fosforu[5][6][1]:
- CH
2(COOH)
2 + P
4O
10 → C
3O
2 + 4HPO
3
Przegląd jego metod otrzymywania i właściwości opublikowano w roku 1930[7].
Budowa
W cząsteczce podtlenku węgla wszystkie atomy są ułożone w linii prostej i połączone skumulowanymi podwójnymi wiązaniami chemicznymi: O=C=C=C=O.
Strukturę krystaliczną C3O2 ustalono w roku 2001 metodą rentgenograficzną w temperaturze −120 °C. Podtlenek węgla w takich warunkach tworzy kryształy w układzie rombowym, w których prawie idealnie liniowe cząsteczki O=C=C=C=O tworzą warstwy o układzie jodełki[6].
Właściwości chemiczne
Pod wpływem wody hydrolizuje do kwasu malonowego. Hydroliza z użyciem ciężkiej wody prowadzi do produktu zawierającego 4 atomy deuteru[8][9]:
- C
3O
2 + 2D
2O → CD
2(COOD)
2
Polimeryzacja
Podtlenek węgla ulega spontanicznej polimeryzacji, mogącej przebiegać wybuchowo, z uwolnieniem dużej ilości ciepła (136 kJ/mol). Produktem jest czerwono-czarne amorficzne ciało stałe, zachowujące wzór empiryczny C3O2[5][10].
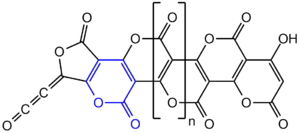
W roku 1960 Erich Ziegler na zjeździe Gesellschaft Deutscher Chemiker zaproponował policykliczną strukturę polimeru (C3O2)n zawierającą skondensowane pierścienie α-pironu (2H-piran-2-onu)[11], co zostało wkrótce potwierdzone w innych laboratoriach, jednak w roku 1984 struktura ta została zakwestionowana[10]. W roku 2004 opublikowane zostały badania rentgenograficzne (C3O2)n w roztworze dowodzące, że związek ten rzeczywiście zawiera jednostki α-pironu, a stopień polimeryzacji wynosi ok. n ≈ 40 (co jest niezgodne z wcześniejszymi wynikami n = 6–8 i wymaga potwierdzenia)[10]. Strukturę poli-α-pironu potwierdziły też analizy 13C NMR w ciele stałym[12].
Przypisy
- ↑ a b podtlenek węgla, [w:] Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 548, OCLC 33835352.
- ↑ Note on the synthesis of marsh-gas and formic acid, and on the electric decomposition of carbonic oxide, „Proceedings of the Royal Society of London”, 21 (139-147), 1873, s. 245–247, DOI: 10.1098/rspl.1872.0052 [dostęp 2022-03-17] (ang.).
- ↑ B.C. Brodie, Ueber eine Synthese von Sumpfgas und Ameisensäure und die electrische Zersetzung des Kohlenoxyds, „Justus Liebig's Annalen der Chemie und Pharmacie”, 169 (1-2), 1873, s. 270–271, DOI: 10.1002/jlac.18731690119 [dostęp 2022-03-17] (niem.).
- ↑ Marcellin Berthelot, Action de la chaleur sur l'oxyde de carbone, „Annales de chimie et de physique”, 24, 6, 1891, s. 126-132 [dostęp 2022-03-17] (fr.).
- ↑ a b Otto Diels, Bertram Wolf, Ueber das Kohlensuboxyd. I, „Berichte der deutschen chemischen Gesellschaft”, 39 (1), 1906, s. 689–697, DOI: 10.1002/cber.190603901103 [dostęp 2022-03-17] (niem.).
- ↑ a b A. Ellern, T. Drews, K. Seppelt, The Structure of Carbon Suboxide, C3O2, in the Solid State, „Zeitschrift für anorganische und allgemeine Chemie”, 627 (1), 2001, s. 73–76, DOI: 10.1002/1521-3749(200101)627:1<73::AID-ZAAC73>3.0.CO;2-A (ang.).
- ↑ L.H. Reyerson, Kenneth. Kobe, Carbon Suboxide, „Chemical Reviews”, 7 (4), 1930, s. 479–492, DOI: 10.1021/cr60028a002 [dostęp 2022-03-17] (ang.).
- ↑ J.O. Halford, Leigh C. Anderson, Organic Deuterium Compounds. Acetic, Malonic and Succinic Acids, „Journal of the American Chemical Society”, 58 (5), 1936, s. 736–740, DOI: 10.1021/ja01296a011 [dostęp 2022-03-17] (ang.).
- ↑ F. Dalton, R.D. Hill, G.D. Meakins, 590. The infrared spectra of deuterium compounds. Part I. The C–H stretching bands of OMe and NMe groups, „Journal of the Chemical Society”, 0 (0), 1960, s. 2927–2929, DOI: 10.1039/JR9600002927 [dostęp 2022-03-17] (ang.).
- ↑ a b c d Matthias Ballauff i inni, Analysis of Poly(carbon suboxide) by Small-Angle X-ray Scattering, „Angewandte Chemie International Edition”, 43 (43), 2004, s. 5843–5846, DOI: 10.1002/anie.200460263 [dostęp 2022-03-17] (ang.).
- ↑ Über die konstitutionellen Beziehungen ziuischen Polypyrono-Verbindungen und „der roten Kohle”, „Angewandte Chemie”, 72 (16), Hauptversammlung der Gesellschaft Deutscher Chemiker, 1960, s. 582, DOI: 10.1002/ange.19600721611 [dostęp 2022-03-17] (niem.).
- ↑ Jörn Schmedt auf der Günne i inni, The Structure of Poly(carbonsuboxide) on the Atomic Scale: A Solid-State NMR Study, „Chemistry - A European Journal”, 11 (15), 2005, s. 4429–4440, DOI: 10.1002/chem.200401133 [dostęp 2022-03-17] (ang.).
Media użyte na tej stronie
Wzór poli(podtlenku węgla) z wyróżnionym motywem α-pironu (wg Angew. Chem. Int. Ed. 2004, 43, 5843–5846)




