Poniżej zaprezentowane są fragmenty wszystkich
wyróżnionych artykułów z dziedziny chemii.
Mamy ich w chwili obecnej 14.
Pisane są one zarówno przez specjalistów, jak i pasjonatów chemii.
Ty także możesz wziąć w tym udział.
Sprawdź jak możesz pomóc!
Atom – podstawowy składnik
materii. Składa się z małego dodatnio naładowanego
jądra o dużej
gęstości i otaczającej go
chmury elektronowej o ujemnym ładunku elektrycznym. Słowo
atom pochodzi z
greckiego ἄτομος −
átomos (od α-, „nie-” + τέμνω −
temno, „ciąć”), oznaczającego coś, czego nie da się przeciąć ani podzielić. Idea istnienia niepodzielnych składników materii pojawiła się już w pismach starożytnych
filozofów indyjskich i
greckich. W XVII i XVIII wieku chemicy potwierdzili te przypuszczenia, identyfikując pierwiastki chemiczne i pokazując, że reagują one ze sobą w ściśle określonych proporcjach. W XIX wieku odkryto
ruchy Browna, będące pośrednim dowodem ziarnistości materii. Na początku XX wieku fizycy odkryli wewnętrzną strukturę atomów, pokazując tym samym, że są one podzielne. Teorie
mechaniki kwantowej pozwoliły stworzyć matematyczne modele wnętrza atomu.
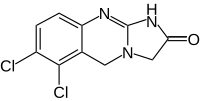
Bortezomib (
łac.
bortezomibum) –
organiczny związek chemiczny,
dipeptydowa pochodna
kwasu borowego, będąca silnym i odwracalnym
inhibitorem proteasomu 26S – kompleksu białkowego odpowiadającego za degradację białek komórkowych. Bortezomib jest pierwszym i, jak dotąd, jedynym wprowadzonym do leczenia inhibitorem proteasomu. W badaniach klinicznych II fazy stwierdzono istotną odpowiedź na leczenie u ponad 1/3 pacjentów z zaawansowanym
szpiczakiem mnogim. Na tej podstawie amerykańska
Agencja Żywności i Leków w dniu 13 maja 2003 zarejestrowała bortezomib w trybie przyspieszonym ze wskazaniem leczenia szpiczaka mnogiego u chorych, u których po zastosowaniu co najmniej dwóch schematów leczenia nastąpił nawrót choroby. Następnie Agencja Żywności i Leków zatwierdziła również leczenie
chłoniaka z komórek płaszcza bortezomibem u pacjentów, którzy otrzymali wcześniej co najmniej jeden schemat leczenia.
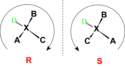
Konfiguracja absolutna (inaczej
bezwzględna) – jednoznaczny sposób rozróżniania i nazewnictwa
izomerów optycznych, a ściśle biorąc ustalania rozmieszczenia w przestrzeni
podstawników w
enancjomerach i
diastereoizomerach. Enancjomery, jeden z rodzajów izomerów optycznych
związków chemicznych różnią się między sobą tak jak lewa i prawa dłoń lub lewo i prawoskrętna skorupa ślimaka, tj. są chiralne i mają się do siebie tak jak lustrzane odbicie do odbijanego przedmiotu. W przypadku
związków organicznych ich chiralność wynika najczęściej z faktu występowania czterech różnych podstawników przy centralnym atomie
węgla. Dokładne ustalenie wzajemnego umiejscowienia tych podstawników w przestrzeni decyduje o tym, z którym z dwóch enancjomerów ma się do czynienia. W odróżnieniu jednak od skorupy ślimaka, którego
prawoskrętność i
lewoskrętność jest łatwo ustalić w intuicyjny sposób, jednoznaczne nazewnictwo enancjomerów wymaga przyjęcia złożonego zbioru zasad, które są opisane poniżej.
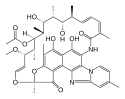
Ryfaksymina,
rifaksymina (
łac. rifaximinum) –
organiczny związek chemiczny,
antybiotyk należący do grupy
ryfamycyn, wchłaniający się w nieznacznym stopniu z
przewodu pokarmowego, stosowany w leczeniu zakażeń jelitowych. Jego stosowanie wiąże się ze względnie niewielkimi działaniami ubocznymi i z niskim ryzykiem rozwinięcia
oporności u bakterii. Syntezę ryfaksyminy opatentowali Egidio Marchi i Lauretta Montecchi z Alfa Farmaceutici S.p. A. w 1982. Lek jest badany i stosowany w terapii
biegunki podróżnych od kilkunastu lat. Do 2009 ryfaksymina otrzymała zezwolenie na zastosowanie w 27 państwach. Jest to syntetyczna pochodna ryfamycyny, ryfamycyny SV lub ryfamycyny O. Jest to dokładnie pirydoimidazoryfamycyna. Otrzymuje się ją na przykład w reakcji 3-bromoryfamycyny S z 2-amino-4-metylo-
pirydyną. Reakcję prowadzi się w
etanolu, w temperaturze od pokojowej do 60 °C, przez dwie do osiemnastu godzin.
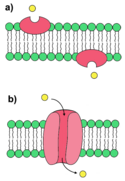
Jonofory –
organiczne związki chemiczne zdolne do transferu
jonów z roztworów wodnych do fazy
hydrofobowej. Termin
antybiotyki jonoforowe jest stosowany do tych jonoforów, które wykazują działanie
bakteriobójcze. Właściwości antybiotyczne jonoforów wynikają z ich zdolności do transportu jonów przez
błony lipidowe komórek lub
organelli. Jony, które nie mogą swobodnie przemieszczać się przez
dwuwarstwy lipidowe, są transportowane w postaci
kompleksów, w których jonofor pełni rolę „gospodarza”, a jon rolę „gościa”. Pierwszym poznanym antybiotykiem z grupy jonoforów była
gramicydyna S (z
ang. Gramicidin Soviet). Została ona odkryta już w 1942 roku przez
rosyjskich naukowców – Gieorgija Gauze'a i jego żonę Marię Brażnikową – badających
bakterie z gatunku
Bacillus brevis. Badacze zaobserwowali, że gramicydyna S silnie hamuje rozrost kolonii
gronkowca złocistego. Nie znali oni jednak mechanizmu tego działania. Kwestia ta wciąż nie jest w pełni wyjaśniona, pomimo że określono już strukturę związku. Przyjmuje się, że powoduje ona rozładowanie
gradientu stężeń jonów na zewnątrz i wewnątrz
komórki bakteryjnej, powodując jej obumieranie. W czasach Gause'a i Breżnikowej znane były także inne antybiotyki zaliczane obecnie do jonoforowych, takie jak
gramicydyna A,
walinomycyna,
naktyny,
wirginiamycyna i
kwas lasalowy, mimo iż nie znano jeszcze właściwego sposobu ich działania.
Projekt Chemia · Dyskusja Projektu Chemia
Acetazolamid –
organiczny związek chemiczny,
lek należący do grupy
sulfonamidowych inhibitorów anhydrazy węglanowej. Do leczenia wprowadzony został w 1953 roku. Jest słabym
diuretykiem; jego działanie ustępuje po 3 dniach stosowania. Acetazolamid jest prekursorem sulfonamidowych leków moczopędnych, stosowanym obecnie głównie w leczeniu
jaskry. Horace Davenport z
Harvard Medical School w latach 40. XX wieku odkrył, że bardzo duże ilości
anhydrazy węglanowej znajdują się
nerkach. Skłoniło to
Rudolfa Höbera do wysnucia wniosku, iż niektóre skutki uboczne stosowania dużych dawek sulfonamidów, m.in.
alkalizacja moczu i zwiększone jego wydalanie, wiążą się z
inhibicją tego enzymu. Z kolei
bostoński lekarz, William Schwartz, próbował wywołać
diurezę u pacjentów z
zastoinową niewydolnością serca, stosując w tym celu duże dawki
sulfanilamidu. Próby nie przyniosły jednak większych rezultatów ze względu na poważne
objawy niepożądane. Davenport, zainteresowany teorią przedstawioną przez Höbera, zaproponował współpracę nad silniejszymi inhibitorami anhydrazy węglanowej Richardowi Roblinowi – ówczesnemu pracownikowi firmy farmaceutycznej
Cyanamid.
Anagrelid –
organiczny związek chemiczny,
lek cytostatyczny, stosowany w leczeniu
nadpłytkowości samoistnej. Próbowano również stosować anagrelid w leczeniu
przewlekłej białaczki szpikowej. Anagrelid zsyntetyzowano pierwotnie jako lek
antyagregacyjny. Jego zdolność do zmniejszania poziomu
płytek krwi wykryto zupełnie przypadkowo, pod koniec lat 80. w trakcie prowadzenia badań nad jego skutecznością w hamowaniu agregacji trombocytów. Od 1997 roku anagrelid zarejestrowany jest w
USA jako lek przeznaczony do leczenia nadpłytkowości samoistnej. Synteza anagrelidu została opracowana przez firmę
Shire. Rozpoczyna się ona od reakcji
nitrowania 2,3-dichlorobenzaldehydu
mieszaniną nitrującą, której produktem jest 2,3-dichloro-6-nitrobenzaldehyd. Związek ten jest następnie
redukowany przez
NaBH4 w środowisku
metanolu, tworząc alkohol 2,3-dichloro-6-nitrobenzylowy, który w reakcji z
chlorkiem tionylu tworzy pochodną chlorku benzylu. Pochodna ta ulega kondensacji z estrem etylowym
glicyny w obecności
trietyloaminy dając 2-(2,3-dichloro-6-nitrobenzylamino)octan etylu. Redukcja
grupy nitrowej przy użyciu zakwaszonego
HCl roztworu wodnego
SnCl2 daje pochodną
aminową, którą następnie poddaje się
cyklizacji z bromkiem
cyjanku w
toluenie, tworząc 2-(5,6-dichloro-2-imino-1,2-dihydrochinazolin-3(4
H)-ylo)octan etylu. Związek ten jest ponownie cyklizowany, w środowisku wodnym z
trietyloaminą, dając anagrelid. Możliwa jest również synteza anagrelidu z 2,3-chloro-6-nitrobenzaldehydu, który kondensuje się z estrem etylowym glicyny w obecności
NaBH4, z pominięciem dwóch produktów przejściowych (pochodnej alkoholu nitrobenzylowego i chlorku benzylu).
Klatrat metanu (hydrat metanu, metanowy lód, wodzian metanu) – substancja krystaliczna złożona z cząsteczek
wody i
metanu.
Klatraty metanu zostały odkryte pod koniec XIX wieku (1888) wraz z hydratami etanu (C2H6), etylenu (C2H4) i podtlenku azotu (N2O) przez francuskiego fizyka Paula Villarda. W latach 30. XX wieku E.G. Hammerschmidt skojarzył po raz pierwszy biały, krystaliczny materiał zatykający rurociągi gazu z hydratami metanu. W ten sposób materiał pierwotnie uważany za ciekawostkę czysto laboratoryjną uzyskał znaczenie ekonomiczne.
W latach 60. XX wieku znaleziono złoża hydratów na
Syberii, a w następnym dziesięcioleciu znaczne ich ilości odkryto na
szelfach kontynentalnych. W 1981 roku statek wiertniczy
Glomar Challenger wydobył u wybrzeży
Gwatemali pierwszą próbkę klatratu. W 1996 roku załoga niemieckiego statku badawczego FS Sonne wydobyła 50 kg hydratów z dna
Pacyfiku w pobliżu
Oregonu. Obecnie rozważane jest wykorzystanie zasobów klatratu metanu jako potencjalnego źródła gazu ziemnego. W ciągu ostatnich parunastu lat, metan uwięziony w hydratach, zaczęto postrzegać również jako potencjalne źródło
zmian klimatu.
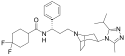
Marawirok (
łac.
maraviroc) –
organiczny związek chemiczny będący silnym, selektywnym, wolno oddysocjowującym
inhibitorem receptora CCR5 dla
chemokin, przeznaczony do leczenia chorych zakażonych wirusem
HIV-1. Marawirok należy do nowej grupy
leków przeciwretrowirusowych –
inhibitorów wejścia. Jest skuteczny jedynie w wypadku zakażenia wirusem HIV-1 wykazującym tzw. CCR5-tropizm, czyli takim, który wykorzystuje receptor CCR5 podczas wnikania do komórki. Nie wykazano, by marawirok indukował oporność na inne leki stosowane w leczeniu zakażeń HIV. Marawirok został wynaleziony przez firmę
Pfizer w trakcie szeroko zakrojonych poszukiwań substancji małocząsteczkowych będących tzw. inhibitorami wejścia. Jako że struktura CCR5 nie była wtedy znana, przebadano tysiące związków chemicznych w poszukiwaniu tych, które mogły być inhibitorami CCR5. Spośród znalezionych substancji, do dalszych badań wybrano jedną – UK-107543. Zsyntetyzowano niemal 1000 analogów UK-107543 oraz przebadano je pod kątem siły inhibicji oraz właśności farmakologicznych i farmakokinetycznych. Substancją o najlepszych właściwościach okazał się marawirok.
Projekt Chemia · Dyskusja Projektu Chemia