Rak jądra
| carcinoma testis | |
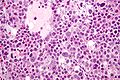
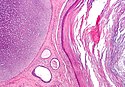
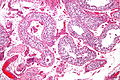
 Nasieniak jądra o wymiarach 7,4 × 5,5 cm w preparacie z orchidektomii przeprowadzonej u 27-letniego mężczyzny | |
| ICD-10 | C62 Nowotwór złośliwy jądra |
|---|---|
| C62.0 | Jądro niezstąpione |
| C62.1 | Jądro zstąpione |
| C62.9 | Jądro nieokreślone |
Rak jądra, ściślej nowotwory jądra – grupa pierwotnych nowotworów jądra wywodzących się z nabłonka rozrodczego (nowotwory germinalne, nowotwory zarodkowe) lub rzadziej z podścieliska gonad i sznurów płciowych (nowotwory niegerminalne). Nowotwory zarodkowe jądra na ogół są nowotworami o wysokiej złośliwości wcześnie dającymi przerzuty odległe, z kolei nowotwory z podścieliska gonad i sznurów płciowych zwykle są nowotworami łagodnymi. Ze względu na odmienną strategię leczenia nowotwory zarodkowe są dzielone na nasieniaki i nienasieniaki[1]. Nazwa „rak jądra” jest nazwą potoczną i nie jest poprawna, ponieważ nowotwory jądra zwykle wykazują pochodzenie germinalne, a nie z tkanki nabłonkowej[2].
Nowotwór najczęściej objawia się jako jednostronny, bezbolesny guz lub obrzęk w mosznie[3]. Podejrzenie choroby jest stawiane na podstawie typowego obrazu klinicznego choroby oraz wyniku badania ultrasonograficznego. Standardem jest wykonywanie u wszystkich chorych z podejrzeniem choroby nowotworowej jądra radykalnej operacji usunięcia jądra zwanej orchidektomią[4]. Materiał tkankowy uzyskany podczas orchidektomii poddaje się badaniu histopatologicznemu, co pozwala na ostateczne rozpoznanie nowotworu oraz określenie typu histologicznego[5].
Dalsze leczenie po wykonaniu orchidektomii zależy od rozpoznania histopatologicznego, zaawansowania choroby oraz stężenia określonych markerów po zabiegu operacyjnym. We wczesnym stadium, w zależności od rozpoznania histopatologicznego oraz stopnia zaawansowania, wykorzystuje się strategię wyłącznego aktywnego nadzoru lub stosuje się leczenie uzupełniające oparte o chemioterapię, radioterapię lub limfadenektomię. Chorzy z zaawansowaną chorobą wymagają chemioterapii opartej na cisplatynie[6].
Epidemiologia
Nowotwory jądra stanowią około 1% nowotworów złośliwych u mężczyzn[7][8][9][10]. Są najczęstszymi nowotworami złośliwymi u młodych mężczyzn, a u dzieci stanowią 9% wszystkich nowotworów[11]. Co roku na świecie rozpoznaje się około 55 000 przypadków nowotworów jąder i dochodzi do 10 000 zgonów z powodu tej choroby, co stanowi około 0,2% przypadków zgonów z powodu choroby nowotworowej[12]. W większości krajów zachodnich obserwuje się stały wzrost zapadalności na nowotwory jądra i przez ostatnie trzy dekady stwierdzono podwojenie zapadalności na tę chorobę[9][13]. Zapadalność jest szacowana na 3–10 nowych przypadków rocznie na 100 000[7][14][15].
Największa zapadalność dotyczy młodych mężczyzn pomiędzy 15. a 44. rokiem życia i w tej grupie wiekowej rozpoznaje się 84% przypadków nowotworów jądra[16]. Jedynie 1% przypadków stwierdza się przed 15. rokiem życia i 15% przypadków jest obserwowane u mężczyzn po 45 roku życia[16]. Szczyt zapadalności na nienasieniaki przypada na 20.–30. rok życia, a nasieniaki pomiędzy 30. a 40. rokiem życia[9], choć nasieniak spermatocytarny głównie dotyczy mężczyzn około 50–55. roku życia[17].
Nowotwory złośliwe jądra wykazują znaczne zróżnicowanie geograficzne i etniczne. Największą zapadalność notuje się w Europie i Ameryce Północnej (4–10 na 100 000), pośrednią zapadalność stwierdza się w Ameryce Środkowej i Południowej, a najniższą w Afryce i Azji (0,2–1 na 100 000). Szczególnie często nowotwory jądra pojawiają się w Europie Północnej z największą zapadalnością w Norwegii (10,5 na 100 000) i Danii (10,1 na 100 000)[18][19][20]. Niezależenie od regionu geograficznego i kraju obserwuje się różnice etniczne w zakresie częstości choroby, wyższe ryzyko dotyczy osób rasy białej, a niższe ryzyko obciąża osoby rasy czarnej czy żółtej[17].
W Polsce zapadalność jest niższa niż średnia europejska, co roku notuje się około 1100 zachorowań rocznie, co przekłada się na roczną zapadalność na poziomie 5,1 przypadków na 100 000[21].
Czynniki ryzyka
Do czynników ryzyka rozwoju nowotworu jądra należą[9][16]:
- wnętrostwo,
- wcześniejsze występowanie nowotworu jądra,
- występowanie nowotworu jądra u najbliższych krewnych,
- niepłodność,
- zaburzenia rozwoju płci,
- zespół Downa,
- zakażenie HIV.
Wnętrostwo
Wnętrostwo jest wadą rozwojową polegającą na niezstąpieniu do moszny jednego albo obu jąder, które pozostają w jamie brzusznej lub kanale pachwinowym[9]. Wnętrostwo jest najsilniejszym czynnikiem ryzyka zachorowania na nowotwór złośliwy jądra, zwiększającym ryzyko zachorowania od czterech do ośmiu razy[9]. Aż u 10% chorych z nowotworem jąder rozpoznano niezstąpienie jąder[16]. Operacja orchidopeksji przed rozpoczęciem dojrzewania pozwala zmniejszyć to ryzyko w porównaniu do osób, u których operacja nie została wykonana lub wykonano ją po okresie dojrzewania płciowego[9][22][23][24]. W metaanalizie Petterssona i współpracowników obserwowano 2,23-krotny wzrost ryzyka u osób z wykonaną orchidektomią przed 13. rokiem życia i 5,4-krotnie zwiększone ryzyko, gdy operacja była wykonana po 13. roku życia[23]. Badania wskazują, że ryzyko rozwoju nowotworu jądra jest również zwiększone po stronie przeciwnej do niezstąpionego jądra[25][9]. Nie jest jasne, w jaki sposób wnętrostwo ma przyczyniać się do rozwoju nowotworu tego narządu, wytłumaczeniem może być wspólna przyczyna obu chorób albo sprzyjanie nieprawidłowych warunków panujących w niezstąpionym jądrze rozwojowi nowotworu[9].
Wcześniejsze występowanie nowotworu jądra
Wcześniejsze występowanie nowotworu jądra jest silnym czynnikiem ryzyka rozwoju nowotworu po stronie przeciwnej w dotychczas zdrowym narządzie[22]. Ocenia się, że wcześniejsze występowanie nowotworu jądra dwunastokrotnie zwiększa ryzyko rozwoju kolejnego guza[26][22][9]. Ryzyko rozwoju guza metachronicznego w drugim jądrze jest oceniane od 2% do 5%[26][27][28][29].
Występowanie rodzinne
Rodzinne występowanie nowotworów jądra jest rzadkie i guzy jądra u chorych o pokrewieństwie I stopnia stanowią jedynie 1–2,8% przypadków nowotworów jąder[30][31][32][16]. Jednak występowanie nowotworu u ojca albo brata dziesięciokrotnie zwiększa ryzyko rozwinięcia tej choroby[9]. Ocenia się, że u braci osób dotkniętych nowotworem jądra ryzyko jest ośmiokrotnie większe niż w populacji ogólnej oraz czterokrotnie większe ryzyko niż ryzyko populacyjne u synów chorych na ten nowotwór[33][30][16]. Pomiędzy rodzeństwem ryzyko zachorowania jest większe w przypadku posiadania chorego brata bliźniaka niż pomiędzy braćmi niebędących bliźniętami[34][16], ale pomiędzy bliźniakami dwujajowymi ryzyko jest większe niż pomiędzy bliźniakami jednojajowymi, co może być związane z odmiennym stężeniem estrogenów podczas ciąży związanego z występowaniem dwóch łożysk[35][36][16].
Niepłodność
Wykazano związek pomiędzy występowaniem niepłodności u mężczyzn ze wzrostem ryzyka zachorowania na nowotwór jądra[37][38][39][22][16]. Nie jest jasne, czy oba zaburzenia mają wspólne czynniki etiologiczne, czy sama niepłodność jest elementem karcynogenezy tego nowotworu[9].
Zaburzenia rozwoju płci
Zaburzenia rozwoju płci (zaburzenia różnicowania płci) to grupa zaburzeń wrodzonych prowadzących do niezgodności pomiędzy płcią genetyczną, gonadalną, genitalną, fenotypową i psychiczną[40]. Niektóre zaburzenia rozwoju płci wiążą się z różnego stopnia zwiększonym ryzykiem rozwoju wewnątrzprzewodowej neoplazji komórek zarodkowych (testicular intratubular neoplasia) oraz nowotworów germinalnych, zarówno nienasieniaków, jak i nasieniaków[41].
Największe ryzyko niosą zaburzenia rozwoju płci z obecnym chromosomem Y w kariotypie, u których często obserwuje się dysgenezję gonad[42][43]. Dysgenezja gonad u chorych z kariotypem 46,XY lub 45,X/46,XY, gdy nie przeprowadzi się orchidektomii, wiąże się z około 30% ryzykiem rozwoju nowotworu jądra[44]. U chorych z mutacją WT1 – u 60% chorych z zespołem Frasier i 40% chorych zespołem Denysa-Drasha – dochodzi do rozwoju nowotworu jądra, przede wszystkim gonadoblastomy[45][46][44][47].
Zespół przetrwałych przewodów Müllera wiąże się ze zwiększonym ryzykiem nowotworu jądra w związku z częstym występowaniem wnętrostwa oraz ryzykiem transformacji struktur Müllerowskich[41]. W zespole całkowitej niewrażliwości na androgeny (CAIS) obserwuje się wysokie ryzyko rozwoju nowotworu w jądrze znajdującym się w jamie brzusznej, sięgające nawet 50%. Ryzyko powstania guza w jądrze znajdującym się w mosznie jest nieznane[41]. Niedobór dehydrogenazy 17β-hydroksysteroidowej również zwiększa ryzyko rozwoju nowotworu germinalnego[44]. U chorych z wrodzonym przerostem nadnerczy nie obserwuje się zwiększonego ryzyka rozwoju nowotworu jądra[41]. Istnieją sprzeczne dane dotyczące ryzyka rozwoju nowotworu jądra w zespole Klinefeltera, choć część badaczy wskazuje na zwiększenie ryzyka, to kilka badań przeczy temu[48][49][50][51][41].
Mikrozwapnienia w jądrach
Mikrozwapnienia w jądrach (microlithiasis) są bardzo często obserwowanymi zmianami w USG jąder, dotyczącymi od 0,5% do 6,7% mężczyzn[9]. Istnieją badania sugerujące wyższe prawdopodobieństwo rozpoznania nowotworu jądra u osób z mikrozwapnieniami w jądrach[52][53][22]. Mikrozwapnienia w jądrach nie są same w sobie czynnikiem ryzyka, a raczej są powiązane z nowotworem jąder[22]. W badaniu na 1500 mężczyznach z mikrozwapnieniami w jądrach po pięciu latach obserwacji jedynie u jednej osoby rozpoznano nowotwór jądra[54], co sugeruje, że u zdecydowanej większości mężczyzn z mikrozwapnieniami nie rozpozna się tego nowotworu[9].
Zespół Downa
U osób chorych na zespół Downa występuje zwiększone ryzyko zachorowania na nowotwory jąder[55][56][57].
Zakażenie HIV
U chorych z zakażeniem HIV częściej niż w populacji ogólnej występują nowotwory jądra. Zwiększone ryzyko dotyczy jedynie nasieniaków i nie potwierdzono zwiększonego ryzyka zachorowania na nienasieniaka[58][59][60][61]. Naturalny przebieg choroby jest podobny do populacji ogólnej bez zakażenia HIV[58].
Narażenie zawodowe
W badaniach epidemiologicznych nie rozpoznano jednoznacznie żadnego zawodu jako czynnika ryzyka zachorowania na nowotwór jądra[16]. Istnieją doniesienia o obserwowanym zwiększonym ryzyku u strażaków, pracowników przemysłu metalowego, skórzanego, lotniczego, papierowego oraz rolników[16].
Zapobieganie
Profilaktyka pierwotna
Profilaktyka pierwotna polega na zwalczaniu czynników ryzyka choroby. Nie ma znanych metod profilaktyki rozwoju nowotworu jądra[62][63][64]. Część znanych czynników ryzyka nowotworu jądra jest niemodyfikowalna, a ponadto nowotwór stosunkowo często rozwija się u chorych bez znanych czynników ryzyka[64].
Profilaktyka wtórna
Profilaktyka wtórna obejmuje wczesne rozpoznawanie choroby na podstawie badań przesiewowych. Obecnie nie ma wystarczających dowodów wspierających stosowanie badań przesiewowych w kierunku nowotworów jądra[65][66]. Nie opublikowano żadnych wyników randomizowanych badań klinicznych oceniających skuteczność badań przesiewowych w nowotworach jądra[67][68][66]. Nie wykazano zmniejszenia śmiertelności wśród mężczyzn poddanych badaniu przesiewowemu, przy jednoczesnym zwiększeniu liczby zbędnych procedur diagnostycznych z towarzyszącymi niepożądanymi następstwami[65][66]. Europejskie Towarzystwo Urologiczne u osób ze zwiększonym ryzykiem zachorowania zaleca samobadanie jąder[65].
Objawy
Nowotwór jądra najczęściej objawia się jako jednostronny, bezbolesny guz lub obrzęk w mosznie[3][69][70][71]. Chorzy mogą zauważać zmianę kształtu lub powierzchni zajętego jądra[72].
Ból w mosznie jest pierwszym objawem u około 20–30% chorych[73][19]. Dolegliwości najczęściej przyjmują charakter bólu tępego[19]. Dolegliwości mogą przybierać formę okresowego lub systematycznie nasilającego się dyskomfortu w mosznie[72]. Nagły silny ból pojawia się u około 10% chorych[19]. Nagły silny ból może być związany ze skrętem guza, krwawieniem do guza albo jego niedokrwieniem (zawałem)[70][74]. U 20% chorych z nowotworem jądra stwierdza się wodniak jądra[75]. U części chorych objawem nowotworu jadra jest nawracające zapalenie najądrzy lub jądra objawiające się bólem i obrzękiem narządu[76][72]. U 3% chorych pierwotnym objawem choroby nowotworowej jądra jest niepłodność[76].
Wydzielanie przez nowotwór β-hCG może skutkować ginekomastią lub tkliwością sutków[74][70]. Ginekomastia może dotyczyć około 7% chorych[73][72]. Bardzo wysokie stężenia β-hCG u chorych na nowotwór jądra rzadko jest przyczyną nadczynności tarczycy najczęściej objawiającej się tachykardią i nadciśnieniem tętniczym[77][78].
Przerzuty do węzłów chłonnych w jamie brzusznej mogą manifestować się jako ból pleców lub ból brzucha promieniujący do pleców[75][72][76]. Duszność, kaszel, ból w klatce piersiowej mogą wiązać się z przerzutami do płuc, z kolei przerzuty do kości powodują ból kostny, a przerzuty do centralnego układu nerwowego odpowiednie objawy neurologiczne[72][75][19]. Zaawansowanej chorobie mogą towarzyszyć utrata masy ciała, brak apetytu i złe samopoczucie[19].
W badaniu fizykalnym podczas palpacji jądra wyczuwalny jest guz, ponadto wyczuwalne mogą być powiększone węzły chłonne różnych grup i czasem duże masy węzłowe w przestrzeni zaotrzewnowej są macalne podczas palpacji brzucha[76].
Histopatologia
Nowotwory wywodzące się z nabłonka rozrodczego, czyli nowotwory germinalne (zarodkowe), stanowią zdecydowaną większość nowotworów jądra u ludzi (94–96%). Około 4–6% stanowią nowotwory ze sznurów płciowych i podścieliska, a pozostałe podtypy histologiczne są jeszcze rzadsze i łącznie rozpoznaje się je jedynie w 1% przypadków nowotworów jądra u ludzi[79]. Większość nowotworów germinalnych cechuje wysoka złośliwość i wczesne wytwarzanie przerzutów odległych, z kolei nowotwory ze sznurów płciowych i podścieliska na ogół są nowotworami łagodnymi, część z nich wykazuje aktywność hormonalną[1]. Nowotwory germinalne ze względów klinicznych są dzielone na nasieniaka i nienasieniaki. Nowotwory germinalne mogą się składać z jednego typu histologicznego lub tworzyć nowotwory mieszane zawierające przynajmniej dwa typy histologiczne[80].
Klasyfikacja WHO nowotworów jąder[81][82][83]:
- nowotwory germinalne (zarodkowe) (germ cell tumours):
- wewnątrzprzewodowa neoplazja komórek zarodkowych (ang. intratubular germ cell neoplasia, IGCN, ICD-O 9064/2),
- nowotwory z jednego utkania histologicznego:
- nasieniak (seminoma, 9061/3),
- nasieniak spermatocytarny (spermatocytic seminoma, 9063/3),
- rak zarodkowy (embryonal carcinoma, 9070/3),
- nowotwór pęcherzyka żółtkowego, nowotwór zatoki endodermalnej (yolk sac tumour, 9071/3),
- nowotwory trofoblastyczne:
- kosmówczak złośliwy (choriocarcinoma, 9100/3),
- guz miejsca łożyskowego (placental site trophoblastic tumour, 9104/1),
- potworniak (teratoma, 9080/3),
- potworniak dojrzały,
- potworniak niedojrzały,
- potworniak zawierający utkanie złośliwe typu somatycznego (teratoma with somatic type malignancies, 9084/3),
- torbiel skórzasta (dermoid cyst, 9084/0),
- nowotwory mieszane (tumours of more than one histological type [mixed forms]),
- nowotwory ze sznurów płciowych i podścieliska (sex cord/gonadal stromal tumours):
- nowotwór z komórek Leydiga (Leydig cell tumour, 8650/1),
- nowotwór z komórek Sertolego (Sertoli cell tumour, 8640/1),
- ziarniszczak (granulosa cell tumour, 8620/1),
- ziarniszczak typu dorosłych (adult type granulosa cell tumour, 8620/1),
- ziarniszczak typu młodzieńczego (juvenile type granulosa cell tumour, 8622/1),
- nowotwory z grupy otoczkowiak/włókniak (tumours of the thecoma/fibroma group),
- nowotwór podścieliskowy ze sznurów płciowych, typ mieszany (sex cord/gonadal stromal tumours, mixed forms, 8592/1),
- złośliwy nowotwór podścieliskowy ze sznurów płciowych (malignant sex cord/gonadal stromal tumours, 8590/3),
- nowotwór zawierający elementy utkania nowotworu germinalnego oraz nowotworu ze sznurów płciowych i podścieliska (tumours containing both germ cell and sex cord/gonadal stromal elements),
- rozrodczak zarodkowy (gonadoblastoma, 9073/1),
- guzy częściowo zróżnicowane (sex cord/gonadal stromal tumour incompletely differentiated, 8591/1),
- nowotwory przewodów zbiorczych i sieci jądra (tumours of collecting ducts and rete),
- nowotwory struktur okołojądrowych (tumours of paratesticular structures),
- nowotwory układu krwiotwórczego (haematopoietic tumours),
- nowotwory mezenchymalne (mesenchymal tumours of the spermatic cord and testicular adnexae),
- inne nowotwory jądra (miscellaneous tumours of the testis).
Wewnątrzprzewodowa neoplazja komórek zarodkowych
Wewnątrzprzewodowa neoplazja komórek zarodkowych jest uważana za zmianę prekursorową niemal wszystkich inwazyjnych nowotworów jądra, prawdopodobnie z wyjątkiem nasieniaka spermatocytarnego, nowotworu pęcherzyka żółtkowego u dzieci oraz potworniaka u dzieci[84].
Wewnątrzprzewodowa neoplazja komórek zarodkowych towarzyszy ponad 80% przypadków nowotworów jądra[85]. Stwierdza się ją w u 5–8% dorosłych z wnętrostwem oraz u 5% chorych na nowotwór jądra w jądrze przeciwnym[84]. Ocenia się, że 50% przypadków wewnątrzprzewodowej neoplazji komórek zarodkowych w ciągu pięciu lat ulega progresji do nowotworu inwazyjnego[86][84].
W obrazie mikroskopowym komórki nowotworowe są większe niż prawidłowe spermatogonium, zawierają obfitą ilość jasnej cytoplazmy bogatej w glikogen oraz okrągłe hiperchromatyczne jądro komórkowe[87][84]. Komórki nowotworowe są rozmieszczone pomiędzy komórkami Sertolego, a spermatogeneza jest nieobecna[87].
Nasieniak
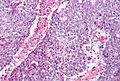
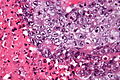
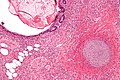
Nasieniak stanowi około 40–50% nowotworów germinalnych jądra u ludzi[88][89]. Makroskopowo zajęte przez nasieniak jądro jest powiększone, choć możliwe jest występowanie nowotworu w jądrze atroficznym[90]. Guz stanowi miękką masę o budowie jednorodnej lub drobnoguzkowej[91]. Powierzchnia przekroju jest koloru szarego, kremowego lub bladoróżowego. Mogą być obecne ogniska martwicy[90].
Mikroskopowo utkanie guza tworzą jednolite komórki nowotworowe ułożone w rozproszone arkusze, które mogą być dzielone przez cienkie przegrody łącznotkankowe na płaty. Okazjonalnie komórki układają się w kolumny albo gniazda[92]. Komórki nowotworowe są duże, mogą być okrągłe lub wieloboczne[91]. Zawierają umiarkowaną ilość eozynofilnej bladej cytoplazmy zawierającej glikogen oraz lipidy, jądra komórkowe są duże, okrągłe, zawierają jąderka, które mogą przybierać kształt pręcików, granice komórek są wyraźne[92][90]. Liczba mitoz jest zmienna, jednak zwykle jest wyraźna[90][92].
W obrębie przegród łączonotkankowych, a rzadziej pomiędzy komórkami nowotworowymi, obecny jest naciek złożony przede wszystkim z limfocytów, a czasem również z eozynofilów lub plazmocytów[90][92]. W 30–50% guzów obecna jest wyraźna reakcja ziarniniakowa[92][93]. Nowotwór powoduje zniszczenie prawidłowego miąższu jądra, który może być obecny na obwodzie zmiany[92].
Nasieniak spermatocytarny
Nasieniak spermatocytarny jest stosunkowo rzadkim nowotworem i stanowi jedynie od 1% do 4,5% przypadków nowotworów jądra u ludzi[94]. Klinicznie nasieniak spermatocytarny wykazuje wiele cech wspólnych z nasieniakiem, jednak nowotwór występuje głównie u osób około 50. roku życia, a więc starszych niż w przypadku nasieniaka[95]. Pierwotną lokalizacją nasieniaka spermatocytarnego jest wyłącznie jądro[94]. Zwykle występuje jednostronnie, choć u 9% chorych jest on obustronny, najczęściej jako guz metachroniczny[95][94]. Nowotwór nie wchodzi w skład guzów mieszanych[96].
Makroskopowo nasieniak spermatocytarny zwykle tworzy dobrze odgraniczone duże guzy, średnio o 7 cm średnicy[94][97]. Nowotwór na przekroju jest miękki, kruchy, koloru jasnoszarego[96]. Występują ogniska krwotoczne, śluzowe oraz torbielowate[96][94].
Mikroskopowo obraz utkania jest zróżnicowany[96]. Komórki są ułożone w arkusze, czasem obecne jest skąpe podścielisko łącznotkankowe. Nasieniak spermatocytarny budują trzy typu komórek: małe komórki podobne do limfocytów, komórki średniej wielkości oraz komórki olbrzymie[96][98]. Małe komórki przypominające limfocyty posiadają pyknotyczne jądro komórkowe z gęstą chromatyną i zawierają skąpą ilość cytoplazmy[98][94]. Komórki o średniej wielkości są dominującym typem komórek, cechują się okrągłym kształtem, posiadają okrągłe jądro komórkowe z delikatną chromatyną. Zawartość eozynofilnej cytoplazmy jest zmienna, cytoplazma nie zawiera glikogenu[98]. Komórki olbrzymie są jednojądrowe lub rzadko wielojądrowe, jądro komórkowe jest okrągłe lub nieregularne[94]. Naciek limfocytarny jest nieobecny lub skąpy, podobnie reakcja ziarniniakowa jest rzadka[98]. Mitozy są częste, możliwa jest obecność atypowych mitoz[98][94].
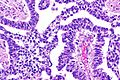
Rak zarodkowy
Rak zarodkowy jest to nowotwór germinalny złożony z niezróżnicowanych komórek nabłonkowych[99][98]. Czysty rak zarodkowy jest rzadki, ponieważ stanowi jedynie 2–3% guzów jądra u ludzi, jednak rak zarodkowy bardzo często wchodzi w skład guzów mieszanych i jest rozpoznawany w 90% przypadków takich mieszanych nowotworów jądra[98][91]. Nowotwór dotyczy głównie mężczyzn pomiędzy 20. a 30. rokiem życia[98].
Makroskopowo rak zarodkowy zwykle jest mniejszy niż nasieniak, średnia średnica przy rozpoznaniu wynosi około 4 cm[99][91]. Guz powoduje powiększenie jądra i zniekształcenie obrysu narządu[99]. Guz jest miękki, o ziarnistej strukturze, na przekroju jest szaro-białawy do różowego lub jasnobrązowego[99]. Często są ogniska martwicy i krwotoczne[99][91]. Makroskopowo granice guza są rozmyte[98]. W 20% guzów widoczne jest szerzenie się guza w kierunku najądrzy lub przekraczanie błony białawej[100].
W obrazie mikroskopowym rak zarodkowy cechuje się zróżnicowanym wzorem utkania i często w obrębie jednego guza widoczne jest kilka wzorów architektonicznych[98]. Komórki nowotworowe mogą tworzyć wzór lity zbudowany ze ściśle ułożonych komórek w arkusze z obecnymi obszarami martwicy[98][101]. Wzór lity jest obecny niemal we wszystkich rakach zarodkowych[98]. Typ gruczołowy jest obecny w trzech czwartych przypadków raka zarodkowego, jest utworzony przez wytworzenie cewek, pęcherzyków lub gruczołów wyścielonych nabłonkiem sześciennym lub walcowatym[101]. Rzadszym wzorem jest typ brodawkowaty związany z obecnością w architekturze guza struktur brodawkowatych[101].
Tworzące rak zarodkowy komórki nowotworowe są niezróżnicowane, mają wygląd komórek nabłonkowych i przypominają komórki tworzące bardzo wczesny zarodek[99]. Komórki są duże, a niekiedy olbrzymie, wieloboczne, czasem walcowate[101][99]. Jądra komórkowe są duże, hiperchromatyczne, mają nieregularne, duże grudy chromatyny, występuje jedno lub więcej dużych jąderek[101][99][102]. Cytoplazma jest obfita, drobnoziarnista, bazofilna lub amfifilowa, rzadziej jasna[99][102]. Granice komórek są rozmyte[102]. Mitozy są liczne, często są obecne jej nieprawidłowe formy[103]. Na obrzeżach zmiany mogą być obecne komórki przypominające syncytiotrofoblast[102]. Ilość zrębu jest zmienna, w litym wzorze utkania jest skąpa, a na obrzeżach zmiany guz jest bardziej włóknisty, mniej lub bardziej komórkowy bez nacieku limfocytarnego[103]. W pozostałym miąższu jądra często obserwuje się wewnątrzprzewodową neoplazję komórek zarodkowych[102].
Nowotwór pęcherzyka żółtkowego
Nowotwór pęcherzyka żółtkowego (nowotwór zatoki endodermalnej, rak pęcherzyka żółtkowego, rak zarodkowy typu dziecięcego, rak dziecięcy zarodkowy) to nowotwór, w którym komórki nowotworowe różnicują się w kierunku pęcherzyka żółtkowego. Nowotwór może występować u małych dzieci oraz dojrzałych płciowo mężczyzn[103]. U dzieci nowotwór występuje w postaci czystej, bez domieszki komponentu innych nowotworów zarodkowych i jest to najczęstszy nowotwór germinalny w tej grupie wiekowej, ponieważ stanowi 80% takich guzów[104]. Występuje w okresie od urodzenia do około 8. roku życia, średnio pojawia się około 18. miesiąca życia[104][105]. U dorosłych najczęściej występuje pomiędzy 17. a 40. rokiem życia, stanowi niemal wyłącznie komponent mieszanego guza germinalnego i jest obecny w 44% przypadków takich mieszanych nowotworów germinalnych[104]. U dzieci nowotwór pęcherzyka żółtkowego ma przebieg nieco odmienny niż u dorosłych, w 85% przypadków jest ograniczony do jądra i rzadziej daje przerzuty odległe do zaotrzewnowych węzłów chłonnych, a częściej do płuc[104].
Makroskopowo czysty nowotwór pęcherzyka żółtkowego jest miękki, na przekroju powierzchnia jest szarobiała lub jasnoszara, wydaje się być galaretowata lub śluzowa[106].
Mikroskopowo guz pęcherzyka żółtkowego prezentuje liczne odmienne wzory architektoniczne i cytologiczne[107][108]. Zwykle w obrębie jednego guza widoczne jest kilka wzorów utkania, które mogą występować w porównywalnych proporcjach, ale czasem jeden z nich może dominować[107].
- Wzór mikrotorbielkowaty (microcystic/reticular pattern)
Jest to najczęstszy wzór utkania, cechuje się występowaniem komórek z wyraźnymi wakuolami, które tworzą obraz siatki czy plastru miodu z widocznymi sznurami małych komórek i wolnych przestrzeni. Komórki nowotworowe są małe, mogą być ściśnięte przez duże wakuole, jadra komórkowe są małe[107][108].
- Wzór torbielowaty (macrocystic pattern)
W utkaniu widoczne są liczne cienkościenne przestrzenie o różnych rozmiarach[107]. Wzór wynika z połączenia mikrotorbieli[108].
- Wzór lity (solid pattern)
Lity wzór utkania budują ściśle przylegające arkusze wielobocznych komórek z wyraźną eozynofilną lub jasną cytoplazmą, wyraźnymi jednolitymi jądrami komórkowymi. Aktywność mitotyczna jest wysoka[107][108].
- Wzór gruczołowo-pęcherzykowy (glandular-alveolar pattern)
Wzór utkania składa się z nieregularnych pęcherzyków, struktur podobnych do gruczołów czy cewek wyłożonych płaskimi, sześciennymi lub wielobocznymi komórkam[107][108].
- Wzór zatoki endodremalnej (endodermal sinus pattern)
W utkaniu widoczne są struktury nazywane ciałkami Schiller-Duvala zbudowane z centralnego naczynia otoczonego luźną tkanką łączną i sześciennymi albo walcowatymi komórkami nowotworowymi z jasną cytoplazmą i wyraźnymi jądrami. Są one otoczone przez przestrzenie torbielowate wyłożone płaskim nabłonkiem[107][108]. Ciałka Schiller-Duvala są uważane za charakterystyczną cechę guza zatoki endodermalnej, ale ich nieobecność nie wyklucza rozpoznania tego nowotworu[107].
- Wzór brodawkowaty (papillary pattern)
Utkanie tworzą małe, nieregularne brodawki widoczne w przestrzeniach torbielowatych. Brodawki są złożone z rdzenia z tkanki łącznej wyłożonego komórkami nowotworowymi[107][108].
- Wzór śluzowy (myxoid pattern)
Utkanie tworzą rzadkie sznury, pasma lub pojedyncze komórki w obrębie obfitego podścieliska śluzowego[107][108].
- Wzór wielopęcherzykowy (polyvesicular vitelline pattern)
Utkanie budują pęcherzyki lub torbiele o różnym kształcie i wielkości, wyłożone spłaszczonymi lub walcowatymi komórkami, pęcherzyki są otoczone tkanką łączną o różnym stopniu komórkowości[107][108].
- Wzór wątrobiakopodobny (hepatoid pattern)
Ten wzór utkania występuje w 20% nowotworów pęcherzyka żółtkowego. W utkaniu są obecne komórki przypominające hepatocyty, z obfitą eozynofilną cytoplazmą, centralnie położonym dużym jądrem komórkowym i wyraźnym jąderkiem. Komórki są ułożone w gniazda, cewki lub beleczki[108].
Rak kosmówki
Rak kosmówki (kosmówczak, nabłoniak kosmówkowy) to nowotwór o wysokiej złośliwości różnicujący się w kierunku syncytiotrofoblastu, cytotrofoblastu i pośrednich komórek trofoblastycznych[109]. Czysty kosmówczak jest rzadkim nowotworem, stanowi mniej niż 0,5–1% nowotworów jądra u ludzi, a w postaci mieszanej jest składnikiem 8–16% nowotworów zarodkowych jądra[109][110][111]. Chorują głównie mężczyźni w wieku 25–30 lat. W przeciwieństwie do innych nowotworów germinalnych jądra kosmówczak jest często rozpoznawany w fazie rozsiewu, a sam guz jądra może być niebadalny palpacyjnie. Guz może się rozsiewać drogą naczyń chłonnych oraz drogą krwionośną[109][110]. Przerzuty najczęściej stwierdza się w płucach, wątrobie, śledzionie, przewodzie pokarmowym, mózgu i nadnerczach[109]. Możliwa jest obecność przerzutów odległych bez zmian w węzłach chłonnych[110].
Makroskopowo kosmówczak zwykle daje stosunkowo niewielkie guzy i jądro może nie być powiększone[110][111]. Guz jest miękki, na przekroju występują rozległe obszary martwicy i krwotoczne, a na obrzeżach może być szarobrązowy[110].
W obrazie mikroskopowym są widoczne rozległe obszary martwicy i obszary krwotoczne, a obszary z żywą tkanką nowotworową mogą być niewielkie[110]. Czasami guz ulega w całości martwicy i w miejscu guza pierwotnego obecna jest jedynie blizna[111]. Utkanie guza w różnych proporcjach tworzą komórki syncytiotrofoblastu i cytotrofoblastu[109]. Komórki syncytiotrofoblastu są duże, wielojądrzaste, nieregularnego kształtu, jądra są nieregularnego kształtu, hiperchromatyczne, komórki zawierają obfitą ilość eozynofilnej do amfifilowej cytoplazmy[109][111]. Komórki cytotrofoblastu są jednojądrzaste, wielobocznego kształtu, mają amfifilową cytoplazmę, cechują się łagodnym do umiarkowanego pleomorfizmem jądra komórkowego[110][111].
W lepiej zróżnicowanych obszarach guza gniazda komponentu cytotrofoblastycznego są przykryte przez komponent syncytiotrofoblastyczny, co może przypominać utkanie widoczne w niedojrzałych kosmkach łożyska[109][110]. W innych przypadkach obserwuje się losowe mieszanie się obu tych komponentów[110]. Rzadko obserwuje się jedynie składnik cytotrofoblastyczny, a komponent syncytiotrofoblastyczny jest w niewielkim stopniu reprezentowany[109]. Cytotrofoblast wykazuje wysoką aktywność mitotyczną, podczas gdy syncytiotrofoblast jest nieaktywny mitotycznie[110]. Inwazja naczyń jest wyraźna i częsta[109].
Potworniak

Potworniak jest to nowotwór germinalny wykazujący cechy różnicowania w kierunku kilku tkanek somatycznych reprezentujących różne listki zarodkowe[112][111]. Nowotwór może składać się z dobrze zróżnicowanych tkanek lub wykazywać obecność tkanek przypominających płód[112].
Potworniak występuje w dwóch grupach wiekowych. U dzieci potworniaki zwykle występują w postaci czystej, stanowią 14–20% guzów germinalnych i są to drugie co do częstości nowotwory zarodkowe jądra w tej grupie wiekowej[113][111]. U 65% dzieci guz pojawia się pomiędzy 1. a 2. rokiem życia, średnio około 20. miesiąca życia[112]. Występowanie po 4. roku życia jest rzadkie[113]. U dorosłych czysty potworniak nie jest częsty, stanowi około 2,7–7% guzów germinalnych jądra, przy czym w postaci mieszanej dotyczy około 50% przypadków guzów mieszanych[112]. U dorosłych nawet czysty dojrzały potworniak ma potencjał złośliwy[113]. Przerzuty czystego potworniaka mogą być potworniakiem lub zawierać komponent niepotworniakowy[113].
Makroskopowo są to zwykle duże guzy, na przekroju mogą być lite lub zawierać torbiele[114][111]. W zależności od obrazu mikroskopowego i stopnia zróżnicowania wyróżnia się potworniaka dojrzałego, potworniaka niedojrzałego i potworniaka z przemianą złośliwą[115][111].
Potworniak dojrzały buduje mieszanina dojrzałych tkanek pochodzenia endodermalnego, mezodermalnego i ektodermalnego[111]. Zatem w utkaniu guza możliwe jest występowanie takich tkanek jak gruczoły, nabłonek oskrzela, nabłonek przewodu pokarmowego, nabłonek dróg moczowych, skóra, pnie nerwowe, chrząstka, pasma mięśni gładkich, kość czy zęby[111][115]. Potworniak dojrzały częściej występuje u dzieci, ale może on występować także u dorosłych[111].
Torbiel skórzasta jest to odmiana potworniaka dojrzałego, która w jądrze jest bardzo rzadkim rozpoznaniem. Makroskopowo jest to pojedyncza torbiel wypełniona żółtą, tłustą masą. W obrazie mikroskopowym torbiel wyściela nabłonek wielowarstwowy płaski z obecnością włosów i gruczołów łojowych, a zawartość torbieli jest utworzona przez złuszczony nabłonek i keratynę[111][116].
Potworniak niedojrzały, obok dojrzałych tkanek, w utkaniu zawiera niedojrzałe tkanki przypominające tkanki płodowe[117]. Tkanki płodowe pochodzą z trzech listków zarodkowych[115] i mogą być reprezentowane przez takie tkanki jak neuroepithelium, blastema, niedojrzała chrząstka czy niedojrzałe gruczoły[111].
Potworniak zawierający utkanie złośliwe typu somatycznego w swoim utkaniu zawiera komponent złośliwy spotykany zwykle w innych strukturach. Najczęściej spotyka się mięsaki, szczególnie mięsak prążkowanokomórkowy, chrzęstniakomięsak, kostniakomięsak, niezróżnicowany mięsak pleomorficzny, złośliwy nowotwór osłonek nerwów obwodowych i prymitywny guz neuroektodermalny[118]. W znacznie mniejszym stopniu z tym potworniakiem wiążą się raki, które mogą być reprezentowane przez gruczolakoraki, raki płaskonabłonkowe i raki neuroendokrynne[117][118].
Mieszane nowotwory zarodkowe jądra
Są to nowotwory jądra składające się z co najmniej dwóch typów histologicznych[119]. Mieszane guzy zarodkowe jądra stanowią 30–50% nowotworów germinalnych jądra[119][120]. Do najczęstszych połączeń należą połączenie raka zarodkowego z potworniakiem, połączenie raka zarodkowego z nasieniakiem oraz połączenie raka zarodkowego, nowotworu pęcherzyka żółtkowego i potworniaka[120][121]. U dzieci mieszane nowotwory germinalne bardzo rzadko występują przed wiekiem dojrzewania[119][120]. U dorosłych średnia wieku zachorowania wynosi około 30 lat[120].
Obraz makroskopowy może odzwierciedlać budowę z kilku składników, powierzchnia cięcia jest niejednorodna, mogą występować obszary martwicy i krwotoczne[119][120].
W obrazie mikroskopowym występują różne typy histologiczne nowotworów zarodkowych w dowolnej kombinacji, a utkania poszczególnych budujących guz komponentów nie różnią się od postaci czystych[122][120]. Ze względów rokowniczych istotny jest wzajemny stosunek poszczególnych elementów[120]. W blisko 50% przypadków obecny jest rak zarodkowy oraz potworniak, w 40% spotyka się nowotwór pęcherzyka żółtkowego, a w 40% przypadków stwierdza się obecność komórek syncytiotrofoblastycznych[122].
Odmianą postaci mieszanych nowotworów zarodkowych jest wielozarodkowiak (polyembryoma), który jest zbudowany z ciałek embrionalnych utworzonych przez raka zarodkowego oraz nowotworu pęcherzyka żółtkowego. Ciałka embrionalne w centralnej części posiadają warstwę komórek raka zarodkowego przypominających płytkę zarodkową, do którego wpuklają się pęcherzyk zbudowany z nowotworu pęcherzyka zarodkowego przypominający zarodkowy pęcherzyk żółtkowy oraz drugi pęcherzyk zbudowany z płaskich komórek przypominający owodnię. Ciałko embrionalne jest otoczone luźną tkanką łączną podobnej do pozazarodkowej mezenchymy[121][123].
Nowotwory ze sznurów płciowych i podścieliska
Nowotwory ze sznurów płciowych i podścieliska stanowią około 4–6% guzów jądra u dorosłych oraz około 20–30% guzów jądra u dzieci[124][125]. Nowotwory z tej grupy mogą występować w formie czystej lub mieszanej[121]. Około 10% przypadków nowotworów ze sznurów płciowych i podścieliska daje przerzuty odległe[124].
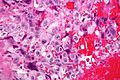
Nowotwór z komórek Leydiga
Nowotwór z komórek Leydiga jest nowotworem złożonym z elementów różnicujących się w kierunku komórek Leydiga[124]. Jest to najczęstszy nowotwór ze sznurów płciowych i podścieliska, stanowi około 1–3% guzów jąder u dorosłych[124]. Nowotwór z komórek Leydiga może pojawić się w dowolnym wieku, ale obserwuje się dwa szczyty zapadalności[126]. Pierwszy szczyt zapadalności występuje u chłopców przed wiekiem dojrzewania płciowego, najczęściej pomiędzy 3. a 9. rokiem życia, w tej grupie wiekowej spotyka się około 20% tych guzów[124][126]. Kolejny szczyt zapadalności obserwuje się pomiędzy trzecią a szóstą dekadą życia[124]. Około 10% nowotworów z komórek Leydiga wykazuje przebieg złośliwy[121]. Guzy z komórek Leydiga są hormonalnie czynne i mogą wydzielać testosteron, androstendion i dehydroepiandrosteron, a czasem również estrogeny[124].
Makroskopowo guzy są nieduże, dobrze odgraniczone, powierzchnia cięcia jest koloru żółto-brązowego[127][121]. W obrazie mikroskopowym nowotwór jest zbudowany z wielobocznych komórek z okrągłymi jądrami komórkowymi, zawierających obfitą ilość eozynofilnej cytoplazmy, która może zawierać wodniczki albo, w związku z zawartością lipidów, przybierać pienisty wygląd. W przypadku złośliwych nowotworów z komórek Leydiga guzy są większe, wykazują wyraźną atypię, większą aktywność mitotyczną i inwazję naczyń[127].
Nowotwór z komórek Sertolego
Nowotwór z komórek Sertolego jest nowotworem wykazującym cechy różnicowania w kierunku komórek Sertolego[128]. Nowotwór z komórek Sertolego stanowi mniej niż 1% nowotworów jądra u ludzi, zwykle pojawia się u osób dorosłych i średnia wieku w chwili rozpoznania wynosi 45 lat, a przed 20. rokiem życia nowotwór jest rzadki[128]. Nowotwór z komórek Sertolego bardzo rzadko wykazuje aktywność hormonalną[129][128].
Makroskopowo nowotwór z komórek Sertolego najczęściej jest niewielkim, dobrze odgraniczonym guzem, na przekroju szaro-białawym[121]. W obrazie mikroskopowym w utkaniu komórki nowotworowe tworzą cewki i beleczki położone we włóknistym podścielisku[121]. Cewki różnią się wielkością i kształtem, mogą być lite lub puste[129][128]. Komórki nowotworowe są jednolite, mają owalne lub wydłużone jądro komórkowe i eozynofilną do bladej cytoplazmę[128]. Złośliwy nowotwór z komórek Sertolego występuje bardzo rzadko[130].
Ziarniszczak
Ziarniszczak jest to nowotwór morfologicznie przypominający znacznie częściej występującego ziarniszczaka jajnika. Ze względów histopatologicznych i klinicznych wyróżnia się postać typu dorosłych i typu młodzieńczego[130].
Ziarniszczak typu dorosłych jest wyjątkowo rzadkim nowotworem. Występuje pomiędzy 20. a 50. rokiem życia, u około 20% chorych występuje ginekomastia[131]. W obrazie mikroskopowym spotyka się kilka wzorów utkania: drobnopęcherzykowy, wielkopęcherzykowy, beleczkowy, wyspowy i lity. Wzór drobnopęcherzykowy jest najczęstszy[132]. W utkaniu wzoru drobnopęcherzykowego obecne są ciałka Call-Exnera, utworzone przez okrągłe lub owalne komórki zawierające skąpą ilość cytoplazmy oraz owalne albo wydłużone jądro komórkowe przypominające ziarno kawy. W centrum ciałek Call-Exnera znajduje się eozynofilny materiał otoczony przez komórki nowotworowe[132][133]. Mitozy są rzadkie[132].
Ziarniszczak typu młodzieńczego jest to nowotwór, którego budowa przypomina pęcherzyki Graafa[132]. Typ młodzieńczy występuje głównie u niemowląt, najczęściej do 6 miesiąca życia[131], a występowanie nowotworu po 1. roku życia jest mało prawdopodobne[132]. Nowotwór często dotyczy chorych z dysgenezją jąder lub wnętrostwem[132]. Klinicznie manifestuje się jako guz jądra lub w obrębie jamy brzusznej, wykazuje tendencję do pojawiania się w lewym jądrze[132].
Makroskopowo guzy są częściowo torbielowate z obszarami litymi oraz częściowo otorebkowane[132]. W obrazie mikroskopowym występują torbiele wyłożone kilkoma rzędami komórek, których zewnętrzne warstwy przypominają komórki tekalne, a wewnętrzne warstwy komórki ziarniste. Komórki podobne do komórek ziarnistych są okrągłe, mają euchromatyczne jądro i skąpą ilość cytoplazmy, z kolei komórki podobne do komórek tekalnych są wydłużone i posiadają skąpą ilość cytoplazmy[132]. Pęcherzyki różnią się wielkością, zawierają eozynofilny lub bazofilny płyn[134].
Włókniak i otoczkowiak
Włókniak i otoczkowiak są rzadkimi nowotworami jądra przypominającymi ich odpowiedniki spotykane w jajniku. Makroskopowo guz jest twardą, dobrze odgraniczoną zmianą koloru żółtobiałego do białego. W obrazie mikroskopowym guz jest utworzony przez wrzecionowate komórki ułożone w pęczki lub wirowato. Podścielisko tworzą włókna kolagenowe, komórkowość zrębu różni się w poszczególnych guzach. Mitozy są rzadkie[135].
Rozrodczak zarodkowy
Rozrodczak zarodkowy (gonadoblastoma) to guz zbudowany z komórek podobnych do nasieniaka oraz komórek podobnych do komórek Sertolego[136]. Nowotwór jest związany z mieszaną dysgenezją gonad, w której jednostronnie lub obustronnie występuje pasmo łącznotkankowe (streak gonads)[137]. Rozrodczak zarodkowy zwykle jest rozpoznawany przed 20. rokiem życia, 80% chorych wykazuje fenotypową płeć żeńską[138].
Guzy mogą mierzyć kilka milimentrów do kilku centymetrów, są koloru żółtego do szarobrązowego. Utkanie budują niedojrzałe komórki podobne do komórek Sertolego oraz komórki podobne do nasieniaka. Wyróżnia się kilka wzorów utkania rozrodczaka zarodkowego. W najczęstszym komórki podobne do komórek Sertolego są otoczone przez złogi hialinowe, w drugim wzorze komórki podobne do komórek Sertolego są otoczone przez duże komórki germinalne, w trzecim wzorze utkania duże komórki germinalne znajdują się w centrum gniazd, wokół których są rozmieszczone komórki podobne do komórek Sertolego[136].
Nowotwory przewodów zbiorczych i sieci jądra
Grupa obejmuje nowotwory łagodne i złośliwe. Do nowotworów łagodnych zalicza się gruczolaka, torbielakogruczolaka, gruczolakowłókniaka, hiperplazję gruczołową[139]. Gruczolakorak sieci jądra jest pierwotnym nowotworem złośliwym pochodzenia nabłonkowego i z definicji nie może współwystępować inny nowotwór germinalny i niegerminalny jądra[140]. Do rozpoznania konieczne jest także stwierdzenia przejścia z prawidłowej, niedotkniętej sieci jądra[139]. Gruczolakorak sieci jądra jest rzadkim nowotworem, dotyczy osób po 40. roku życia, a głównie po 60. roku życia[139]. W obrazie makroskopowym guz tworzy twardą, gumiastą, bladą masę, która może być słabo odgraniczona od prawidłowej tkanki jądra[141]. Mikroskopowo w utkaniu może występować lity, cewkowy, brodawkowaty, sitowaty utworzony przez komórki sześcienne lub walcowate[139].
Nowotwory struktur okołojądrowych
- Nowotwór gruczołowaty
Jest to łagodny nowotwór zbudowany z komórek międzybłonka, cechujący się obecnością w utkaniu struktur przypominających gruczoły. Nowotwór jest najczęstszym guzem przydatków jąder. Może pojawiać się w dowolnym wieku, przy czym większość pojawia się pomiędzy trzecią a piątą dekadą życia[142]. Zwykle są to małe, dobrze ograniczone guzy. Utkanie tworzą eozynofilowe komórki międzybłonka układające się w sznury lub szerokie cewki przypominające gruczoły[142].
- Międzybłoniak struktur okołojądrowych
Jest to nowotwór złośliwy pochodzący z osłonki pochwowej lub błony białawej jądra. Międzybłoniaki struktur okołojądrowych są bardzo rzadkie, choć stanowią drugi pod względem częstości po mięsakach nowotwór złośliwy struktur okołojądrowych. Większość zachorowań przypada pomiędzy 55. a 75. rokiem życia, choć możliwe jest występowanie przed 25. rokiem życia[143].
Makroskopowo nowotwór może powodować pogrubienie osłonki pochwowej. W obrazie mikroskopowym najczęściej spotyka się postać nabłonkową, rzadziej mieszaną i mięsakowatą. W postaci nabłonkowej występują struktury brodawkowate lub cewkowo-brodawkowate ze współistniejącymi litymi sznurami komórek. Komórki tworzące są okrągłe lub sześcienne, z kolei gdy budują sznury ich kształt i wielkość pozostają zmienne. Postać mięsakowata jest utkana z komórek wrzecionowatych, które mogą tworzyć wzór wirowaty[143].
- Gruczolakorak najądrza
Gruczolakorak najądrza jest bardzo rzadkim nowotworem złośliwym pochodzenia nabłonkowego i opisano jedynie pojedyncze przypadki tej choroby. Makroskopowo jest to kilkucentymetrowy brązowy lub szarobiały guz, mogą być widoczne obszary martwicy i krwotoczne. W obrazie mikroskopowym może występować cewkowy, cewkowo-brodawkowaty, brodawkowaty lub pęcherzykowy wzór utkania. Komórki nowotworowe mogą być walcowate lub sześcienne zawierające jasną cytoplazmę[144].
- Torbielakogruczolak surowiczy brodawkowaty
Jest to rzadki nowotwór pochodzenia nabłonkowego występujący w przewodzie najądrza. Obserwuje się go u 17% chorych na zespół von Hippla-Lindaua. W obrazie mikroskopowym występuje poszerzenie przewodu najądrza oraz tworzenie brodawek. Przewody są wyłożone nabłonkiem sześciennym lub walcowatym z jasną cytoplazmą, a brodawki proste albo złożone powstają ze ścian przewodów[145].
- Guz neuroektodermalny barwnikowy
Guz neuroektodermalny barwnikowy w najądrzu jest bardzo rzadkim nowotworem występującym głównie u niemowląt. Makroskopowo są to twarde kilkucentymetrowe guzy o szarobiałej powierzchni przekroju. W obrazie mikroskopowym występują dwa typy komórek. Komórki nabłonkowate zawierają melaninę i tworzą gniazda, sznury lub struktury gruczołowe. Drugi typ komórek to komórki podobne do neuroblastów[146].
- Mięsaki
Najczęstszymi mięsakami struktur okołojądrowych są desmoplastyczny guz drobnookrągłokomórkowy, tłuszczakomięsak, mięśniakomięsak prążkowanokomórkowy i mięśniakomięsak gładkokomórkowy[147].
Historia naturalna choroby
Historia naturalna poszczególnych typów histologicznych nowotworów jądra wykazuje pewne zróżnicowanie, przy czym nienasieniaki odznaczają się bardziej agresywnym przebiegiem niż nasieniak[148]. Typowo w momencie rozpoznania nowotwór pozostaje ograniczony do guza pierwotnego lub występują przerzuty do lokalnych węzłów chłonnych, jednak możliwa jest prezentacja choroby już w stadium rozsianym z obecnymi przerzutami odległymi[148][149]. Najczęściej choroba manifestuje się jako masa w obrębie worka mosznowego u stosunkowo zdrowych młodych mężczyzn[150][151]. Miejscowo w zaawansowanych miejscowo guzach nowotwór może szerzyć się do najądrzy, sieci jądra oraz powrózka nasiennego, a także przez błonę białawą do moszny[152]. Możliwe jest szerzenie nowotworów o agresywnym przebiegu wzdłuż kanału pachwinowego do przestrzeni zaotrzewnowej[153].
Nowotwory jądra wykazują tendencję do szerzenia się naczyniami limfatycznymi już w stosunkowo wczesnym etapie zaawansowania, szerzenie się naczyniami krwionośnymi pojawia się w bardziej zaawansowanym stadium choroby[149]. Jednak rak kosmówki cechuje się wczesnym pierwotnym rozsiewem drogą naczyń krwionośnych[154]. Przerzuty szerzą się za pośrednictwem naczyń limfatycznych powrózka nasiennego w pierwszej kolejności do węzłów zaotrzewnowych[148]. Guzy lewego jądra zwykle dają przerzuty do lewych węzłów okołoaortalnych, z kolei guzy jądra prawego do prawych węzłów okołoaortalnych[148]. Zajęcie węzłów chłonnych pachwinowych może wystąpić w przypadku nacieku moszny[154][149][153], z kolei zajęcie najądrzy lub powrózka nasiennego może skutkować przerzutami w węzłach biodrowych i zasłonowych[149]. Zajęcie węzłów chłonnych po stronie przeciwnej dotyczy około 15% chorych[149]. W dalszej kolejności może dojść do zajęcia węzłów chłonnych śródpiersiowych oraz nadobojczykowych[152]. Masa węzłowa w obrębie przestrzeni zaotrzewnowej może zamykać światło moczowodu i być powodem niewydolności nerek[151][149]. Przerzuty drogą krwionośną w nasieniakach są rzadkie, częściej występują w nienasieniakach[152]. Przerzuty odległe nowotworów jąder najczęściej pojawiają się w płucach, choć mogą również umiejscowić się w obrębie kości, wątroby, śledziony, mózgu, nerek, nadnerczy i przewodu pokarmowego[152][154].
Patogeneza
Modele patogenezy nowotworów germinalnych jądra
Wiele dowodów wskazuje, że germinalne nowotwory jądra moją swój początek już we wczesnej embriogenezie i mogą być elementem zespołu dysgenetycznych jąder (ang. testicular dysgenesis syndrome, TDS) obejmującego dysgenezję jądra, wnętrostwo, spodziectwo, obniżoną płodność i zwiększone ryzyko rozwoju nowotworu jądra[155][156]. W konsekwencji nieprawidłowego rozwoju jąder podczas embriogenezy dochodzi do zablokowania różnicowania się gonocytów i utrzymania przez nie ekspresji markerów embrionalnych[155]. Powód zahamowania różnicowania nie jest znany, najprawdopodobniej jest to efekt nakładania się czynników genetycznych i epigenetycznych oraz czynników środowiskowych[155].
W modelu zaproponowanym przez Skakkebaeka i współpracowników część gonocytów nie ulega fizjologicznemu różnicowaniu w kierunku spermatogonii i wykazuje zdolność do nieprawidłowych podziałów. Proliferację komórek stymuluje patologiczna parakrynowa pętla, w której uczestniczy wydzielany przez komórki Sertolego czynnik wzrostu komórek macierzystych (stem cell factor, SCF) będący ligandem KIT[157][158]. Dalszy wzrost tych komórek może być stymulowany przez gonadotropiny postanatalnie lub w okresie dojrzewania płciowego[157].
Chaganti i Houldsworth zaproponowali inny model wyjaśniający powstawania nowotworu germinalnego jądra. W tym modelu kluczowym zdarzeniem jest zwiększenie podczas podziału mejotycznego liczby kopii chromosomu 12p, a w konsekwencji nadmiernej ekspresji cykliny D2 (CCND2). Nadmierna ilość cykliny D2 może zablokować apoptozę zainicjowaną przez p53 związaną z uszkodzeniem materiału genetycznego, a także podtrzymać podział komórkowy. Prowadzi to niestabilności genetycznej i dalej progresji karcynogenezy[157][159].
Zaburzenia szlaku KIT i KITLG
Szlak KIT i KITLG reguluje proliferację, przeżycie komórki i migrację[160][161][162]. Polimorfizm pojedynczego nukleotydu w 12q22 jest silnie związany z ryzykiem rozwoju nowotworu germinalnego jądra[163][164][155]. Ponadto opisano mutacje somatyczne genu KIT i w 21% nasieniaków oraz 9% nienasieniaków obserwuje się zwiększenie liczby kopii genu KIT[165][155]. Najprawdopodobniej do mutacji dochodzi we wczesnej embriogenezie, na co wskazuje możliwość występowania tej samej mutacji w obu jądrach w przypadku guza obustronnego[155].
Pozostałe zaburzenia genetyczne
W komórkach nowotworów germinalnych jądra zaobserwowano polimorfizm pojedynczego nukleotydu w pobliżu genów SPRY4, BAK1, DMRT1, TERT, ATF7IP, HPGDS, MAD1L1, RFWD3, TEX14 i PPM1E[155].
Gen SPRY4 koduje białko o tej samej nazwie będące inhibitorem szlaku kinazy białkowej aktywowanego mitogenem, który jest aktywowany przez KIT. Nasilona ekspresja SPRY4 zmniejsza aktywność szlaku KIT[155].
BAK1 koduje białko antagonizujące aktywność antyapoptyczną BCL2 i innych białek antyapoptycznych powodując apoptozę. W komórkach germinalnych ekspresja BAK1 jest regulowana przez szlak KIT-KITLG[155].
DMRT1 jest czynnikiem transkrypcyjnym, którego wysoka ekspresja jest niezbędna do różnicowania gonady w kierunku jądra, a niska konieczna do różnicowania w kierunku jajnika. Prawdopodobnie niedobór tego czynnika wiąże się z wyższym ryzykiem zachorowania na niektóre nienasieniaki[155].
TERT jest telomerazą, która poprzez hamowanie skracania telomerów szybko dzielących się komórek zapobiega niestabilności genomu. W nienasieniakach obserwuje się niską ekspresję TERT. Z kolei ATF7IP aktywuje ekspresję TERT i związanego z nim TERC. Zablokowanie ATF7IP skutkuje TERT i TERC, a także spadkiem aktywności telomerazy[155].
MAD1L1 kontroluje MAD1, które uczestniczy w mitotycznym punkcie kontroli cyklu komórkowego. RFWD3 chroni p53 przed degradacją[155].
Diagnostyka
U chorego z guzem jądra wykonuje się ultrasonografię jąder w celu potwierdzenia obecności guza, oceny wielkości i struktury guza oraz oceny przeciwnego jądra[4][166]. W przypadku podejrzenia procesu nowotworowego w USG jąder wykonuje się radykalną orchidektomię z dostępu pachwinowego[4]. Ostateczne rozpoznanie nowotworu jądra jest oparte o badanie histopatologiczne preparatu uzyskanego podczas orchidektomii[167]. Nie przeprowadza się biopsji zmian w jądrze podejrzanych o proces nowotworowy[167].
W ocenie zaawansowania choroby wykonuje się tomografię komputerową jamy brzusznej z miednicą oraz tomografię komputerową klatki piersiowej oraz oznacza się stężenie AFP, β-hCG oraz LDH przed orchidektomią i po orchidektomii[168].
Badania obrazowe
Diagnostyka obrazowa pełni ważną rolę w rozpoznaniu i ocenie zaawansowania nowotworów jąder[169]. U chorego z podejrzeniem nowotworu jądra metodą z wyboru jest ultrasonografia[75][168]. Z kolei w ocenie zaawansowania choroby wykonuje się tomografię komputerową klatki piersiowej oraz brzucha z miednicą[75][169].
Ultrasonografia
Ultrasonografia (USG) jest metodą z wyboru w diagnostyce zmian nowotworowych jądra[168][170]. Ultrasonografia w połączeniu z wywiadem i badaniem fizykalnym wykazuje blisko 98–100% czułość w wykrywaniu guzów w miąższu jądra[22][169][171][168]. Metoda pozwala na wiarygodne odróżnienie zmian wewnątrz miąższu jądra od tych położonych w tkankach pozajądrowych, a także odróżnienie zmian nowotworowych od zmian infekcyjnych[169]. Odróżnienie lokalizacji wewnątrzjądrowej od pozajądrowej jest istotne, ponieważ większość zmian pozajądrowych jest łagodna, a lokalizacji wewnątrzjądrowa w większym stopniu wiąże się z ryzykiem zmian o charakterze złośliwym[170].
Prawidłowe jądro jest homogenne o ziarnistej echostrukturze[168]. Większość nowotworów jest dobrze odgraniczona, hipoechogenna w stosunku do prawidłowego miąższu jądra[169][168]. Mogą być niejednorodne echogenicznie i posiadać obszary hiperechogenne odpowiadające zwapnieniom lub obszary lito-torbielowate[168][170], cześć guzów jest słabo odgraniczona[170]. W USG dopplerowskim może być widoczne wzmożone unaczynienie zmiany[169]. Wykonywane podczas USG jąder badanie jamy brzusznej z przestrzenią zaotrzewnową może wykazać duże zmiany w węzłach zaotrzewnowych[169].
Tomografia komputerowa
Tomografia komputerowa (TK) nie jest stosowana w diagnostyce zmian w obrębie worka mosznowego, natomiast jest cenną metodą diagnostyczną w ocenie zaawansowania choroby[168]. W ocenie zaawansowania wykonuje się tomografię komputerową z dożylnym podaniem kontrastu z badaniem jamy brzusznej z miednicą oraz klatki piersiowej[169]. Ocena zajęcia węzłów jest oparta o kryterium wielkości i za patologiczne węzły uznaje się te powyżej 8–10 mm[169]. Przy kryterium 8 mm czułość i swoistość wynoszą około 70%. Obniżenie kryterium wielkości uznawania węzła chłonnego za patologiczny, choć skutkuje zwiększeniem czułości, to jednak prowadzi do znacznego obniżenia swoistości badania[172][169][173].
Metoda jest rutynowo stosowana w ocenie odpowiedzi na leczenie. Jej ograniczeniem w tym zastosowaniu są trudności w różnicowaniu resztkowego procesu rozrostowego, potworniaka i zwłóknienia czy martwicy[174].
Rezonans magnetyczny
Rezonans magnetyczny (MRI) ze względu na długi czas badania, mniejszą dostępność i wyższy koszt w porównaniu do tomografii komputerowej ma dość ograniczone zastosowanie w diagnostyce i ocenie zaawansowania nowotworu jądra[169]. Rezonans magnetyczny osiąga podobną skuteczność w ocenie zajęcia węzłów zaotrzewnowych jak tomografia komputerowa[175][176][177], jednak może być przydatny gdy inne metody diagnostyczne dają niejednoznaczne wyniki lub w przypadku nadwrażliwości na jodowe środki kontrastowe[177]. Metoda nie jest szeroko stosowana w diagnostyce guza pierwotnego, choć bywa wykorzystywana w przypadku niejednoznacznych wyników badania ultrasonograficznego[169].
Pozytonowa tomografia emisyjna
Pozytonowa tomografia emisyjna w połączeniu z tomografią komputerową (PET-TK) opiera się na wykrywaniu obszarów zwiększonego wychwytu znacznika (najczęściej F18-FDG), które mogą odpowiadać obszarom zwiększonego metabolizmu, w tym towarzyszącym procesom nowotworowym[169]. Nie ma dowodów wspierających rutynowe stosowanie PET w celu określenia zaawansowania choroby[178][179][180][169]. PET jest przydatny jedynie w przypadku niejednoznacznych wyników tomografii komputerowej[169]. Natomiast metoda znajduje zastosowanie w ocenie charakteru guza resztkowego po 6 tygodniach od zakończonej chemioterapii[180][181].
Orchidektomia
U chorego z podejrzeniem rozpoznania nowotworu jądra wykonuje się radykalną orchidektomię z dostępu pachwinowego z wysokim podwiązaniem powrózka nasiennego[5][182]. Orchidektomia z dostępu pachwinowego jest jednocześnie zabiegiem diagnostycznym i leczniczym[183].
Badanie histopatologiczne
Badanie histopatologiczne materiału tkankowego uzyskanego podczas orchidektomii pozwala na ostateczne rozpoznanie choroby oraz określenie typu histologicznego nowotworu[5]. W raporcie histopatologicznym opisuje się cechy makroskopowe guza, jego wielkość, rozpoznanie podtypu histopatologicznego, a w przypadku guzów mieszanych określenie wzajemnego stosunku wszystkich jego składników, stosunek do struktur ważnych dla oceny zaawansowania guza i ocenę zaawansowania miejscowego, ocenę zajęcia węzłów chłonnych, ocenę angioinwazji, margines resekcji i stopień zaawansowania patomorfologicznego[184].
Markery nowotworowe
Surowicze markery nowotworowe takie jak podjednostka beta ludzkiej gonadotropiny kosmówkowej (β-hCG), alfa-fetoproteina (AFP) czy dehydrogenaza mleczanowa (LDH) pełnią istotną rolę w ocenie zaawansowania choroby, ocenie rokowania, monitorowaniu skuteczności leczenia oraz wykrywaniu nawrotów[83]. W 90% przypadkach nienasieniaków obserwuje się podwyższenie stężenia β-hCG albo AFP[185]. Około 30% chorych na nasieniaki ma podwyższone stężenie β-hCG[83].
- Alfa-fetoproteina
Alfa-fetoproteina jest glikoproteiną fizjologicznie produkowaną w życiu płodowym w pęcherzyku żółtkowym, wątrobie i jelicie[186]. AFP nie jest markerem swoistym dla nowotworów germinalnych i poza nimi jego stężenie może ulegać podwyższeniu w przypadku marskości wątroby, zapaleniu wątroby, raku wątrobowokomórkowym i innych nowotworach[185]. Ocenia się, że w przypadku 50–70% nienasieniaków jądra stężenie alfa-fetoproteiny przekracza górną granicę normy[185]. W nowotworach germinalnych AFP jest wytwarzany głównie przez komponent nowotworu pęcherzyka żółtkowego (guz zatoki endodermalnej), a w mniejszym stopniu przez rak zarodkowy i potworniaki[186]. Czysty nasieniak i czysty rak kosmówki nie wytwarzają AFP, a więc podwyższone stężenie markera w tych guzach sugeruje domieszkę innych komponentów[186]. Podwyższone stężenie AFP w przypadku rozpoznania czystego nasieniaka przemawia za koniecznością traktowania nowotworu jako nienasieniaka[186][83].
- Gonadotropina kosmówkowa
Gonadotropina kosmówkowa jest białkiem fizjologicznie wydzielanym przez syncytiotrofoblast łożyska podczas ciąży[186]. Nowotwór jądra może produkować zarówno podjednostkę β, jak i α, jednak ze względu na podobieństwo podjednostki α-hCG do hormonu luteizującego, hormonu folikulotropowego (FSH) oraz hormonu tyreotropowego (TSH) w celach diagnostycznych oznacza się jedynie β-hCG[186]. Stężenie β-hCG może być podwyższone w przypadku 10–20% zlokalizowanych nasieniaków i 30–50% rozsianych przypadków nasieniaka. W przypadku nienasieniaków stężenie β-hCG jest znacznie podwyższone w przypadku raka kosmówki, a w mniejszym stopniu w przypadku raka zarodkowego lub mieszanych guzach germinalnych[186]. Również β-hCG nie jest markerem swoistym dla nowotworów jądra i podwyższone stężenie może być związane z hipogonadyzmem, nowotworami neuroendokrynnymi, rakiem pęcherza moczowego, rakiem nerki, rakiem płuca, nowotworami głowy i szyi, nowotworami przewodu pokarmowego, rakiem szyjki macicy, rakiem trzonu macicy, chłoniakami i białaczkami[185].
- Dehydrogenaza mleczanowa
Dehydrogenaza mleczanowa jest enzymem wytwarzanym przez liczne tkanki, katalizującym przejście pirogronianu w mleczan. Najczęściej obserwuje się podwyższenie aktywności izoenzymu LDH-1[186]. Enzym ma niską swoistość dla nowotworów germinalnych jądra, jego podwyższoną aktywność stwierdza się w 40–60% przypadków tych nowotworów[186][185].
- Zastosowanie w ocenie stopnia zaawansowania oraz w monitorowaniu leczenia
Ocena stężenia AFP, β-hCG oraz LDH jest istotna w kwalifikacji chorego do odpowiedniego stadium zaawansowania, a następnie odpowiedniego leczenia[177][185]. Stężenie AFP, β-hCG oraz LDH jest oznaczane przed orchidektomią oraz po przynajmniej 7 dniach po orchidektomii[83]. Utrzymywanie się nieprawidłowych wartości stężenia markerów lub zbyt wolny spadek ich stężenia, po uwzględnieniu ich okresu półtrwania, mogą przemawiać za obecnością przerzutów[177][185]. Średni okres półtrwania AFP wynosi około 5–7 dni, a β-hCG 2–3 dni[177]. Natomiast normalizacja stężenia markerów po orchidektomii nie wyklucza obecności rozsiewu[177].
Kolejnym zastosowaniem markerów jest monitorowanie odpowiedzi na chemioterapię[185]. Stężenie markera powinno odpowiadać wielkości guza i odpowiednio wysoka wartość stężenia jest kryterium gorszego rokowania[186]. Ze względu na możliwe pewne opóźnienie spadku stężenia w stosunku do zastosowania leczenia interpretacja wyniku dynamiki spadku stężenia markera może być skomplikowana[186]. Utrzymywanie się nieprawidłowych stężeń lub zbyt wolny ich spadek może sugerować utrzymywanie się aktywnej choroby[186]. Ocena stężenia markerów bywa pomocna podczas diagnostyki obecności choroby resztkowej[185].
Zaawansowanie kliniczne
Zaawansowanie nowotworów złośliwych jądra jest oceniane w oparciu o klasyfikację TNM[187]
| Guz pierwotny – cecha T | |||
| Tx | Nie można ocenić guza pierwotnego – nie wykonano orchidektomii | ||
| T0 | Nie stwierdza się guza pierwotnego | ||
| Tis | Wewnątrzprzewodowa neoplazja komórek zarodkowych (rak in situ) | ||
| T1 | Guz ograniczony do jądra i najądrza, bez naciekania naczyń krwionośnych lub chłonnych, może naciekać osłonkę białawą, ale nie może naciekać osłonki pochwowej | ||
| T2 | Guz ograniczony do jądra i najądrza, obecne naciekanie naczyń krwionośnych lub chłonnych albo naciekanie osłonki pochwowej | ||
| T3 | Naciekanie powrózka nasiennego | ||
| T4 | Naciekanie moszny | ||
| Zajęcie okolicznych węzłów chłonnych – cecha N | |||
| Nx | Nie można ocenić okolicznych węzłów chłonnych | ||
| N0 | Nie stwierdza się przerzutów w okolicznych węzłach chłonnych | ||
| N1 | Przerzut w 1 lub wielu węzłach chłonnych o największym wymiarze ≤2 cm | ||
| N2 | Przerzut w 1 lub wielu węzłach chłonnych o największym wymiarze >2 cm, ale ≤5 cm | ||
| N3 | Przerzut w węźle chłonnym o największym wymiarze >5 cm | ||
| Przerzuty odległe – cecha M | |||
| Mx | Nie można określić obecności przerzutów odległych | ||
| M0 | Nie stwierdza się przerzutów odległych | ||
| M1 | Obecne przerzuty odległe | ||
| M1a | Przerzuty do pozaregionalnych węzłów chłonnych lub płuca | ||
| M1b | Przerzut w innej lokalizacji niż pozaregionalny węzeł chłonny lub płuco | ||
| Markery nowotworowe w surowicy – cecha S | |||
| Sx | Nie oceniono stężenia markerów w surowicy | ||
| S0 | Stężenie markerów nowotworowych w zakresie wartości prawidłowych | ||
| S1 | AFP <1000 ng/ml | β–HCG <5000 mUI/ml | LDH <1,5 wartości normy |
| S2 | AFP 1000–10 000 ng/ml | β–HCG 5000–50 000 mUI/ml | LDH 1,5–10 wartości normy |
| S3 | AFP >10 000 ng/ml | β–HCG >50 000 mUI/ml | LDH >10 wartości normy |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M | Cecha S |
| 0 | pTis | N0 | M0 | S0 |
| pTis | N0 | M0 | S1 | |
| I | każde pT | N0 | M0 | Sx |
| IA | pT1 | N0 | M0 | S0 |
| IB | pT2 | N0 | M0 | S0 |
| pT3 | N0 | M0 | S0 | |
| pT4 | N0 | M0 | S0 | |
| IS | każde pT | N0 | M0 | S1 |
| każde pT | N0 | M0 | S2 | |
| każde pT | N0 | M0 | S3 | |
| II | każde pT | N1–N3 | M0 | Sx |
| IIA | każde pT | N1 | M0 | S0 |
| każde pT | N1 | M0 | S1 | |
| IIB | każde pT | N2 | M0 | S0 |
| każde pT | N2 | M0 | S1 | |
| IIC | każde pT | N3 | M0 | S0 |
| każde pT | N3 | M0 | S1 | |
| III | każde pT | każde N | M1 | Sx |
| IIIA | każde pT | każde N | M1a | S0 |
| każde pT | każde N | M1a | S1 | |
| IIIB | każde pT | N1 | M0 | S2 |
| każde pT | N2 | M0 | S2 | |
| każde pT | N3 | M0 | S2 | |
| każde pT | każde N | M1a | S2 | |
| IIIC | każde pT | N1 | M0 | S3 |
| każde pT | N2 | M0 | S3 | |
| każde pT | N3 | M0 | S3 | |
| każde pT | każde N | M1a | S3 | |
| każde pT | każde N | M1a | każde S |
Leczenie
U chorych z klinicznym podejrzeniem nowotworu jądra, po potwierdzeniu obecności guza narządu w USG jąder, wykonuje się radykalną przezpachwinową orchidektomię[192][193]. Dalsze postępowanie zależy od rozpoznania histopatologicznego, stopnia zaawansowania i stężenia markerów po zabiegu operacyjnym[6][194]. Ogólnie u chorych z chorobą ograniczoną (stadium I) dąży się do modyfikacji intensywności leczenia w celu uzyskania wysokich odsetków wyleczeń i ograniczania niekorzystnych następstw leczenia. W tej grupie chorych stosuje się strategię wyłącznego aktywnego nadzoru lub wykorzystuje się chemioterapię uzupełniającą, radioterapię uzupełniającą lub limfadenektomię zaotrzewnową. U chorych z zaawansowaną chorobą, szczególnie w pośredniej lub niekorzystnej grupie ryzyka, leczenie ma przede wszystkim za zadanie uzyskać wysoki odsetek odpowiedzi przy akceptowalnej toksyczności. W tej grupie chorych wykorzystuje się chemioterapię opartą o cisplatynę[6].
Radykalna orchidektomia
Chory z guzem jądra potwierdzonym w USG jąder ma bardzo wysokie prawdopodobieństwo rozpoznania choroby nowotworowej[195]. Zatem kolejnym krokiem diagnostycznym i leczniczym po wykonaniu USG jąder oraz przedoperacyjnym oznaczeniu stężenia markerów nowotworowych jest wykonanie radykalnej orchidektomii z dostępu pachwinowego[192]. Ocenia się, że w 10% przypadków orchidektomii usunięta zmiana ostatecznie w badaniu histopatologicznym ma łagodny charakter, dlatego w przypadku guzów jądra o niejasnym charakterze niektórzy autorzy proponują wykonanie śródoperacyjnej oceny histopatologicznej zamrożonych tkanek[196].
Nie wykonuje się zabiegów z dostępu mosznowego, ponieważ ze względu na kierunek spływu chłonki z obszaru moszny w kierunku węzłów pachwinowych zabieg w tym obszarze wiąże się z ryzykiem rozsiewu do węzłów pachwinowych[197].
Operację wykonuje się pod znieczuleniem ogólnym lub miejscowym[197]. Po wykonaniu poprzecznego nacięcia skóry i odpreparowaniu tkanek podskórnych rozcięgno mięśnia skośnego zewnętrznego brzucha otwiera się wzdłuż podłużnych włókien od pierścienia pachwinowego powierzchniowego do głębokiego. Tym samym odsłania się zawartość kanału pachwinowego, w tym powrózek nasienny i mięsień dźwigacz jądra[197][195]. W kolejnym etapie mobilizuje się powrózek nasienny. Jeśli rozpoznanie nowotworu nie jest pewne i przed decyzją o orchidektomii konieczna jest eksploracja moszny, to powrózek zostaje czasowo odpowiednio zaciśnięty, co zapewnia zablokowanie odpływu krwi żylnej i chłonki, a umożliwia zaopatrzenie tętnicze[197]. W większości przypadków podejrzenie kliniczne procesu nowotworowego jest pewne i wykonuje się proste przecięcie powrózka nasiennego proksymalnie w stosunku do pierścienia pachwinowego głębokiego. Istotne jest założenie na kikut powrózka nasiennego niewchłanialnego szwu, co ułatwia jego identyfikację, gdy konieczne okazuje się wykonanie późniejszej limfadenektomii[197]. Następnie po przecięciu powrózka nasiennego i zabezpieczeniu hemostazy jądro jest wydobywane poprzez delikatne parcie poniżej narządu i delikatne pociągnięcie za fragment odciętego powrózka nasiennego[197]. Jeśli usuwane jądro jest znacznie powiększone to konieczne jest poszerzenie nacięcia w kierunku moszny. Zabezpiecza to usuwane jądro przed zbędnymi manipulacjami podczas przechodzenia przez zbyt mały otwór i zmniejsza ryzyko zanieczyszczenia rany komórkami nowotworowymi[195]. Jednoczasowo z orchidektomią można wykonać wstawienie protezy jądra[197].
Nie zaleca się wykonywania operacji oszczędzających jądro. Jednak w szczególnych przypadkach u wybranych chorych z metachronicznym lub synchronicznym nowotworem obu jąder lub nowotworem w jedynym jądrze bywa podejmowana próba leczenia zachowującego jądro, gdy nowotwór stanowi poniżej 30% objętości jądra i jest możliwy zabieg radykalny[5]. Jednak w zachowanym jądrze w aż ponad 80% przypadków stwierdza się wewnątrzprzewodową neoplazję komórek zarodkowych (TIN)[5]. Nie ma badań porównujących skuteczność i bezpieczeństwo leczenia zachowującego jądro z radykalną orchidektomią[198].
Leczenie nasieniaków
Leczenie nasieniaków w I stopniu zaawansowania
Radykalna orchidektomia z dostępu pachwinowego zapewnia wyleczenie u większości chorych z nasieniakiem w I stopniu zaawansowania klinicznego[199][200]. Jedynie u około 15–20% chorych w tym stadium są obecne subkliniczne przerzuty, które pozostały niewykryte pomimo odpowiedniej diagnostyki zastosowanej podczas stadiowania (oceny zaawansowania) i są one przyczyną nawrotu choroby[199]. W tej grupie chorych preferowanym postępowaniem jest aktywny nadzór polegający na okresowej kontroli lekarskiej z oceną stężenia markerów nowotworowych oraz okresowym wykonywaniu badań obrazowych według określonego planu. Alternatywnym postępowaniem jest pojedyncza dawka karboplatyny lub radioterapia na obszar węzłów okołoaortalnych[200].
- Aktywny nadzór
Aktywny nadzór jest preferowanym postępowaniem u chorych na nasieniaka w stadium I (pT1, pT2 i pT3)[199][200][6]. Aktywny nadzór ma za zadanie wczesne wykrycie ewentualnej wznowy i szybkie wdrożenie leczenia, co zapewnia przeżycie porównywalne z chorymi otrzymującymi leczenie adiuwantowe (uzupełniające)[201]. Polega on na regularnej kontroli lekarskiej z oceną poziomu markerów nowotworowych przez pierwsze 2 lata co 4 miesiące, następnie przez kolejne 3 lata co 12 miesięcy oraz kontroli w badaniach obrazowych polegających na wykonaniu tomografii komputerowej brzucha z miednicą oraz zdjęcia rentgenowskiego klatki piersiowej co 6 miesięcy przez pierwsze 2 lata, a następnie co 12 miesięcy przez kolejne trzy lata[202][201][203].
Samodzielna radykalna orchidektomia pozwala na wyleczenie 80% chorych na nasieniaka w stopniu zaawansowania I. Pomimo że uzupełniająca chemioterapia lub radioterapia prowadzą do zmniejszenia ryzyka nawrotu, to jednak znaczna część chorych jest nadmiernie leczona[204][205]. Wysoka skuteczność metod leczenia nasieniaka, zarówno chemioterapii, jak i radioterapii, obawa o późne następstwa leczenia oraz badania kliniczne spowodowały zmianę strategii leczenia nasieniaka w stadium I i preferencji wyłącznego aktywnego nadzoru w tej grupie chorych[6].
Skuteczność i bezpieczeństwo aktywnego nadzoru oceniono w kilku badaniach[206][207][208][209]. Sugerują one 15–20% ryzyko nawrotu w ciągu pięciu lat[199][200][203], przy czym większość nawrotów pojawia się w ciągu pierwszych trzech lat obserwacji jako przerzuty w węzłach chłonnych poniżej przepony[200].
Czynniki ryzyka nawrotu nasieniaka w stadium I są słabo poznane[204]. Część badań wskazuje średnicę guza większą niż 4 cm oraz naciek sieci jądra jako czynnik ryzyka nawrotu[210][208][211][212][200]. W jednym badaniu u chorych po orchidektomii z guzem o wielkości poniżej 4 cm, bez nacieku sieci jądra ryzyko nawrotu wynosiło jedynie 6%[210][199]. Jednak wartość predykcyjna wielkości guza powyżej 4 cm czy obecności nacieku sieci jądra jest niepewna[205]. W badaniu Chung i współpracowników nie potwierdzono roli wielkości guza powyżej 4 cm lub nacieku sieci jądra jako czynników ryzyka nawrotu[213][214][200].
Chorych, u których rozpoznano nawrót choroby poddaje się chemioterapii lub radioterapii[207][199][205]. Ostatecznie odsetek wyleczeń chorych na nasieniaka w stadium I poddanych aktywnemu nadzorowi wynosi 97–100%[215][207][201][199].
- Chemioterapia adiuwantowa
Podanie pojedynczej dawki karboplatyny w dawce obliczonej dla AUC równej 7 jest jedną z możliwych form postępowania u chorych z nasieniakiem w stopniu I stanowiącą alternatywę dla aktywnego nadzoru lub radioterapii[199][216].
Chemioterapia uzupełniająca w porównaniu do radioterapii pozwala uzyskać podobne wyniki w zakresie odsetka nawrotów, mediany przeżycia wolnego od nawrotu oraz mediany przeżycia całkowitego[199][203]. W badaniu na 1477 chorych z nasieniakiem w stopniu I porównano skuteczność leczenia adiuwantowego za pomocą pojedynczej dawki karboplatyny oraz radioterapii. Nie wykazano istotnych różnic w odsetku nawrotów po pięciu latach pomiędzy obiema metodami leczenia uzupełniającego[217][218][199]. Ważne jest podanie karboplatyny w pełnej dawce, ponieważ redukcja dawki leku wiąże się z mniejszą skutecznością leczenia w zapobieganiu nawrotowi nowotworu[217][219].
Dwa kursy karboplatyny w leczeniu adiuwantowym prawdopodobnie pozwalają jeszcze bardziej obniżyć ryzyko nawrotu[220][221][199], jednak ze względu na brak długotrwałych obserwacji nieznane są odległe efekty takiego postępowania[219][199].
- Radioterapia adiuwantowa
Radioterapia jest opcją leczenia uzupełniającego po orchidektomii w nasieniaku o zaawansowaniu klinicznym stopnia I, choć w tej grupie chorych preferuje się aktywny nadzór[199][222]. Leczenie obejmuje podanie na obszar węzłów okołoaortalnych łącznej dawki 20 Gy w 10 frakcjach po 2 Gy, jedynie w szczególnych sytuacjach naświetla się również węzły biodrowe po stronie guza[222][223]. Alternatywnie bywa stosowana dawka 25,5 Gy we frakcjach po 1,5–1,7 Gy[222].
Nasieniak jest nowotworem wyjątkowo promienioczułym, dlatego przez wiele lat radioterapia była standardową metodą leczenia uzupełniającego po orchidektomii[219]. Dawniej w leczeniu uzupełniającym standardowo stosowano radioterapię na obszar węzłów okołoaortalnych i biodrowych o łącznej dawce 30 Gy podzielonej na 15 frakcji, co zapewniało wysokie odsetki przeżycia swoistego dla nowotworu kosztem wysokiej toksyczności krótkoterminowej i długoterminowej[192]. Toksyczność związana z leczeniem spowodowała zmianę strategii leczenia przez ograniczenie dawki promieniowania oraz naświetlanego obszaru[192].
W badaniu TE18 wykazano równoważność pod względem odsetka nawrotów radioterapii uzupełniającej w dawce 30 Gy w 15 frakcjach i 20 Gy w 10 frakcjach[224][192]. W badaniu TE10 porównano radioterapię na obszar węzłów okołoaortalnych oraz radioterapię na obszar węzłów okołoaortalnych i biodrowych. Zaobserwowano, że napromieniowanie wyłącznie węzłów okołoaortalnych wiąże się z mniejszą toksycznością hematologiczną, ze strony przewodu pokarmowego i gonad, przy podobnym odsetku przeżyć trzyletnich wolnych od nawrotu wynoszących odpowiednio dla radioterapii węzłów okołoaortalnych 96% oraz 96,6% dla radioterapii obejmującej obszar również węzłów biodrowych oraz podobnym odsetku trzyletnich przeżyć całkowitych wynoszących odpowiednio 99,3% i 100%[225][192].
Chorzy po zabiegach chirurgicznych w obszarze miednicy mogą mieć zmieniony drenaż limfatyczny jądra. U tych chorych radioterapia jest rozszerzana o obszar węzłów biodrowych i pachwinowych położonych po stronie guza. Jednak ze względu na znaczną objętość napromieniowywanych tkanek i zwiększone ryzyko późnych powikłań raczej zaleca się rozważenie innych metod postępowania[223]. U chorych w stadium I nasieniaka nie wykonuje się radioterapii na obszar powyżej przepony, ponieważ w tym obszarze w tym stopniu zaawansowania rzadko obserwuje się przerzuty[222][226].
Leczenie nasieniaków w stopniu zaawansowania IIA i IIB
Stadium IIA obejmuje zajęcie regionalnych węzłów chłonnych z wielkością węzłów poniżej 2 cm, w stadium IIB zajęte węzły chłonne są wielkości powyżej 2 cm i poniżej 5 cm. W leczeniu chorych na nasieniaka w stadium IIA lub IIB stosuje się radioterapię albo chemioterapię[227].
W leczeniu nasieniaka w stadium IIA stosuje się radioterapię obszaru węzłów chłonnych okołoaortalnych oraz biodrowych po stronie guza pierwotnego lub alternatywnie chemioterapię z podaniem 3 kursów BEP lub 3 EP[228][229][227]. Zajęcie wielu węzłów chłonnych w stadium IIA przemawia za wykorzystaniem chemioterapii[230][219]. W stadium IIB u większości chorych preferuje się chemioterapię z podaniem 3 kursów BEP albo 4 EP[230][227][229]. Jedynie u wybranych chorych w tym stadium bez masywnych zmian węzłowych (według NCCN węzły poniżej 3 cm, według PTOK poniżej 2,5 cm) wykorzystuje się radioterapię[230][231][219].
Radioterapia jest podstawową metodą leczenia nasieniaków w stopniu IIA i niektórych chorych w stadium IIB. Z kolei chorzy z bardziej zaawansowaną chorobą w stadium IIB lepiej opowiadają na chemioterapię niż na radioterapię, choć chemioterapia jest związana z większym ryzykiem działań krótkoterminowych niepożądanych[232].
- Radioterapia
Radioterapia znajduje zastosowanie w stadiach IIA oraz IIB bez masywnych zmian węzłowych (low-volume disease)[230]. W stopniu IIA napromieniowuje się do łącznej dawki 30 Gy, a w stadium IIB do 36 Gy[228]. W stadium IIB boczne granice pola naświetlania obejmują przerzutowe węzły chłonne z marginesem 1–1,5 cm[228]. Zatem w porównaniu do radioterapii w stadium I standardowo pole jest poszerzone o obszar węzłów biodrowych oraz podaje się wyższą dawkę promieniowania[228]. Łączna całkowita dawka napromieniowania jest podzielona na 20 Gy na obszar węzłów okołoaortalnych oraz ipsilateralnych węzłów biodrowych (midplane) oraz w stadium IIA 10 Gy albo w stadium IIB 16 Gy na obszar zajętych węzłów chłonnych (cone down)[233][230][231]. Radioterapia pozwala osiągnąć 92% odsetek przeżyć wolnych od nawrotów w stadium IIA oraz 90% odsetek przeżyć wolnych od nawrotów w stadium IIB, a całkowite przeżycie leczonych tą metodą jest zbliżone do 100%[234][235][228]. W retrospektywnym badaniu Domont i współpracowników zaobserwowano zmniejszoną skuteczność radioterapii w zmianach węzłowych powyżej 3 cm[236][237][232].
- Chemioterapia
Kolejną opcją leczniczą stadium IIA lub IIB jest chemioterapia. Stosuje się 4 kursy programu BEP składającego się z bleomycyny, etopozydu oraz cisplatyny albo 4 kursów programu EP składającego się z etopozydu i cisplatyny[228]. Nie ma wyników randomizowanych badań porównujących chemioterapię z radioterapią w tych stadiach zaawansowania[228]. Badanie Tandstad i współpracowników sugeruje przewagę chemioterapii nad radioterapią w stadiach IIA i IIB[215][205][6]. W porównaniu z radioterapią wielolekowa chemioterapia, choć pozwala uniknąć długoterminowych działań niepożądanych radioterapii, wiąże się z wyższym prawdopodobieństwem działań niepożądanych krótkoterminowych[238]. Monoterapia karboplatyną, która jest stosowana na niższych stopniach zaawansowania, nie jest stosowana w chorobie z przerzutami, ponieważ nie oferuje wystarczającej skuteczności[239][232][228].
Leczenie nasieniaków w stopniu zaawansowania IIC i III
Podstawową metodą leczenia chorych na nasieniaka w stadium IIC i III jest chemioterapia. U chorych z korzystnym rokowaniem (chorzy bez pozapłucnych przerzutów) podaje się 3 kursy BEP lub 4 EP, gdy występują przeciwwskazania do podania bleomycyny[229][240]. W grupie chorych o pośrednim rokowaniu (chorzy z obecnymi przerzutami pozapłucnymi) stosuje się 4 kursy BEP. Alternatywnie, w przypadku przeciwwskazań do bleomycyny, zastosowanie znajduje program VIP składający się z etopozydu, ifosfamidu, mesny oraz cisplatyny[241][240].
Zmiany resztkowe po leczeniu w stadiach II i III
Po leczeniu w stadiach II i III chorzy są ponownie oceniani w badaniach obrazowych oraz kontroluje się stężenie markerów nowotworowych, a dalsze postępowanie zależy od wyników tych badań[242]. Chorzy z progresją radiologiczną zmiany resztkowej albo utrzymującym się podwyższeniem lub progresją stężenia markerów nowotworowych wymagają dalszego leczenia[243][244].
W przypadku występowania masy resztkowej poniżej 3 cm przy prawidłowym stężeniu markerów nowotworowych chorzy nie wymagają dalszego leczenia, a jedynie dalszej obserwacji[242][244]. Wykonywanie badania PET-TK w tej grupie chorych nie jest konieczne[244].
Stwierdzenie całkowitej remisji lub obecność masy resztkowej powyżej 3 cm przy prawidłowym stężeniu markerów nowotworowych wymaga wykonania badania PET-TK, które pozwala ocenić aktywność metaboliczną masy resztkowej[242]. Badanie ma wysoką dodatnią i ujemną wartość predykcyjną w określaniu charakteru zmiany resztkowej po chemioterapii[245][246][242][181]. W celu uniknięcia wyniku fałszywie dodatniego badanie wykonuje się po przynajmniej 6 tygodniach od zakończeniu chemioterapii[242][244]. Ze względu na wysoką wartość predykcyjną badania PET-TK ujemny wynik zastępuje biopsję i pozwala na zakwalifikowanie chorego do obserwacji. Stwierdzenie aktywności metabolicznej w obrębie guza resztkowego daje wysokie prawdopodobieństwo obecności resztkowego nasieniaka[241].
Chorzy z ujemnym wynikiem PET-TK nie wymagają dalszego leczenia, poza dalszym nadzorem onkologicznym[247][242].
U chorych z dodatnim wynikiem PET-TK ze względu na wysokie prawdopodobieństwo występowania aktywnej choroby wykonuje się biopsję lub wycięcie zmiany resztkowej i w przypadku stwierdzenia w badaniu histopatologicznym żywego utkania nowotworowego konieczne jest dalsze leczenie[242]. EAU u chorych z dodatnim wynikiem PET-TK, obok biopsji albo wycięcia zmiany resztkowej, alternatywnie proponuje również możliwość ponownej oceny charakteru zmiany w drugim PET-TK wykonanym po 6 tygodniach i wówczas w przypadku progresji zmiany konieczne jest dalsze leczenie[244].
Jeśli nie ma możliwości wykonania PET-TK, wybór dalszego postępowania w przypadku zmian powyżej 3 cm jest oparty o wynik biopsji albo resekcji zmiany, albo zmianę obserwuje się do stwierdzenia jej regresji lub progresji[241].
Dalsze leczenie może obejmować resekcję zmiany, radioterapię lub kolejną linię chemioterapii. Leczenie II linii nasieniaków jest prowadzone na tych samych zasadach jak w przypadku nienasieniaków[242].
Leczenie nienasieniaków
Leczenie nienasieniaków w I stopniu zaawansowania
Około 50–60% nienasieniaków jest rozpoznawana w I stopniu zaawansowania[6]. Ocenia się, że po radykalnej orchidektomii u 30% chorych na nienasieniaka w stadium I występują mikroprzerzuty i dochodzi do nawrotu choroby[226][6]. Do metod postępowania w nienasieniaku w I stopniu zaawansowania należy aktywny nadzór, chemioterapia adiuwantowa lub limfadenektomia zaotrzewnowa z oszczędzeniem nerwów (NS RPLND)[6][248].
U chorych w stadium IA (stadium T1N0M0 bez naciekania struktur naczyniowych) preferuje się aktywny nadzór, alternatywnym postępowaniem u chorych nieakceptujących nadzoru są 1–2 kursy chemioterapii w programie BEP lub limfadenektomia zaotrzewnowa z oszczędzeniem nerwów (NS RPLND)[249][250][251][252].
U chorych w stadium IB (stadia T2–T4N0M0) standardowo wykorzystuje się chemioterapię z wykorzystaniem 1–2 kursów BEP[253][254][252]. U chorych z przeciwwskazaniami do chemioterapii wykonuje się limfadenektomię zaotrzewnową z oszczędzeniem nerwów[253][254]. W tym stadium chemioterapia i limfadenektomia zaotrzewnowa z oszczędzeniem nerwów zmniejszają ryzyko nawrotu, a aktywny nadzór ze względu na wysokie ryzyko nawrotu u chorych z naciekaniem struktur naczyniowych jest wykorzystywany jedynie u wybranych chorych bez naciekania naczyń[255].
U chorych w stopniu IS, a więc podwyższonych stężeń AFP lub β-hCG bez radiologicznych dowodów na obecność choroby, stosuje się 3 kursy BEP albo 4 kursy EP[256]. Chemioterapia jest preferowaną metodą leczenia wobec limfadenektomii zaotrzewnowej, ponieważ chorzy w tym stadium zwykle mają chorobę rozsianą[257][258][256]. Konieczne jest różnicowanie z nienowotworowymi przyczynami podwyższenia stężenia tych markerów, szczególnie z chorobami wątroby lub dróg żółciowych, hipogonadyzmem czy paleniem marihuany[256].
- Aktywny nadzór
Strategia aktywnego nadzoru nienasieniaka w stadium I jest oparta o możliwość wyleczenia większości chorych samodzielną orchidektomią i wysoką skuteczność chemioterapii włączanej w przypadku nawrotów choroby[259][226]. Podobnie jak u chorych na nasieniaki polega on na okresowej kontroli lekarskiej z okresową kontrolą markerów nowotworowych przez pierwsze 3 lata co 3 miesiące, następnie przez kolejne 2 lata co 12 miesięcy, wykonywania zdjęcia rentgenowskiego klatki piersiowej co 6 miesięcy do 5 roku obserwacji i wykonywaniu tomografii komputerowej brzucha z miednicą co 6 miesięcy w pierwszym roku obserwacji (około 3 miesiąca i 12 miesiąca obserwacji), a następnie co 12 miesięcy około 24 i 36 miesiąca obserwacji[260]. Aktywny nadzór jest stosowany u chorych w stadium pierwszym bez czynników wysokiego ryzyka nawrotu (naciekanie naczyń krwionośnych i limfatycznych)[226].
Niezależnie od strategii postępowania po orchidektomii u chorych na nienasieniaka w stadium I obserwuje się 98–100% wieloletnich przeżyć swoistych dla nowotworu (CSS)[259][241]. U około 30% chorych w tym stadium dochodzi do nawrotu nienasieniaka, około 80% nawrotów jest stwierdzanych w ciągu roku po orchidektomii, kolejne 12% w drugim roku od zabiegu, a 6% w trzecim roku, jedynie 1% nawrotów jest rozpoznawana w czwartym i piątym roku od operacji[261][262][226]. Większość nawrotów pojawia się w przestrzeni zaotrzewnowej[226].
Czynnikiem ryzyka nawrotu jest naciek naczyń krwionośnych lub limfatycznych. Ocenia się, że u chorych z naciekaniem naczyń krwionośnych lub limfatycznych ryzyko nawrotu wynosi około 50%, podczas gdy u chorych bez naciekania struktur naczyniowych ryzyko nawrotu wynosi 15–20%[241][6][263][264]. Naciekanie naczyń krwionośnych lub limfatycznych jest cechą zaawansowania guza pierwotnego w klasyfikacji TNM[189].
- Chemioterapia uzupełniająca
Chemioterapia uzupełniająca jest jedną z metod postępowania u chorych z nienasieniakiem w stadium IA lub IB i polega na podaniu jednego lub dwóch kursów programu BEP złożonego z cisplatyny, etopozydu i bleomycyny[265][250]. Chemioterapia uzupełniająca jest metodą zmniejszającą ryzyko nawrotu u chorych w stadium IB[255].
Skuteczność chemioterapii adiuwantowej za pomocą 2 kursów BEP oceniono w kilku badaniach[266][267][268][269][270], w których przeżycie wolne od nawrotu (RFS) osiągało ponad 95%[255]. W badaniu SWENOTECA VI oceniono skuteczność leczenia adiuwantowego u chorych na nienasieniaka w stadium I. Chorych bez inwazji struktur naczyniowych poddano samodzielnemu nadzorowi lub podano 1 kurs BEP, z kolei chorym z naciekiem naczyń krwionośnych lub limfatycznych zaproponowano 1 kurs BEP lub 2 kursy BEP. Po 1 roku badania stwierdzono wysoką skuteczność pojedynczego kursu BEP, dlatego zmieniono protokół badania i również chorym z inwazją naczyń proponowano 1 kurs BEP[6]. U 313 chorych leczonych jednym cyklem BEP po pięciu latach odsetek nawrotów u chorych bez inwazji naczyń krwionośnych lub limfatycznych wynosił 1,3%, a chorych z inwazją naczyń 3,2%[271][6]. Podobne wyniki uzyskano po ośmiu latach obserwacji[272]. Badanie dowodzi, że leczenie uzupełniające zapobiega ponad 90% nawrotom nienasieniaka, nawroty nie pojawiały się po 3,3 roku od zakończenia leczenia[265][6].
W 2008 roku opublikowano wyniki niemieckiego badania porównującego limfadenektomię zaotrzewnową z oszczędzeniem nerwów (NS RPLND) z chemioterapią adiuwantową za pomocą jednego kursu BEP. Zaobserwowano, że chemioterapia istotnie statystycznie zwiększa odsetek dwuletniego przeżycia wolnego od nawrotu (RFS), które wynosiło 99,41%, a podczas gdy limfadenektomia zaotrzewnowa pozwalała uzyskać 92,37% odsetek przeżyć wolnych od nawrotów[273][265].
- Limfadenektomia zaotrzewnowa z oszczędzeniem nerwów
Limfadenektomia zaotrzewnowa jest zabiegiem diagnostycznym i leczniczym[6]. Limfadenektomia zaotrzewnowa jest najdokładniejszą metodą diagnostyczną oceny zajęcia lokalnych węzłów chłonnych[203]. U około 15–30% chorych w stadium klinicznym I ostatecznie po limfadenektomii rozpoznaje się patologiczne stadium II[274][275][276][203][277]. Rola pierwotnej limfadenektomii zaotrzewnowej w związku z wysoką skutecznością leczenia kolejnych linii oraz niskiego odsetku nawrotów po chemioterapii adiuwantowej znacznie zmniejszyła się[265]. Stanowi ona opcję postępowania po orchidektomii u chorych niechcących poddać się nadzorowi ani chemioterapii uzupełniającej[276].
Dawniej limfadenektomia obejmowała usunięcie wszelkiej tkanki limfatycznej pomiędzy odnogami przepony a podziałem aorty na tętnice biodrowe wspólne i pomiędzy oboma moczowodami[278]. Wówczas limfadenektomia była związana z wysokim ryzykiem niepłodności, spowodowanej wytryskiem wstecznym[203]. Wytrysk wsteczny jest następstwem związanym z zakresem zabiegu uszkodzeniem unerwienia współczulnego pochodzącego ze splotu podbrzusznego górnego i dolnego. W celu uniknięcia tego powikłania wprowadzono modyfikację zakresu zabiegu oraz technikę zaoszczędzenia struktur nerwowych[279]. Badania drenażu limfatycznego z guza pomogły ustalić tendencję nowotworu do jednostronnego przerzutowania i zmodyfikować zakres zabiegu, co pozwoliło zmniejszyć ilość powikłań po zabiegu[279][203][280]. W przypadku guza położonego po stronie prawej usuwane są węzły lędźwiowe prawe (węzły żyły głównej dolnej przednie i węzły żyły głównej dolnej tylne), lędźwiowe pośrednie i biodrowe wspólne prawe. W przypadku guza jądra po stronie lewej usuwa się węzły lędźwiowe lewe (węzły przedaortalne, węzły zaaortalne) i biodrowe wspólne lewe[203][a]. Technika z zaoszczędzeniem nerwów polega na identyfikacji, oddzieleniu i zaoszczędzeniu struktur układu autonomicznego podczas limfadenektomii[279][282]. Współcześnie stosowane modyfikacje limfadenektomii pozwoliły ograniczyć ryzyko wytrysku wstecznego do 1%[203].
Odsetek wyleczeń po wykonaniu limfadenektomii zaotrzewnowej zależy od wielkości, liczby zajętych węzłów chłonnych oraz kompletności resekcji tkanki limfatycznej[203]. W przypadku obecności przerzutów do węzłów chłonnych metoda pozwala osiągnąć wysoki odsetek wyleczeń bez stosowania chemioterapii u tych chorych[203]. We włoskim badaniu u chorych w klinicznym stadium I zaobserwowano niemal 85% dziesięcioletnie przeżycie wolne od progresji i 15% odsetek nawrotów po 17 latach obserwacji[283]. Jednak u większości chorych (nawet do 70% chorych) limfadenektomia zaotrzewnowa jest nadmiernym, niepotrzebnym leczeniem[276][203].
Po wykonanej limfadenektomii zaotrzewnowej, jeśli w węzłach chłonnych nie rozpozna się przerzutów, to nie stosuje się dalszego leczenia adiuwantowego, a chorzy wymagają jedynie dalszego nadzoru. Jednak jeśli wycięte węzły chłonne zawierają przerzuty, to dalsze postępowanie zależy od stopnia ich zajęcia. W stopniu pN1 preferuje się nadzór wobec chemioterapii adiuwantowej. W stopniu pN2 preferuje się chemioterapię adiuwantową polegającą na podaniu 2 kursów BEP lub EP. W stopniu pN3 podaje się 3 kursy BEP albo 4 kursy EP, a samodzielny nadzór nie jest stosowany[255][284]. Po wykonanej limfadenektomii dalszy nadzór onkologiczny jest prostszy niż schemat aktywnego nadzoru po samodzielnej orchidektomii[254].
Leczenie nienasieniaków w stopniu zaawansowania IIA
W stadium II leczenie polega na chemioterapii, choć u chorych z nienasieniakiem w stadium IIA bez podwyższonego stężenia markerów notworowych leczenie może polegać na limfadenektomii zaotrzewnowej lub wyłącznym nadzorze[285]. Niezależnie od metody postępowania w stadium II odsetek wyleczeń osiąga 98%[286][287][288][285][289]. Węzły chłonne zaotrzewnowe są pierwszym miejscem występowania przerzutów[290]. U części chorych z podejrzanym obrazem węzłów chłonnych bez podwyższonego stężenia markerów nowotworowych limfadenopatia ma łagodny charakter, choć część jest związana z chorobą nowotworową[289]. Weryfikację histologiczną umożliwia wykonanie limfadenektomii lub biopsja chirurgiczna[291].
Wybór formy postępowania w stadium w IIA (T1–T4N1M0S0–S1) zależy od stężenia markerów nowotworowych po wykonaniu orchidektomii[256]. U chorych w stadium IIA z prawidłowym stężeniem AFP lub β-hCG stosuje się aktywny nadzór albo wykonuje się limfadenektomię zaotrzewnową lub podaje się chemioterapię złożoną z 3 kursów BEP albo 4 EP[292].
W tym etapie zaawansowania aktywny nadzór polega na wykonaniu kontroli w badaniach obrazowych po 6 tygodniach. Jeśli w kontrolnym badaniu zmiana ulega zmniejszeniu, najprawdopodobniej nie ma charakteru nowotworowego, ale wskazana jest dalsza obserwacja. Zmiany stabilne lub rosnące mogą wskazywać na obecność potworniaka lub nowotworu nisko zróżnicowanego. Jeśli zmiana ulega powiększeniu bez wzrostu stężenia markerów, to wykonuje się limfadenektomię zaotrzewnową. Gdy zmiana rośnie i wzrastają stężenia AFP lub β-hCG, to w dalszym leczeniu stosuje się chemioterapię za pomocą 3 kursów BEP[285]. Alternatywą u tych chorych jest wykonanie biopsji podejrzanej zmiany pod kontrolą TK[285].
Innymi metodami postępowania u chorych w stadium IIA bez podwyższonych stężeń markerów nowotworowych są chemioterapia lub pierwotna limfadenektomia zaotrzewnowa z oszczędzeniem nerwów. Obie metody oferują podobne wyniki, jednak różnią się towarzyszącymi działaniami niepożądanymi[293][285]. Po limfadenektomii w konsekwencji ponownej oceny rozległości zajęcia węzłów chłonnych część chorych wymaga leczenia uzupełniającego. W przypadku niestwierdzenia obecności przerzutów (pN0) stosuje się wyłącznie aktywny nadzór. W przypadku zajęcia węzłów w stopniu pN1 preferuje się aktywny nadzór albo podaje się dwa cykle BEP. Stwierdzenie zajęcia węzłów chłonnych pN2 wskazuje na potrzebę podania 2 cykli BEP, a alternatywnym postępowaniem jest aktywny nadzór. Zaawansowanie pN3 po limfadenektomii zaotrzewnowej wymaga podania 3 kursów BEP[294].
U chorych w stadium IIA z podwyższonym stężeniem AFP lub β-hCG w leczeniu stosuje się chemioterapię z zastosowaniem 3 kursów BEP lub 4 EP[295][256]. Na wybór chemioterapii w tej grupie chorych wskazują wyniki dwóch badań retrospektywnych[296][297][256]. Podwyższone stężenie markerów nowotworowych jest czynnikiem wysokiego ryzyka nawrotu choroby[256].
Leczenie nienasieniaków w stopniu zaawansowania IIB
Chemioterapia jest podstawową metodą leczenia nienasieniaków w stadium II i III[253][285][290]. W stadium IIB w leczeniu stosuje się 3 cykle BEP lub 4 kursy EP[292]. Jeśli rozsiew jest ograniczony do węzłów chłonnych zaotrzewnowych, a stężenia AFP i β-hCG są prawidłowe, to według NCCN u starannie wybranych chorych w leczeniu można wykorzystać również limfadenektomię zaotrzewnową, a następnie leczenie uzupełniające[298][256].
Leczenie nienasieniaków w stopniu zaawansowania IIC
Leczenie nienasieniaka w stopniu IIC polega na podaniu 3 kursów BEP lub 4 kursów EP[292].
Leczenie nienasieniaków w stopniu zaawansowania III
Leczenie nienasieniaków w stadium zaawansowania III jest oparte o chemioterapię zawierającą cisplatynę[290]. Intensywność leczenia zależy od oceny rokowania chorego. W przypadku zakwalifikowania chorego do grupy korzystnego rokowania leczenie polega na podaniu 3 kursów programu BEP albo 4 cyklów programu EP. Rokowanie pośrednie i niekorzystne wymaga podania 4 kursów BEP[299].
- Nienasieniak o korzystnym rokowaniu
Według IGCCCG grupa zaawansowanego nienasieniaka o korzystnym rokowaniu obejmuje stadia kliniczne IS, IIA, IIB, IIC i IIIA[300]. W leczeniu stosuje się 3 kursy BEP (bleomycyna, etopozyd, cisplatyna) lub 4 kursy EP (etopozyd, cisplatyna)[240][300][290].
Program BEP okazał się skuteczniejszy i mniej toksyczny niż wcześniej stosowany PVB (cisplatyna, winblastyna i bleomycyna)[301][302][303][240][259]. Program BEP najczęściej stosuje się w schemacie pięciodniowym, który wobec schematu trzydniowego jest mniej toksyczny przy uzyskaniu podobnej skuteczności[304][240]. Unika się redukcji dawki leków, ale wydłużanie 21-dniowego rytmu cykli bywa stosowane przy nasilonych toksycznościach[240]. Program EP stosuje się w przypadku przeciwwskazań do stosowania bleomycyny[240].
Nie ma wielu badań porównujących programy BEP i EP. W badaniu EORTC program BEP pozwalał osiągnąć wyższy odsetek odpowiedzi całkowitych (CR) (95% dla BEP i 87% dla EP), jednak nie wykazano różnicy pomiędzy schematami w osiąganych przeżyciach całkowitych (OS) ani czasie do progresji (TTP)[302][290]. W innym badaniu Culine i współpracowników zastosowanie programów BEP i EP dało podobny odsetek odpowiedzi całkowitych (CR) i częściowych (PR) oraz nie wykazano istotnej statystycznie różnicy w osiąganym odsetku czteroletniego przeżycia całkowitego[305][290]. Oba programy są dobrze tolerowane i pozwalają na wyleczenie około 90% chorych na nienasieniaka o korzystnym rokowaniu[306][307][300].
- Nienasieniak o pośrednim rokowaniu
W leczeniu zaawansowanego nienasieniaka o pośrednim rokowaniu stosuje się 4 kursy BEP[300]. U chorych z przeciwwskazaniami do bleomycyny podaje się 4 kursy programu VIP (PEI) składającego się z winblastyny, ifosfamidu, mesny i cisplatyny[300][240]. Leczenie pozwala na wyleczenie około 80% chorych[308][240].
W badaniu porównującym skuteczność programów BEP i VIP w pierwszej linii leczenia chorych na zaawansowanego nienasieniaka o pośrednim lub niekorzystnym rokowaniu nie wykazano różnicy w osiąganych przez chorych odsetkach odpowiedzi całkowitych (CR), przeżyciach całkowitych (OS) i przeżyciach wolnych od choroby (DFS)[308]. Pozwala to stosować VIP zamiast BEP u chorych z przeciwwskazaniami do bleomycyny, choć kosztem większej toksyczności hematologicznej[259].
- Nienasieniak o niekorzystnym rokowaniu
W leczeniu zaawansowanego nienasieniaka o niekorzystnym rokowaniu stosuje się 4 kursy BEP[240][300]. U chorych z przeciwwskazaniami do bleomycyny wykorzystuje się 4 kursy programu VIP (PEI)[300][240]. Ocenia się, że w wyniku leczenia 4 kursami BEP około 50% chorych osiąga długoletnie przeżycie[240][300].
U chorych z rozległym zajęciem płuc po włączeniu leczenia występuje ryzyko rozwoju ARDS, związanego z rozpadem guza nowotworowego oraz zakażeniami spowodowanymi neutropenią. Podanie u tych chorych pierwszego zmodyfikowanego cyklu BEP bez bleomycyny w schemacie trzydniowym, najprawdopodobniej zmniejsza wczesną śmiertelność[309][244].
Postępowanie po chemioterapii indukcyjnej
Po około 6 tygodniach od zakończenia chemioterapii indukcyjnej ponownie ocenia się zaawansowanie wykonując tomografię komputerową lub rezonans magnetyczny brzucha z miednicą oraz tomografię albo zdjęcie rentgenowskie klatki piersiowej[253][244]. Również ponownie ocenia się stężenia markerów nowotworowych[244][310]. Dalsze postępowanie zależy od obecności guza resztkowego, obecności powiększonych węzłów chłonnych oraz podwyższonego stężenia AFP lub β-hCG[310].
W przypadku stwierdzenia całkowitej odpowiedzi oraz prawidłowego stężenia markerów nowotworowych nie jest konieczne dalsze leczenie, a chorych poddaje się dalszemu nadzorowi onkologicznemu[253].
U ponad 70% chorych leczonych chemioterapią pierwszej linii obserwuje się całkowitą odpowiedź z całkowitym zaniknięciem guza i normalizacją markerów nowotworowych, jednak u 30% chorych po chemioterapii obserwuje się obecność guza resztkowego[311]. Jedynie u 6–10% chorych po chemioterapii za pomocą BEP masa resztkowa zawiera żywe utkanie nowotworu germinalnego, w 50% stwierdza się potworniaka, a w 40% w zmianach obecna jest martwica lub tkanka włóknista[244][312][313][311]. Z kolei wykorzystywany w ocenie charakteru zmian resztkowych PET ma ograniczoną wartość predykcyjną[314][244][310].
Według EUA zmiany resztkowe o wielkości przekraczającej 1 cm przy prawidłowych stężeniach markerów nowotworowych wycina się. Resekcji poddaje się wszystkie guzy resztkowe w ciągu 2–6 tygodni od zakończenia chemioterapii pierwszej linii[315][310]. Rola resekcji zmian resztkowych o wielkości poniżej 1 cm jest mniej jasna[315]. Według EUA takie zmiany po pierwszej linii leczenia poddaje się resekcji lub obserwuje, przy czym wycina się wszystkie zmiany resztkowe u chorych po leczeniu kolejnej linii[315]. Przesłanką do wycinania wszystkich zmian resztkowych jest możliwość obecności żywego utkania nowotworu lub potworniaka niezależnie od rozpoznania radiologicznej całkowitej remisji[315]. Jednak w seriach z wieloletnią obserwacją chorych z guzem resztkowym po chemioterapii poniżej 1 cm jedynie u poniżej 10% chorych rozpoznaje się nawrót choroby[316][247][315]. Z kolei ESMO i NCCN sugerują, o ile jest to możliwe technicznie, resekcję wszystkich zmian resztkowych (niezależnie od ich wielkości)[310][295][317].
Dalsze postępowanie po resekcji zależy od wyniku badania histopatologicznego preparatu uzyskanego po wycięciu guza resztkowego. Jeśli wyresekowana zmiana resztkowa jest zbudowana z martwicy lub dojrzałego albo niedojrzałego potworniaka, to nie ma konieczności dalszego leczenia[315][317]. U chorych z dobrym rokowaniem z kompletną resekcją guza resztkowego (resekcja R0) z obecnym żywym utkaniem nowotworu stanowiącym poniżej 10% masy resztkowej nawroty są rzadkie i chorzy nie osiągają korzyści z chemioterapii konsolidującej[318][319][315][317]. Z kolei chorzy z pośrednim lub niekorzystnym rokowaniem, po niekompletnej resekcji guza resztkowego lub obecnym żywym utkaniem nowotworu stanowiącym powyżej 10% wymagają chemioterapii konsolidującej[317][320]. W ramach chemioterapii konsolidującej podaje się 2 kursy chemioterapii opartej o cisplatynę (EP, VIP, TIP)[295].
Chorzy, u których nie osiągnięto całkowitej odpowiedzi za pomocą pierwszej linii leczenia kwalifikuje się do drugiej linii leczenia[310].
Leczenie nawrotu nienasieniaków i nasieniaków
Nawrót po leczeniu miejscowym
Nawrót u chorych poddanych wyłącznie aktywnemu nadzorowi leczy się na zasadach leczenia pierwotnego. Nawrót po radioterapii w zależności od kategorii rokowniczej wymaga podania 3 kursów BEP lub 4 EP albo 4 kursów BEP[321].
Nawrót po chemioterapii I linii
U około 15–20% chorych z zaawansowanym nowotworem jąder dochodzi do nawrotu po pierwszej linii leczenia[204]. Blisko połowę z tych chorych można wyleczyć leczeniem drugiej linii (tzw. „chemioterapia ratunkowa”, ang. salvage treatment), choć zależy to od czynników rokowniczych[322][204]. W drugiej linii leczenia stosuje się chemioterapię w standardowych dawkowaniu lub chemioterapię wysokodawkową[204].
W leczeniu nawrotów po chemioterapii I linii (indukcyjnej) stosuje się 4 kursy chemioterapii wielolekowej opartej o cisplatynę w skojarzeniu z ifosfamidem[322]. Najczęściej wykorzystuje się schematy TIP (cisplatyna, ifosfamid, paklitaksel), VeIP (winblastyna, ifosfamid, cisplatyna) i VIP (PEI) (cisplatyna, etopozyd, ifosfamid)[317][321]. Programu BEP nie stosuje się w drugiej linii, ponieważ jego zastosowanie wiązałoby się z przekroczeniem łącznej dawki bleomycyny[321]. Nie istnieją randomizowane badania kliniczne porównujące skuteczność tych programów[322]. Skuteczność TIP, VeIP czy VIP jest porównywalna[317][323]. U leczonych za pomocą TIP w badaniu na 46 chorych u 63% leczonych zaobserwowano długotrwałą remisję, a ponadto skojarzenie paklitakselu z cisplatyną i ifosfamidem wykazało przewagę nad połączeniem wyłącznie cisplatyny i ifosfamidu[324][323]. U leczonych za pomocą VIP lub VeIP w poszczególnych badaniach osiągano 7–26% odsetek długotrwałych odpowiedzi[325][326][327][328][329][323].
Kolejną opcją leczenia w przypadku nawrotu po pierwszej linii leczenia jest chemioterapia wysokodawkowa z autologicznym przeszczepieniem szpiku kostnego[204]. Metoda jest oparta o zależność efektu cytotoksycznego od dawki[330]. Protokoły chemioterapii wysokodawkowej składają się z 2–3 kursów zawierających karboplatynę oraz etopozyd z lub bez cyklofosfamidu albo ifosfamidu[323]. Nie ma badań porównujących poszczególne programy chemioterapii wysokodawkowej[323]. Jednak ze względu na mniejszą śmiertelność związaną z leczeniem preferuje się program HD-CE[331][322]. W największym badaniu 63% chorych osiągnęło długotrwałe odpowiedzi całkowite[332][323]. Programy zawierające jeden cykl chemioterapii wysokodawkowej poprzedzone kilkoma cyklami leczenia w standardowych dawkach są mniej skuteczne niż protokoły zawierające dwa czy trzy cykle wysokodawkowej chemioterapii[333][323].
Ze względu na ograniczoną ilość dowodów nie można jednoznacznie wskazać grupy chorych, u których korzystna jest intensyfikacja leczenia z zastosowaniem chemioterapii wysokodawkowej, a u których optymalne jest zastosowanie chemioterapii w standardowych dawkach[322][310][323]. Jednak duże prospektywne badania u chorych z progresją po pierwszej linii chemioterapii pomogły wyróżnić 5 grup rokowniczych o różnym ryzyku nawrotu[334][335][336][322]. Niektórzy autorzy sugerują stosowanie chemioterapii wysokodawkowej z przeszczepieniem szpiku u chorych w grupach pośredniego oraz wysokiego ryzyka nawrotu, a stosowanie chemioterapii w standardowych dawkach w grupie niskiego ryzyka, inni proponują wykorzystanie chemioterapii wysokodawkowej u wszystkich chorych z nawrotem po chemioterapii pierwszej linii[330].
W jednym badaniu prospektywnym nie wykazano różnicy odsetka przeżycia całkowitego pomiędzy chemioterapią w standardowych dawkach z użyciem 4 kursów VeIP a 3 kursami VeiP i 1 kursem chemioterapii wysokodawkowej CarboPEC, ale wartość badania ogranicza zastosowanie jednego kursu wysokodawkowej chemioterapii, podczas gdy 2 kursy są uważane za niezbędne w celu osiągnięcia korzyści z leczenia[333][323]. W dużej analizie na blisko 1600 chorych we wszystkich grupach rokowniczych opisano poprawę przeżycia całkowitego o około 10% u chorych leczonych chemioterapią wysokodawkową w porównaniu z leczeniem w rutynowym dawkowaniu[337][330][322]. Również w innej retrospektywnej analizie na 193 chorych porównującej chemioterapię wysokodawkową z chemioterapią w standardowych dawkach u leczonych chemioterapią wysokodawkową zaobserwowano poprawę odsetku przeżycia całkowitego o 10%[338][323].
Leczenie chirurgiczne po chemioterapii II linii
Obecność guza resztkowego po chemioterapii II linii (ratunkowej) może wymagać jego resekcji. Warunkiem jest możliwość wycięcia wszystkich guzów resztkowych i prawidłowe stężenie markerów nowotworowych[315][323]. Resekcja masy resztkowej pozwala uzyskać długotrwałe remisje u 20% chorych[339][340][315].
U wybranych chorych resekcji poddaje się zmiany niereagujące na leczenie lub ulegające progresji radiologicznej lub ze wzrostem stężenia markerów nowotworowych[315].
Kolejny nawrót
Nie ma randomizowanych badań klinicznych oceniających skuteczność leczenia III linii. U niektórych chorych leczonych dwoma liniami chemioterapii w konwencjonalnych dawkach można zastosować chemioterapię wysokodawkową, która pozwala na wyleczenie 20–25% chorych[341].
Progresja choroby lub nawrót w ciągu 4–8 tygodni od zakończenia chemioterapii może być związany z platynoopornością. U tych chorych stosuje się połączenia gemcytabiny z paklitakselem oraz gemcytabiny, oksaliplatyny i paklitakselu. U części chorych ponownie wprowadza się cisplatynę w połączeniu z gemcytabiną i paklitakselem[341].
Leczenie paliatywne
U chorych z przetrwałą lub nawrotową chorobą leczenie dalsze leczenie może mieć charakter paliatywny i mieć na celu kontrolę choroby oraz kontrolę objawów[323]. W ramach chemioterapii paliatywnej wykorzystuje się połączenie gemcytabiny i oksaliplatyny (GEMOX), połączenie gemcytabiny, oksaliplatyny i paklitakselu, połączenie gemcytabiny i paklitakselu lub monoterapię etopozydem[342].
Rokowanie
Rokowanie w nowotworze jądra jest bardzo dobre[343]. W analizie SEER 95,1% chorych na nowotwór jądra osiąga przeżycie pięcioletnie[344]. Dziesięcioletnie przeżycie swoiste dla nowotworu jest oceniane na 88–91%[345]. Podobnie w pracy Verhoeven i współpracowników analizującej przeżycia całkowite chorych na nowotwór jądra w Europie i Stanach Zjednoczonych 98% chorych na nasieniaka osiąga przeżycie pięcioletnie, a u chorych na nienasieniaka przeżycie jest niższe o około 3–6%[346]. W zależności od stopnia zaawansowania klinicznego odsetki przeżyć pięcioletnich dla stadium I wynoszą ponad 99%, dla stadium II około 95% i dla stadium III 70–80%[343][22].
Weterynaria
Nowotwory jąder występują również u zwierząt. Pierwotne nowotwory jąder są stosunkowo częste u starszych psów, w mniejszym stopniu dotyczą byków. U innych gatunków są one rzadkie. Częstość występowania poszczególnych podtypów najlepiej została przebadana u psów, u których najczęściej występują nasieniak, nowotwór z komórek Sertolego i nowotwór z komórek Leydiga, a pozostałe podtypy są bardzo rzadkie[347]. Nowotwory jąder u zwierząt zwykle są rozpoznawane na etapie choroby zlokalizowanej, przerzuty są rzadkie i choroba zwykle wiąże się ze stosunkowo niską śmiertelnością[347][348].
Choroba objawia się jako obecność masy w obrębie worka mosznowego, która może być wykazana podczas badania palpacyjnego lub za pomocą ultrasonografu. Nowotwór może wiązać się z hiperestrogenizmem objawiającym się ginekomastią, mlekotokiem, hiperpigmentacją, obustronnym symetrycznym łysieniem i atrofią prącia. Podstawową metodą leczenia nowotworów bez przerzutów jest orchidektomia. W przypadku obecności przerzutów możliwości leczenia są ograniczone. Istnieją pojedyncze doniesienia dotyczące stosowania radioterapii i chemioterapii[348].
Historia
Do połowy XX wieku nowotwór jąder był uleczalny jedynie w najwcześniejszych etapach zaawansowania. Podstawą leczenia była orchidektomia, wycięcie zaotrzewnowych węzłów chłonnych oraz napromieniowanie na obszar zaotrzewnowych węzłów chłonnych. W przypadku wykrycia przerzutów odległych napromieniowywano również lokalizacje występowania przerzutów, w tym również jamę brzuszną, śródpiersie, płuca oraz okolicę nadobojczykową[349].
Przed wprowadzeniem chemioterapii rozpoznanie przerzutów odległych wiązało się z bardzo niskim wskaźnikiem wyleczeń i 90% śmiertelnością w ciągu 1 roku. W latach 50. i 60. leczenie zrewolucjonizowało wprowadzenie pierwszych cytostatyków, w tym leków alkilujących, metotreksatu czy aktynomycyny D[349]. W 1960 roku Li i współpracownicy dowiedli, że chemioterapia złożona aktynomycyny D oraz chlorambucylu i metotreksatu powoduje trwałe remisje u 10–20% chorych i u 5% chorych dochodzi do wyleczenia[350][349]. Na początku lat 70. odkryto aktywność bleomycyny[351] i winblastyny[352] w leczeniu nowotworów jąder, następnie odkryto, że połączenie bleomycyny i winblastyny skutkuje znaczną poprawą odsetka odpowiedzi na leczenie[353]. W pierwszej połowie lat 70. wykazano aktywność cisplatyny, co okazało się przełomem w leczeniu choroby[354]. Cisplatynę, winblastynę i bleomycynę połączono w program PVB, który skutkował znaczącą poprawą odsetka przeżyć pięcioletnich osiągającego 64%[355]. W 1971 roku rozpoczęto badania nad skutecznością etopozydu, wykazano jego aktywność w nawrotowym nowotworze jądra oraz synergizm z cisplatyną (program EP)[356][349]. Na podstawie tych badań połączenie etopozydu i cisplatyny stało się standardowym leczeniem II linii[349]. W 1975 roku opracowano program VAB-6 składający się z cisplatyny, winblastyny, bleomycyny, cyklofosfamidu i aktynomycyny D, który wywoływał 67% odsetek całkowitych remisji[357][349]. Następnie porównano VAB-6 z EP i wykazano przewagę EP obserwując 90% odsetek odpowiedzi[358]. W latach 80. oceniano możliwość wymiany winblastyny na etopozyd w leczeniu I linii. Porównano program PVB (cisplatyna, winblastyna, bleomycyna) z BEP (cisplatyna, etopozyd, platyna) i wykazano przewagę BEP[359]. Na podstawie tego i kolejnych badań BEP nadal pozostaje standardem leczenia nowotworów jądra[349]. Badania z lat 90. i późniejsze pozwoliły zidentyfikować grupy ryzyka nawrotu i zoptymalizować intensywność leczenia[349].
Uwagi
Przypisy
- ↑ a b Stachura i Domagała 2009 ↓, s. 982.
- ↑ Krajowy Rejestr Nowotworów: Jądro. [dostęp 2018-04-03]. [zarchiwizowane z tego adresu].
- ↑ a b Eble i in. 2004 ↓, s. 222.
- ↑ a b c Gilligan i in. 2017 ↓, s. 37.
- ↑ a b c d e Albers i in. 2016 ↓, s. 14.
- ↑ a b c d e f g h i j k l m n Y. Ehrlich, D. Margel, M.A. Lubin, J. Baniel. Advances in the treatment of testicular cancer. „Transl Androl Urol”. 4 (3), s. 381–390, 2015. DOI: 10.3978/j.issn.2223-4683.2015.06.02. PMID: 26816836.
- ↑ a b Albers i in. 2016 ↓, s. 8.
- ↑ Gilligan i in. 2017 ↓, s. 36.
- ↑ a b c d e f g h i j k l m n R.P. Manecksha, J.M. Fitzpatrick. Epidemiology of testicular cancer. „BJU Int”. 104, s. 1329–1333, 2009. DOI: 10.1111/j.1464-410X.2009.08854.x. PMID: 19840008.
- ↑ T. Shanmugalingam, A. Soultati, S. Chowdhury, S. Rudman i inni. Global incidence and outcome of testicular cancer. „Clin Epidemiol”. 5, s. 417–427, 2013. DOI: 10.2147/CLEP.S34430. PMID: 24204171.
- ↑ Krzakowski i in. 2015 ↓, s. 769.
- ↑ J. Ferlay, I. Soerjomataram, M. Ervi, R. Dikshit, S. Eser, C. Mathers, M. Rebelo, D.M. Parkin, D. Forman, F. Bray: GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012 v1.0 IARC CancerBase No. 11. IARC, 2013. ISBN 978-92-832-2447-1.
- ↑ E. Huyghe, T. Matsuda, P. Thonneau. Increasing incidence of testicular cancer worldwide: a review. „J Urol”. 170 (1), s. 5–11, 2003. DOI: 10.1097/01.ju.0000053866.68623.da. PMID: 12796635.
- ↑ M.P. Curado i inni, Cancer Incidence in Five Continents Vol. IX, IARC, 2007, ISBN 978-92-832-2160-9 [dostęp 2018-04-09] [zarchiwizowane z adresu 2018-07-22].
- ↑ C. La Vecchia, C. Bosetti, F. Lucchini, P. Bertuccio i inni. Cancer mortality in Europe, 2000-2004, and an overview of trends since 1975. „Ann Oncol”. 21 (6), s. 1323–1360, 2010. DOI: 10.1093/annonc/mdp530. PMID: 19948741.
- ↑ a b c d e f g h i j k K.A. McGlynn, M.B. Cook. Etiologic factors in testicular germ-cell tumors. „Future Oncol”. 5 (9), s. 1389–1402, 2009. DOI: 10.2217/fon.09.116. PMID: 19903067.
- ↑ a b K.A. McGlynn, B. Trabert. Adolescent and adult risk factors for testicular cancer. „Nat Rev Urol”. 9 (6), s. 339–349, 2012. DOI: 10.1038/nrurol.2012.61. PMID: 22508459.
- ↑ B. Trabert, J. Chen, S.S. Devesa, F. Bray i inni. International patterns and trends in testicular cancer incidence, overall and by histologic subtype, 1973-2007. „Andrology”. 3 (1), s. 4–12, 2015. DOI: 10.1111/andr.293. PMID: 25331326.
- ↑ a b c d e f O. Khan, A. Protheroe. Testis cancer. „Postgrad Med J”. 83 (984), s. 624–632, 2007. DOI: 10.1136/pgmj.2007.057992. PMID: 17916870.
- ↑ M.J. Garner, M.C. Turner, P. Ghadirian, D. Krewski. Epidemiology of testicular cancer: an overview. „Int J Cancer”. 116 (3), s. 331–339, 2005. DOI: 10.1002/ijc.21032. PMID: 15818625.
- ↑ KRN: Nowotwory złośliwe jądra (C62). [dostęp 2017-11-04]. [zarchiwizowane z tego adresu].
- ↑ a b c d e f g h S.M. Stevenson, W.T. Lowrance. Epidemiology and Diagnosis of Testis Cancer. „Urol Clin North Am”. 42 (3), s. 269–275, 2015. DOI: 10.1016/j.ucl.2015.04.001. PMID: 26216814.
- ↑ a b A. Pettersson, L. Richiardi, A. Nordenskjold, M. Kaijser i inni. Age at surgery for undescended testis and risk of testicular cancer. „N Engl J Med”. 356 (18), s. 1835–1841, 2007. DOI: 10.1056/NEJMoa067588. PMID: 17476009.
- ↑ C. Myrup, T.H. Schnack, J. Wohlfahrt. Correction of cryptorchidism and testicular cancer. „N Engl J Med”. 357 (8), s. 825–827, 2007. DOI: 10.1056/NEJMc071510. PMID: 17715418.
- ↑ K.P. Dieckmann, U. Pichlmeier. Clinical epidemiology of testicular germ cell tumors. „World J Urol”. 22 (1), s. 2–14, 2004. DOI: 10.1007/s00345-004-0398-8. PMID: 15034740.
- ↑ a b S.D. Fosså, J. Chen, S.J. Schonfeld, K.A. McGlynn i inni. Risk of contralateral testicular cancer: a population-based study of 29,515 U.S. men. „J Natl Cancer Inst”. 97 (14), s. 1056–1066, 2005. DOI: 10.1093/jnci/dji185. PMID: 16030303.
- ↑ A. Osterlind, J.G. Berthelsen, N. Abildgaard, S.O. Hansen i inni. Risk of bilateral testicular germ cell cancer in Denmark: 1960-1984. „J Natl Cancer Inst”. 83 (19), s. 1391–1395, 1991. PMID: 1656057.
- ↑ K.P. Dieckmann, V. Loy. Prevalence of contralateral testicular intraepithelial neoplasia in patients with testicular germ cell neoplasms. „J Clin Oncol”. 14 (12), s. 3126–3132, 1996. DOI: 10.1200/JCO.1996.14.12.3126. PMID: 8955658.
- ↑ H. von der Maase, M. Rørth, S. Walbom-Jørgensen, B.L. Sørensen i inni. Carcinoma in situ of contralateral testis in patients with testicular germ cell cancer: study of 27 cases in 500 patients. „Br Med J (Clin Res Ed)”. 293 (6559), s. 1398–1401, 1986. PMID: 3026550.
- ↑ a b K. Hemminki, X. Li. Familial risk in testicular cancer as a clue to a heritable and environmental aetiology. „Br J Cancer”. 90 (9), s. 1765–1770, 2004. DOI: 10.1038/sj.bjc.6601714. PMID: 15208620.
- ↑ K.P. Dieckmann, U. Pichlmeier. The prevalence of familial testicular cancer: an analysis of two patient populations and a review of the literature. „Cancer”. 80 (10), s. 1954–1960, 1997. PMID: 9366298.
- ↑ K. Hemminki, K. Czene. Attributable risks of familial cancer from the Family-Cancer Database. „Cancer Epidemiol Biomarkers Prev”. 11 (12), s. 1638–1644, 2002. PMID: 12496055.
- ↑ K. Hemminki, B. Chen. Familial risks in testicular cancer as aetiological clues. „Int J Androl”. 29 (1), s. 205–210, 2006. DOI: 10.1111/j.1365-2605.2005.00599.x. PMID: 16466541.
- ↑ K. Hemminki, X. Li. Cancer risks in twins: results from the Swedish family-cancer database. „Int J Cancer”. 99 (6), s. 873–878, Jun 2002. DOI: 10.1002/ijc.10441. PMID: 12115491.
- ↑ A.J. Swerdlow, B.L. De Stavola, M.A. Swanwick, N.E. Maconochie. Risks of breast and testicular cancers in young adult twins in England and Wales: evidence on prenatal and genetic aetiology. „Lancet”. 350 (9093), s. 1723–1728, 1997. PMID: 9413462.
- ↑ M.M. Braun, A. Ahlbom, B. Floderus, L.A. Brinton i inni. Effect of twinship on incidence of cancer of the testis, breast, and other sites (Sweden). „Cancer Causes Control”. 6 (6), s. 519–524, 1995. PMID: 8580300.
- ↑ V.P. Doria-Rose, M.L. Biggs, N.S. Weiss. Subfertility and the risk of testicular germ cell tumors (United States). „Cancer Causes Control”. 16 (6), s. 651–656, 2005. DOI: 10.1007/s10552-005-0169-x. PMID: 16049803.
- ↑ J.D. Raman, C.F. Nobert, M. Goldstein. Increased incidence of testicular cancer in men presenting with infertility and abnormal semen analysis. „J Urol”. 174 (5), s. 1819–1822, Nov 2005. DOI: 10.1097/01.ju.0000177491.98461.aa. PMID: 16217294.
- ↑ M. Mancini, L. Carmignani, G. Gazzano, P. Sagone i inni. High prevalence of testicular cancer in azoospermic men without spermatogenesis. „Hum Reprod”. 22 (4), s. 1042–1046, 2007. DOI: 10.1093/humrep/del500. PMID: 17220165.
- ↑ Katarzyna Bajszczak, Maria Szarras-Czapnik, Jolanta Słowikowska-Hilczer. Zaburzenia rozwoju płci – nowa nomenklatura oraz wytyczne w postępowaniu terapeutycznym. „Seksuologia Polska”, 2014. [zarchiwizowane z adresu].
- ↑ a b c d e M. Kathrins, T.F. Kolon. Malignancy in disorders of sex development. „Transl Androl Urol”. 5 (5), s. 794–798, 2016. DOI: 10.21037/tau.2016.08.09. PMID: 27785439.
- ↑ Katarzyna Bajszczak, Jolanta Słowikowska-Hilczer. Problemy terapeutyczne w zaburzeniach rozwoju płci. „Pediatric Endocrinology, Diabetes & Metabolism”, 2016.
- ↑ R. Hersmus, H. Stoop, S.J. White, S.L. Drop i inni. Delayed Recognition of Disorders of Sex Development (DSD): A Missed Opportunity for Early Diagnosis of Malignant Germ Cell Tumors. „Int J Endocrinol”. 2012, 2012. DOI: 10.1155/2012/671209. PMID: 22315593.
- ↑ a b c J. Pleskacova, R. Hersmus, J.W. Oosterhuis, B.A. Setyawati i inni. Tumor risk in disorders of sex development. „Sex Dev”. 4 (4–5), s. 259–269, Sep 2010. DOI: 10.1159/000314536. PMID: 20558977.
- ↑ M.M. Joki-Erkkilä, R. Karikoski, I. Rantala, H.L. Lenko i inni. Gonadoblastoma and dysgerminoma associated with XY gonadal dysgenesis in an adolescent with chronic renal failure: a case of Frasier syndrome. „J Pediatr Adolesc Gynecol”. 15 (3), s. 145–149, 2002. PMID: 12106750.
- ↑ J. Pelletier, W. Bruening, C.E. Kashtan, S.M. Mauer i inni. Germline mutations in the Wilms’ tumor suppressor gene are associated with abnormal urogenital development in Denys-Drash syndrome. „Cell”. 67 (2), s. 437–447, 1991. PMID: 1655284.
- ↑ L.H. Looijenga, R. Hersmus, J.W. Oosterhuis, M. Cools i inni. Tumor risk in disorders of sex development (DSD). „Best Pract Res Clin Endocrinol Metab”. 21 (3), s. 480–495, 2007. DOI: 10.1016/j.beem.2007.05.001. PMID: 17875493.
- ↑ C.M. Smyth, W.J. Bremner. Klinefelter syndrome. „Arch Intern Med”. 158 (12), s. 1309–1314, 1998. PMID: 9645824.
- ↑ G. Accardo, G. Vallone, D. Esposito, F. Barbato i inni. Testicular parenchymal abnormalities in Klinefelter syndrome: a question of cancer? Examination of 40 consecutive patients. „Asian J Androl”. 17 (1). s. 154–158. DOI: 10.4103/1008-682X.128514. PMID: 25130577.
- ↑ A.J. Swerdlow, C.D. Higgins, M.J. Schoemaker, A.F. Wright i inni. Mortality in patients with Klinefelter syndrome in Britain: a cohort study. „J Clin Endocrinol Metab”. 90 (12), s. 6516–6522, 2005. DOI: 10.1210/jc.2005-1077. PMID: 16204366.
- ↑ H. Hasle, A. Mellemgaard, J. Nielsen, J. Hansen. Cancer incidence in men with Klinefelter syndrome. „Br J Cancer”. 71 (2), s. 416–420, 1995. PMID: 7841064.
- ↑ H.T. Heller, M.C. Oliff, P.M. Doubilet, M.P. O’Leary i inni. Testicular microlithiasis: prevalence and association with primary testicular neoplasm. „J Clin Ultrasound”. 42 (7), s. 423–426, 2014. DOI: 10.1002/jcu.22144. PMID: 24585495.
- ↑ M.L. Cooper, M. Kaefer, R. Fan, R.C. Rink i inni. Testicular microlithiasis in children and associated testicular cancer. „Radiology”. 270 (3), s. 857–863, 2014. DOI: 10.1148/radiol.13130394. PMID: 24475810.
- ↑ B.J. DeCastro, A.C. Peterson, R.A. Costabile. A 5-year followup study of asymptomatic men with testicular microlithiasis. „J Urol”. 179 (4), s. 1420–1423, 2008. DOI: 10.1016/j.juro.2007.11.080. PMID: 18289592.
- ↑ D.A. Hill, G. Gridley, S. Cnattingius, L. Mellemkjaer i inni. Mortality and cancer incidence among individuals with Down syndrome. „Arch Intern Med”. 163 (6), s. 705–711, 2003. PMID: 12639204.
- ↑ K. Patja, E. Pukkala, R. Sund, M. Iivanainen i inni. Cancer incidence of persons with Down syndrome in Finland: a population-based study. „Int J Cancer”. 118 (7), s. 1769–1772, 2006. DOI: 10.1002/ijc.21518. PMID: 16231334.
- ↑ H. Hasle, J.M. Friedman, J.H. Olsen, S.A. Rasmussen. Low risk of solid tumors in persons with Down syndrome. „Genet Med”. 18 (11), s. 1151–1157, 2016. DOI: 10.1038/gim.2016.23. PMID: 27031084.
- ↑ a b T.P. Cooley. Non-AIDS-defining cancer in HIV-infected people. „Hematol Oncol Clin North Am”. 17 (3), s. 889–899, 2003. PMID: 12852661.
- ↑ J.J. Goedert, M.P. Purdue, T.S. McNeel, K.A. McGlynn i inni. Risk of germ cell tumors among men with HIV/acquired immunodeficiency syndrome. „Cancer Epidemiol Biomarkers Prev”. 16 (6), s. 1266–1269, 2007. DOI: 10.1158/1055-9965.EPI-07-0042. PMID: 17548695.
- ↑ M. Frisch, R.J. Biggar, E.A. Engels, J.J. Goedert. Association of cancer with AIDS-related immunosuppression in adults. „JAMA”. 285 (13), s. 1736–1745, 2001. PMID: 11277828.
- ↑ J.J. Goedert, T.R. Coté, P. Virgo, S.M. Scoppa i inni. Spectrum of AIDS-associated malignant disorders. „Lancet”. 351 (9119), s. 1833–1839, 1998. PMID: 9652666.
- ↑ Cancer.gov: Testicular Cancer – Health Professional Version. [dostęp 2017-11-10]. [zarchiwizowane z tego adresu].
- ↑ Mayo Clinic: Testicular cancer. [dostęp 2017-11-10]. [zarchiwizowane z tego adresu].
- ↑ a b American Cancer Society: Can Testicular Cancer Be Prevented?. [dostęp 2017-11-10]. [zarchiwizowane z tego adresu].
- ↑ a b c Albers i in. 2016 ↓, s. 15.
- ↑ a b c NIH: Testicular Cancer Screening (PDQ®)–Health Professional Version. [dostęp 2017-11-17].
- ↑ K. Lin, R. Sharangpani. Screening for testicular cancer: an evidence review for the U.S. Preventive Services Task Force. „Ann Intern Med”. 153 (6), s. 396–399, 2010. DOI: 10.7326/0003-4819-153-6-201009210-00007. PMID: 20855803.
- ↑ D. Ilic, M.L. Misso. Screening for testicular cancer. „Cochrane Database Syst Rev”, 2011. DOI: 10.1002/14651858.CD007853.pub2. PMID: 21328302.
- ↑ M. Pilar Laguna, Peter Albers, Jerome P. Richie, Carsten Bokemeyer: Cancer of the Testis. Springer Science & Business Media, 2010, s. 125–126. ISBN 978-1-84800-370-5.
- ↑ a b c John E. Niederhuber, James O. Armitage, James H. Doroshow, Michael B. Kastan, Joel E. Tepper: Abeloff’s Clinical Oncology. Elsevier Health Sciences, 2013, s. 1511. ISBN 978-1-4557-2881-7.
- ↑ William Hamilton, Timothy James Peters: Cancer Diagnosis in Primary Care. Elsevier Health Sciences, 2007, s. 163–164. ISBN 978-0-443-10367-4.
- ↑ a b c d e f Pat Price, Karol Sikora: Treatment of Cancer. CRC Press, 2014, s. 350. ISBN 978-1-4822-1496-3.
- ↑ a b Albers i in. 2016 ↓, s. 13.
- ↑ a b Daniel W. Lin: Testicular Cancer: Urologic Clinics of North America. Elsevier Health Sciences, 2015, s. 271–273. ISBN 978-0-323-39360-7.
- ↑ a b c d e Krzakowski i in. 2015 ↓, s. 770.
- ↑ a b c d Denis A. Casciato, Marry C. Territo: Manual of Clinical Oncology. Lippincott Williams & Wilkins, 2012, s. 264. ISBN 978-1-4511-1560-4.
- ↑ S.A. Giralt, F. Dexeus, R. Amato, A. Sella i inni. Hyperthyroidism in men with germ cell tumors and high levels of beta-human chorionic gonadotropin. „Cancer”. 69 (5), s. 1286–1290, 1992. PMID: 1371235.
- ↑ S.F. Oosting, E.C. de Haas, T.P. Links, D. de Bruin i inni. Prevalence of paraneoplastic hyperthyroidism in patients with metastatic non-seminomatous germ-cell tumors. „Ann Oncol”. 21 (1), s. 104–108, 2010. DOI: 10.1093/annonc/mdp265. PMID: 19605510.
- ↑ Fletcher 2013 ↓, s. 951.
- ↑ Fletcher 2013 ↓, s. 951–952.
- ↑ Eble i in. 2004 ↓, s. 218.
- ↑ Jerzy Stachura, Wenancjusz Domagała: Patologia znaczy słowo o chorobie. T. II. Polska Akademia Umiejętności, 2009, s. 983. ISBN 978-83-60183-64-9.
- ↑ a b c d e Krzakowski i in. 2015 ↓, s. 771.
- ↑ a b c d Weidner i in. 2009 ↓, s. 1203.
- ↑ Eble i in. 2004 ↓, s. 228.
- ↑ Fletcher 2013 ↓, s. 952.
- ↑ a b Eble i in. 2004 ↓, s. 229.
- ↑ Fletcher 2013 ↓, s. 957.
- ↑ Weidner i in. 2009 ↓, s. 1204.
- ↑ a b c d e Eble i in. 2004 ↓, s. 231.
- ↑ a b c d e Stachura i Domagała 2009 ↓, s. 986.
- ↑ a b c d e f Weidner i in. 2009 ↓, s. 1205.
- ↑ Fletcher 2013 ↓, s. 959.
- ↑ a b c d e f g h Eble i in. 2004 ↓, s. 234.
- ↑ a b Weidner i in. 2009 ↓, s. 1207.
- ↑ a b c d e Stachura i Domagała 2009 ↓, s. 987.
- ↑ Fletcher 2013 ↓, s. 962.
- ↑ a b c d e f g h i j k l Weidner i in. 2009 ↓, s. 1208.
- ↑ a b c d e f g h i Eble i in. 2004 ↓, s. 236.
- ↑ Fletcher 2013 ↓, s. 964.
- ↑ a b c d e Stachura i Domagała 2009 ↓, s. 988.
- ↑ a b c d e Weidner i in. 2009 ↓, s. 1209.
- ↑ a b c Eble i in. 2004 ↓, s. 237.
- ↑ a b c d Weidner i in. 2009 ↓, s. 1210.
- ↑ Stachura i Domagała 2009 ↓, s. 989.
- ↑ Eble i in. 2004 ↓, s. 238.
- ↑ a b c d e f g h i j k Eble i in. 2004 ↓, s. 238–239.
- ↑ a b c d e f g h i j Weidner i in. 2009 ↓, s. 1211–1212.
- ↑ a b c d e f g h i Eble i in. 2004 ↓, s. 240.
- ↑ a b c d e f g h i j Weidner i in. 2009 ↓, s. 1213–1214.
- ↑ a b c d e f g h i j k l m n Stachura i Domagała 2009 ↓, s. 990.
- ↑ a b c d Eble i in. 2004 ↓, s. 243.
- ↑ a b c d Weidner i in. 2009 ↓, s. 1214.
- ↑ Weidner i in. 2009 ↓, s. 121–1215.
- ↑ a b c Eble i in. 2004 ↓, s. 243–244.
- ↑ Eble i in. 2004 ↓, s. 244–245.
- ↑ a b Weidner i in. 2009 ↓, s. 1215.
- ↑ a b Eble i in. 2004 ↓, s. 245–246.
- ↑ a b c d Eble i in. 2004 ↓, s. 246.
- ↑ a b c d e f g Weidner i in. 2009 ↓, s. 1217.
- ↑ a b c d e f g Stachura i Domagała 2009 ↓, s. 991.
- ↑ a b Eble i in. 2004 ↓, s. 247.
- ↑ Weidner i in. 2009 ↓, s. 1217–1218.
- ↑ a b c d e f g Eble i in. 2004 ↓, s. 250.
- ↑ M. Pilar Laguna, Peter Albers, Jerome P. Richie, Carsten Bokemeyer: Cancer of the Testis. Springer Science & Business Media, 2010, s. 16. ISBN 978-1-84800-370-5.
- ↑ a b Weidner i in. 2009 ↓, s. 1218.
- ↑ a b Eble i in. 2004 ↓, s. 251.
- ↑ a b c d e Eble i in. 2004 ↓, s. 252–253.
- ↑ a b Weidner i in. 2009 ↓, s. 1220.
- ↑ a b Eble i in. 2004 ↓, s. 255.
- ↑ a b Weidner i in. 2009 ↓, s. 1221.
- ↑ a b c d e f g h i Eble i in. 2004 ↓, s. 256.
- ↑ Ming Zhou, Cristina Magi-Galluzzi: Genitourinary Pathology. Elsevier Health Sciences, 2014, s. 657–659. ISBN 978-0-323-18833-3.
- ↑ Weidner i in. 2009 ↓, s. 1222.
- ↑ Eble i in. 2004 ↓, s. 257.
- ↑ a b Eble i in. 2004 ↓, s. 259.
- ↑ Weidner i in. 2009 ↓, s. 1223.
- ↑ Weidner i in. 2009 ↓, s. 1222–1223.
- ↑ a b c d Weidner i in. 2009 ↓, s. 1224.
- ↑ Eble i in. 2004 ↓, s. 265.
- ↑ Eble i in. 2004 ↓, s. 265–266.
- ↑ a b Eble i in. 2004 ↓, s. 267.
- ↑ a b Eble i in. 2004 ↓, s. 267–268.
- ↑ Eble i in. 2004 ↓, s. 270.
- ↑ Eble i in. 2004 ↓, s. 270–271.
- ↑ Eble i in. 2004 ↓, s. 271–272.
- ↑ Weidner i in. 2009 ↓, s. 1227–1228.
- ↑ a b c d Raphael E. O’Sullivan, Raphael E. Pollock: UICC Manual of Clinical Oncology. John Wiley & Sons, 2015, s. 370. ISBN 978-1-119-01313-6.
- ↑ a b c d e f Martin D. Abeloff, James O. Armitage, John E. Niederhuber, Michael B. Kastan, W. Gillies McKenna: Abeloff’s Clinical Oncology. Elsevier Health Sciences, 2008, s. 1715. ISBN 978-1-4377-2056-3.
- ↑ David Lyden, Danny R. Welch, Bethan Psaila: Cancer Metastasis: Biologic Basis and Therapeutics. Cambridge University Press, 2011, s. 468. ISBN 978-1-139-49875-3.
- ↑ a b A.A. Borski. Proceedings: Diagnosis, staging, and natural history of testicular tumors. „Cancer”. 32 (5), s. 1202–1205, 1973. PMID: 4757911.
- ↑ a b c d Seymour H. Levitt, James A. Purdy, Carlos A. Perez, Philip Poortmans: Technical Basis of Radiation Therapy: Practical Clinical Applications. Springer Science & Business Media, 2012, s. 740. ISBN 978-3-642-11572-1.
- ↑ a b Morton A Meyers, Chusilp Charnsangavej, Michael Oliphant: Meyers’ Dynamic Radiology of the Abdomen: Normal and Pathologic Anatomy. Springer, 2009, s. 334. ISBN 978-1-4419-5939-3.
- ↑ a b c Daniel W. Lin: Testicular Cancer: Urologic Clinics of North America. Elsevier Health Sciences, 2015, s. 273–274. ISBN 978-0-323-39360-7.
- ↑ a b c d e f g h i j k l J.E. Elzinga-Tinke, G.R. Dohle, L.H. Looijenga. Etiology and early pathogenesis of malignant testicular germ cell tumors: towards possibilities for preinvasive diagnosis. „Asian J Androl”. 17 (3). s. 381–393. DOI: 10.4103/1008-682X.148079. PMID: 25791729.
- ↑ Słowikowska-Hilczer Słowikowska-Hilczer, Maria Szarras-Czapnik, Katarzyna Marchlewska, Eliza Filipiak. Zespół dysgenetycznych jąder: patogeneza i konsekwencje kliniczne. „Endokrynol. Ped.”, 2013.
- ↑ a b c DeVita, Lawrence i Rosenberg 2008 ↓, s. 1465–1466.
- ↑ N.E. Skakkebaek, E. Rajpert-De Meyts, N. Jørgensen, E. Carlsen i inni. Germ cell cancer and disorders of spermatogenesis: an environmental connection?. „APMIS”. 106 (1), s. 3–11, 1998. PMID: 9524557.
- ↑ R.S. Chaganti, J. Houldsworth. The cytogenetic theory of the pathogenesis of human adult male germ cell tumors. Review article. „APMIS”. 106 (1), s. 80–83, 1998. PMID: 9524565.
- ↑ B. Boldajipour, E. Raz. What is left behind--quality control in germ cell migration. „Sci STKE”. 2007 (383), 2007. DOI: 10.1126/stke.3832007pe16. PMID: 17456805.
- ↑ L.H. Looijenga, H. de Leeuw, M. van Oorschot, R.J. van Gurp i inni. Stem cell factor receptor (c-KIT) codon 816 mutations predict development of bilateral testicular germ-cell tumors. „Cancer Res”. 63 (22), s. 7674–7678, 2003. PMID: 14633689.
- ↑ A. Ferlin, M. Pengo, D. Pizzol, U. Carraro i inni. Variants in KITLG predispose to testicular germ cell cancer independently from spermatogenic function. „Endocr Relat Cancer”. 19 (1), s. 101–108, 2012. DOI: 10.1530/ERC-11-0340. PMID: 22194441.
- ↑ E.A. Rapley, C. Turnbull, A.A. Al Olama, E.T. Dermitzakis i inni. A genome-wide association study of testicular germ cell tumor. „Nat Genet”. 41 (7), s. 807–810, 2009. DOI: 10.1038/ng.394. PMID: 19483681.
- ↑ P.A. Kanetsky, N. Mitra, S. Vardhanabhuti, M. Li i inni. Common variation in KITLG and at 5q31.3 predisposes to testicular germ cell cancer. „Nat Genet”. 41 (7), s. 811–815, 2009. DOI: 10.1038/ng.393. PMID: 19483682.
- ↑ A. McIntyre, B. Summersgill, B. Grygalewicz, A.J. Gillis i inni. Amplification and overexpression of the KIT gene is associated with progression in the seminoma subtype of testicular germ cell tumors of adolescents and adults. „Cancer Res”. 65 (18), s. 8085–8089, 2005. DOI: 10.1158/0008-5472.CAN-05-0471. PMID: 16166280.
- ↑ Oldenburg i in. 2013 ↓, s. 1.
- ↑ a b Krzakowski i in. 2015 ↓, s. 772.
- ↑ a b c d e f g h M. Studniarek, K. Skrobisz-Balandowska, E. Modzelewska. Scrotal imaging. „J Ultrason”. 15 (62), s. 245–258, 2015. DOI: 10.15557/JoU.2015.0021. PMID: 26674847.
- ↑ a b c d e f g h i j k l m n o G.W. Barrisford, E.I. Kreydin, M.A. Preston, D. Rodriguez i inni. Role of imaging in testicular cancer: current and future practice. „Future Oncol”. 11 (18), s. 2575–2586, 2015. DOI: 10.2217/fon.15.194. PMID: 26314944.
- ↑ a b c d S. Hilton. Contemporary radiological imaging of testicular cancer. „BJU Int”. 104 (9 Pt B), s. 1339–1345, 2009. DOI: 10.1111/j.1464-410X.2009.08856.x. PMID: 19840010.
- ↑ M.D. Rifkin, A.B. Kurtz, M.E. Pasto, B.B. Goldberg. Diagnostic capabilities of high-resolution scrotal ultrasonography: prospective evaluation. „J Ultrasound Med”. 4 (1), s. 13–19, Jan 1985. PMID: 3882978.
- ↑ S. Hilton, H.W. Herr, J.B. Teitcher, C.B. Begg i inni. CT detection of retroperitoneal lymph node metastases in patients with clinical stage I testicular nonseminomatous germ cell cancer: assessment of size and distribution criteria. „AJR Am J Roentgenol”. 169 (2), s. 521–525, 1997. DOI: 10.2214/ajr.169.2.9242768. PMID: 9242768.
- ↑ E.I. Kreydin, G.W. Barrisford, A.S. Feldman, M.A. Preston. Testicular cancer: what the radiologist needs to know. „AJR Am J Roentgenol”. 200 (6), s. 1215–1225, 2013. DOI: 10.2214/AJR.12.10319. PMID: 23701056.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1468.
- ↑ S.A. Sohaib, D.M. Koh, Y. Barbachano, J. Parikh i inni. Prospective assessment of MRI for imaging retroperitoneal metastases from testicular germ cell tumours. „Clin Radiol”. 64 (4), s. 362–367, 2009. DOI: 10.1016/j.crad.2008.10.011. PMID: 19264179.
- ↑ J.H. Ellis, J.R. Bies, K.K. Kopecky, E.C. Klatte i inni. Comparison of NMR and CT imaging in the evaluation of metastatic retroperitoneal lymphadenopathy from testicular carcinoma. „J Comput Assist Tomogr”. 8 (4), s. 709–719, 1984. PMID: 6539790.
- ↑ a b c d e f Albers i in. 2016 ↓, s. 9.
- ↑ M. de Wit, W. Brenner, M. Hartmann, J. Kotzerke i inni. [18F]-FDG-PET in clinical stage I/II non-seminomatous germ cell tumours: results of the German multicentre trial. „Ann Oncol”. 19 (9), s. 1619–1623, 2008. DOI: 10.1093/annonc/mdn170. PMID: 18453520.
- ↑ R.A. Huddart, M.J. O’Doherty, A. Padhani, G.J. Rustin i inni. 18fluorodeoxyglucose positron emission tomography in the prediction of relapse in patients with high-risk, clinical stage I nonseminomatous germ cell tumors: preliminary report of MRC Trial TE22--the NCRI Testis Tumour Clinical Study Group. „J Clin Oncol”. 25 (21), s. 3090–3095, 2007. DOI: 10.1200/JCO.2006.09.3831. PMID: 17634488.
- ↑ a b Albers i in. 2016 ↓, s. 9–10.
- ↑ a b M. De Santis, A. Becherer, C. Bokemeyer, F. Stoiber i inni. 2-18fluoro-deoxy-D-glucose positron emission tomography is a reliable predictor for viable tumor in postchemotherapy seminoma: an update of the prospective multicentric SEMPET trial. „J Clin Oncol”. 22 (6), s. 1034–1039, 2004. DOI: 10.1200/JCO.2004.07.188. PMID: 15020605.
- ↑ C. Winter, P. Albers. Testicular germ cell tumors: pathogenesis, diagnosis and treatment. „Nat Rev Endocrinol”. 7 (1), s. 43–53, 2011. DOI: 10.1038/nrendo.2010.196. PMID: 21116298.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1463–1464.
- ↑ Anna Nasierowska-Guttmejer, Barbara Górnicka: Zalecenia do diagnostyki histopatologicznej nowotworów. Warszawa: Centrum Onkologii, Oddział Gliwice; Polskie Towarzystwo Patologów, 2013, s. 221–225. ISBN 978-83-909137-1-1.
- ↑ a b c d e f g h i M.C. Mir, N. Pavan, M.L. Gonzalgo. Current Clinical Applications of Testicular Cancer Biomarkers. „Urol Clin North Am”. 43 (1), s. 119–125, 2016. DOI: 10.1016/j.ucl.2015.08.011. PMID: 26614034.
- ↑ a b c d e f g h i j k l J.C. Milose, C.P. Filson, A.Z. Weizer, K.S. Hafez i inni. Role of biochemical markers in testicular cancer: diagnosis, staging, and surveillance. „Open Access J Urol”. 4, s. 1–8, 2011. DOI: 10.2147/OAJU.S15063. PMID: 24198649.
- ↑ a b Albers i in. 2016 ↓, s. 11.
- ↑ a b Gilligan i in. 2017 ↓, s. 33–34.
- ↑ a b Krzakowski i in. 2015 ↓, s. 773.
- ↑ Albers i in. 2016 ↓, s. 12.
- ↑ Krzakowski i in. 2015 ↓, s. 774.
- ↑ a b c d e f S.M. Pearce, S.L. Liauw, S.E. Eggener. Management of Low-Stage Testicular Seminoma. „Urol Clin North Am”. 42 (3), s. 287–298, 2015. DOI: 10.1016/j.ucl.2015.04.003. PMID: 26216816.
- ↑ Gilligan i in. 2017 ↓, s. 37–38.
- ↑ Gilligan i in. 2017 ↓, s. 38.
- ↑ a b c Nicholas Vogelzang: Comprehensive Textbook of Genitourinary Oncology. Lippincott Williams & Wilkins, 2006, s. 605. ISBN 978-0-7817-4984-8.
- ↑ Axel Heidenreich, Maria Angerer-Shipilenya. Organ-preserving surgery for testicular tumours. „BJU International Journal”. 109 (3), s. 474–490, 2012. BJUI.
- ↑ a b c d e f g Derek Raghavan: Germ Cell Tumors. PMPH-USA, 2003, s. 94–96. ISBN 9781550090826.
- ↑ H. Djaladat. Organ-sparing surgery for testicular tumours. „Curr Opin Urol”. 25 (2), s. 116–120, 2015. DOI: 10.1097/MOU.0000000000000150. PMID: 25581544.
- ↑ a b c d e f g h i j k l m Albers i in. 2016 ↓, s. 16.
- ↑ a b c d e f g Gilligan i in. 2017 ↓, s. 39.
- ↑ a b c Krzakowski i in. 2015 ↓, s. 775.
- ↑ Albers i in. 2016 ↓, s. 30.
- ↑ a b c d e f g h i j k l M. Chovanec, N. Hanna, K.C. Cary, L. Einhorn i inni. Management of stage I testicular germ cell tumours. „Nat Rev Urol”. 13 (11), s. 663–673, 2016. DOI: 10.1038/nrurol.2016.164. PMID: 27618772.
- ↑ a b c d e f E. Rajpert-De Meyts, K.A. McGlynn, K. Okamoto, M.A. Jewett i inni. Testicular germ cell tumours. „Lancet”. 387 (10029), s. 1762–1774, 2016. DOI: 10.1016/S0140-6736(15)00991-5. PMID: 26651223.
- ↑ a b c d Oldenburg i in. 2013 ↓, s. 3.
- ↑ R.J. Groll, P. Warde, M.A. Jewett. A comprehensive systematic review of testicular germ cell tumor surveillance. „Crit Rev Oncol Hematol”. 64 (3), s. 182–197, 2007. DOI: 10.1016/j.critrevonc.2007.04.014. PMID: 17644403.
- ↑ a b c J. Aparicio, X. García del Muro, P. Maroto, L. Paz-Ares i inni. Multicenter study evaluating a dual policy of postorchiectomy surveillance and selective adjuvant single-agent carboplatin for patients with clinical stage I seminoma. „Ann Oncol”. 14 (6), s. 867–872, 2003. PMID: 12796024.
- ↑ a b P. Warde, L. Specht, A. Horwich, T. Oliver i inni. Prognostic factors for relapse in stage I seminoma managed by surveillance: a pooled analysis. „J Clin Oncol”. 20 (22), s. 4448–4452, 2002. DOI: 10.1200/JCO.2002.01.038. PMID: 12431967.
- ↑ P. Chung, C. Parker, T. Panzarella, M.K. Gospodarowicz i inni. Surveillance in stage I testicular seminoma – risk of late relapse. „Can J Urol”. 9 (5), s. 1637–1640, 2002. PMID: 12431325.
- ↑ a b J. Aparicio, P. Maroto, X. García del Muro, A. Sánchez-Muñoz i inni. Prognostic factors for relapse in stage I seminoma: a new nomogram derived from three consecutive, risk-adapted studies from the Spanish Germ Cell Cancer Group (SGCCG). „Ann Oncol”. 25 (11), s. 2173–2178, 2014. DOI: 10.1093/annonc/mdu437. PMID: 25210015.
- ↑ T. Tandstad, O. Ståhl, O. Dahl, H.S. Haugnes i inni. Treatment of stage I seminoma, with one course of adjuvant carboplatin or surveillance, risk-adapted recommendations implementing patient autonomy: a report from the Swedish and Norwegian Testicular Cancer Group (SWENOTECA). „Ann Oncol”. 27 (7), s. 1299–1304, 2016. DOI: 10.1093/annonc/mdw164. PMID: 27052649.
- ↑ P. Warde, M.K. Gospodarowicz, D. Banerjee, T. Panzarella i inni. Prognostic factors for relapse in stage I testicular seminoma treated with surveillance. „J Urol”. 157 (5), s. 1705–1709, 1997. PMID: 9112510.
- ↑ P. Chung, G. Daugaard, S. Tyldesley, E.G. Atenafu i inni. Evaluation of a prognostic model for risk of relapse in stage I seminoma surveillance. „Cancer Med”. 4 (1), s. 155–160, 2015. DOI: 10.1002/cam4.324. PMID: 25236854.
- ↑ P. Chung, P. Warde. Stage I seminoma: adjuvant treatment is effective but is it necessary?. „J Natl Cancer Inst”. 103 (3), s. 194–196, 2011. DOI: 10.1093/jnci/djq535. PMID: 21212383.
- ↑ a b T. Tandstad, R. Smaaland, A. Solberg, R.M. Bremnes i inni. Management of seminomatous testicular cancer: a binational prospective population-based study from the Swedish norwegian testicular cancer study group. „J Clin Oncol”. 29 (6), s. 719–725, 2011. DOI: 10.1200/JCO.2010.30.1044. PMID: 21205748.
- ↑ Gilligan i in. 2017 ↓, s. 39–40.
- ↑ a b R.T. Oliver, G.M. Mead, G.J. Rustin, J.K. Joffe i inni. Randomized trial of carboplatin versus radiotherapy for stage I seminoma: mature results on relapse and contralateral testis cancer rates in MRC TE19/EORTC 30982 study (ISRCTN27163214). „J Clin Oncol”. 29 (8), s. 957–962, 2011. DOI: 10.1200/JCO.2009.26.4655. PMID: 21282539.
- ↑ R.T. Oliver, M.D. Mason, G.M. Mead, H. von der Maase i inni. Radiotherapy versus single-dose carboplatin in adjuvant treatment of stage I seminoma: a randomised trial. „Lancet”. 366 (9482). s. 293–300. DOI: 10.1016/S0140-6736(05)66984-X. PMID: 16039331.
- ↑ a b c d e Krzakowski i in. 2015 ↓, s. 776.
- ↑ J. Aparicio, J.R. Germà, X. García del Muro, P. Maroto i inni. Risk-adapted management for patients with clinical stage I seminoma: the Second Spanish Germ Cell Cancer Cooperative Group study. „J Clin Oncol”. 23 (34), s. 8717–8723, 2005. DOI: 10.1200/JCO.2005.01.9810. PMID: 16260698.
- ↑ J. Aparicio, P. Maroto, X.G. del Muro, J. Gumà i inni. Risk-adapted treatment in clinical stage I testicular seminoma: the third Spanish Germ Cell Cancer Group study. „J Clin Oncol”. 29 (35), s. 4677–4681, 2011. DOI: 10.1200/JCO.2011.36.0503. PMID: 22042940.
- ↑ a b c d Gilligan i in. 2017 ↓, s. 40.
- ↑ a b Gilligan i in. 2017 ↓, s. 24.
- ↑ W.G. Jones, S.D. Fossa, G.M. Mead, J.T. Roberts i inni. Randomized trial of 30 versus 20 Gy in the adjuvant treatment of stage I Testicular Seminoma: a report on Medical Research Council Trial TE18, European Organisation for the Research and Treatment of Cancer Trial 30942 (ISRCTN18525328). „J Clin Oncol”. 23 (6), s. 1200–1208, 2005. DOI: 10.1200/JCO.2005.08.003. PMID: 15718317.
- ↑ S.D. Fosså, A. Horwich, J.M. Russell, J.T. Roberts i inni. Optimal planning target volume for stage I testicular seminoma: A Medical Research Council randomized trial. Medical Research Council Testicular Tumor Working Group. „J Clin Oncol”. 17 (4), s. 1146, 1999. DOI: 10.1200/JCO.1999.17.4.1146. PMID: 10561173.
- ↑ a b c d e f Albers i in. 2016 ↓, s. 17.
- ↑ a b c Gilligan i in. 2017 ↓, s. 9.
- ↑ a b c d e f g h Albers i in. 2016 ↓, s. 21.
- ↑ a b c Oldenburg i in. 2013 ↓, s. 3–4.
- ↑ a b c d e Gilligan i in. 2017 ↓, s. 42.
- ↑ a b Rutkowski i Warzocha 2013 ↓, s. 328.
- ↑ a b c N. Boujelbene, A. Cosinschi, N. Boujelbene, K. Khanfir i inni. Pure seminoma: a review and update. „Radiat Oncol”. 6, s. 90, 2011. DOI: 10.1186/1748-717X-6-90. PMID: 21819630.
- ↑ Gilligan i in. 2017 ↓, s. 25.
- ↑ P.W. Chung, M.K. Gospodarowicz, T. Panzarella, M.A. Jewett i inni. Stage II testicular seminoma: patterns of recurrence and outcome of treatment. „Eur Urol”. 45 (6), s. 754–759, 2004. DOI: 10.1016/j.eururo.2004.01.020. PMID: 15149748.
- ↑ J. Classen, H. Schmidberger, C. Meisner, R. Souchon i inni. Radiotherapy for stages IIA/B testicular seminoma: final report of a prospective multicenter clinical trial. „J Clin Oncol”. 21 (6), s. 1101–1106, 2003. DOI: 10.1200/JCO.2003.06.065. PMID: 12637477.
- ↑ J. Domont, C. Massard, A. Patrikidou, A. Bossi i inni. A risk-adapted strategy of radiotherapy or cisplatin-based chemotherapy in stage II seminoma. „Journal of Clinical Oncology”, 2005. DOI: 10.1200/jco.2005.23.16_suppl.4571.
- ↑ J. Domont, C. Massard, A. Patrikidou, A. Bossi i inni. A risk-adapted strategy of radiotherapy or cisplatin-based chemotherapy in stage II seminoma. „Urol Oncol”. 31 (5), s. 697–705, 2013. DOI: 10.1016/j.urolonc.2011.04.004. PMID: 21665493.
- ↑ X. Garcia-del-Muro, P. Maroto, J. Gumà, J. Sastre i inni. Chemotherapy as an alternative to radiotherapy in the treatment of stage IIA and IIB testicular seminoma: a Spanish Germ Cell Cancer Group Study. „J Clin Oncol”. 26 (33), s. 5416–5421, 2008. DOI: 10.1200/JCO.2007.15.9103. PMID: 18936476.
- ↑ S. Krege, C. Boergermann, R. Baschek, A. Hinke i inni. Single agent carboplatin for CS IIA/B testicular seminoma. A phase II study of the German Testicular Cancer Study Group (GTCSG). „Ann Oncol”. 17 (2), s. 276–280, 2006. DOI: 10.1093/annonc/mdj039. PMID: 16254023.
- ↑ a b c d e f g h i j k l Albers i in. 2016 ↓, s. 23.
- ↑ a b c d e Oldenburg i in. 2013 ↓, s. 4.
- ↑ a b c d e f g h Gilligan i in. 2017 ↓, s. 43.
- ↑ Gilligan i in. 2017 ↓, s. 10.
- ↑ a b c d e f g h i j Albers i in. 2016 ↓, s. 24.
- ↑ S. Hinz, M. Schrader, C. Kempkensteffen, R. Bares i inni. The role of positron emission tomography in the evaluation of residual masses after chemotherapy for advanced stage seminoma. „J Urol”. 179 (3), s. 936–940, 2008. DOI: 10.1016/j.juro.2007.10.054. PMID: 18207171.
- ↑ A. Becherer, M. De Santis, G. Karanikas, M. Szabó i inni. FDG PET is superior to CT in the prediction of viable tumour in post-chemotherapy seminoma residuals. „Eur J Radiol”. 54 (2), s. 284–288, 2005. DOI: 10.1016/j.ejrad.2004.07.012. PMID: 15837411.
- ↑ a b Y. Ehrlich, M.J. Brames, S.D. Beck, R.S. Foster i inni. Long-term follow-up of Cisplatin combination chemotherapy in patients with disseminated nonseminomatous germ cell tumors: is a postchemotherapy retroperitoneal lymph node dissection needed after complete remission?. „J Clin Oncol”. 28 (4), s. 531–536, 2010. DOI: 10.1200/JCO.2009.23.0714. PMID: 20026808.
- ↑ Gilligan i in. 2017 ↓, s. 44.
- ↑ Oldenburg i in. 2013 ↓, s. 4–5.
- ↑ a b Gilligan i in. 2017 ↓, s. 12.
- ↑ Gilligan i in. 2017 ↓, s. 44–45.
- ↑ a b Krzakowski i in. 2015 ↓, s. 777.
- ↑ a b c d e Oldenburg i in. 2013 ↓, s. 5.
- ↑ a b c Albers i in. 2016 ↓, s. 19.
- ↑ a b c d Gilligan i in. 2017 ↓, s. 45.
- ↑ a b c d e f g h Gilligan i in. 2017 ↓, s. 46.
- ↑ S. Culine, C. Theodore, M.J. Terrier-Lacombe, J.P. Droz. Primary chemotherapy in patients with nonseminomatous germ cell tumors of the testis and biological disease only after orchiectomy. „J Urol”. 155 (4), s. 1296–1298, 1996. PMID: 8632558.
- ↑ B.E. Davis, H.W. Herr, W.R. Fair, G.J. Bosl. The management of patients with nonseminomatous germ cell tumors of the testis with serologic disease only after orchiectomy. „J Urol”. 152 (1), s. 111–113, 1994. PMID: 7515445.
- ↑ a b c d Y.S. Shin, H.J. Kim. Current management of testicular cancer. „Korean J Urol”. 54 (1), s. 2–10, 2013. DOI: 10.4111/kju.2013.54.1.2. PMID: 23362440.
- ↑ Albers i in. 2016 ↓, s. 29.
- ↑ G. Read, S.P. Stenning, M.H. Cullen, M.C. Parkinson i inni. Medical Research Council prospective study of surveillance for stage I testicular teratoma. Medical Research Council Testicular Tumors Working Party. „J Clin Oncol”. 10 (11), s. 1762–1768, 1992. DOI: 10.1200/JCO.1992.10.11.1762. PMID: 1403057.
- ↑ L.S. Freedman, M.C. Parkinson, W.G. Jones, R.T. Oliver i inni. Histopathology in the prediction of relapse of patients with stage I testicular teratoma treated by orchidectomy alone. „Lancet”. 2 (8554), s. 294–298, 1987. PMID: 2886764.
- ↑ J.F. Sturgeon, M.J. Moore, D.M. Kakiashvili, I. Duran i inni. Non-risk-adapted surveillance in clinical stage I nonseminomatous germ cell tumors: the Princess Margaret Hospital’s experience. „Eur Urol”. 59 (4), s. 556–562, 2011. DOI: 10.1016/j.eururo.2010.12.010. PMID: 21190791.
- ↑ C. Kollmannsberger, C. Moore, K.N. Chi, N. Murray i inni. Non-risk-adapted surveillance for patients with stage I nonseminomatous testicular germ-cell tumors: diminishing treatment-related morbidity while maintaining efficacy. „Ann Oncol”. 21 (6), s. 1296–1301, 2010. DOI: 10.1093/annonc/mdp473. PMID: 19875756.
- ↑ a b c d Albers i in. 2016 ↓, s. 18.
- ↑ M.H. Cullen, S.P. Stenning, M.C. Parkinson, S.D. Fossa i inni. Short-course adjuvant chemotherapy in high-risk stage I nonseminomatous germ cell tumors of the testis: a Medical Research Council report. „J Clin Oncol”. 14 (4), s. 1106–1113, 1996. DOI: 10.1200/JCO.1996.14.4.1106. PMID: 8648364.
- ↑ J. Pont, W. Albrecht, G. Postner, F. Sellner i inni. Adjuvant chemotherapy for high-risk clinical stage I nonseminomatous testicular germ cell cancer: long-term results of a prospective trial. „J Clin Oncol”. 14 (2), s. 441–448, 1996. DOI: 10.1200/JCO.1996.14.2.441. PMID: 8636755.
- ↑ C. Chevreau, C. Mazerolles, M. Soulié, M.H. Gaspard i inni. Long-term efficacy of two cycles of BEP regimen in high-risk stage I nonseminomatous testicular germ cell tumors with embryonal carcinoma and/or vascular invasion. „Eur Urol”. 46 (2), s. 209–214, 2004. DOI: 10.1016/j.eururo.2004.03.022. PMID: 15245815.
- ↑ R.T. Oliver, J. Ong, J. Shamash, R. Ravi i inni. Long-term follow-up of Anglian Germ Cell Cancer Group surveillance versus patients with Stage 1 nonseminoma treated with adjuvant chemotherapy. „Urology”. 63 (3), s. 556–561, 2004. DOI: 10.1016/j.urology.2003.10.023. PMID: 15028457.
- ↑ D. Böhlen, M. Borner, R.W. Sonntag, M.F. Fey i inni. Long-term results following adjuvant chemotherapy in patients with clinical stage I testicular nonseminomatous malignant germ cell tumors with high risk factors. „J Urol”. 161 (4), s. 1148–1152, 1999. PMID: 10081858.
- ↑ T. Tandstad, O. Dahl, G. Cohn-Cedermark, E. Cavallin-Stahl i inni. Risk-adapted treatment in clinical stage I nonseminomatous germ cell testicular cancer: the SWENOTECA management program. „J Clin Oncol”. 27 (13), s. 2122–2128, 2009. DOI: 10.1200/JCO.2008.18.8953. PMID: 19307506.
- ↑ T. Tandstad, O. Ståhl, U. Håkansson, O. Dahl i inni. One course of adjuvant BEP in clinical stage I nonseminoma mature and expanded results from the SWENOTECA group. „Ann Oncol”. 25 (11), s. 2167–2172, 2014. DOI: 10.1093/annonc/mdu375. PMID: 25114021.
- ↑ P. Albers, R. Siener, S. Krege, H.U. Schmelz i inni. Randomized phase III trial comparing retroperitoneal lymph node dissection with one course of bleomycin and etoposide plus cisplatin chemotherapy in the adjuvant treatment of clinical stage I Nonseminomatous testicular germ cell tumors: AUO trial AH 01/94 by the German Testicular Cancer Study Group. „J Clin Oncol”. 26 (18), s. 2966–2972, 2008. DOI: 10.1200/JCO.2007.12.0899. PMID: 18458040.
- ↑ C.J. Sweeney, B.P. Hermans, D.K. Heilman, R.S. Foster i inni. Results and outcome of retroperitoneal lymph node dissection for clinical stage I embryonal carcinoma-predominant testis cancer. „J Clin Oncol”. 18 (2), s. 358–362, 2000. DOI: 10.1200/JCO.2000.18.2.358. PMID: 10637250.
- ↑ A. Heidenreich, P. Albers, M. Hartmann, S. Kliesch i inni. Complications of primary nerve sparing retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ cell tumors of the testis: experience of the German Testicular Cancer Study Group. „J Urol”. 169 (5), s. 1710–1714, 2003. DOI: 10.1097/01.ju.0000060960.18092.54. PMID: 12686815.
- ↑ a b c A. Heidenreich, D. Pfister. Retroperitoneal lymphadenectomy and resection for testicular cancer: an update on best practice. „Ther Adv Urol”. 4 (4), s. 187–205, 2012. DOI: 10.1177/1756287212443170. PMID: 22852029.
- ↑ Albers i in. 2016 ↓, s. 18–19.
- ↑ Derek Raghavan: Germ Cell Tumors. PMPH-USA, 2003, s. 99–106. ISBN 9781550090826.
- ↑ a b c DeVita, Lawrence i Rosenberg 2008 ↓, s. 1472–1473.
- ↑ Derek Raghavan: Germ Cell Tumors. PMPH-USA, 2003, s. 99–100. ISBN 9781550090826.
- ↑ Roman Sosnowski, Rafał Zdun, Tomasz Demkow. Anatomia układu chłonnego narządów moczowo-płciowych. „Urologia Polska”, 2008.
- ↑ S.D. Beck, A.L. Bey, R. Bihrle, R.S. Foster. Ejaculatory status and fertility rates after primary retroperitoneal lymph node dissection. „J Urol”. 184 (5), s. 2078–2080, Nov 2010. DOI: 10.1016/j.juro.2010.06.146. PMID: 20850817.
- ↑ N. Nicolai, R. Miceli, A. Necchi, D. Biasoni i inni. Retroperitoneal lymph node dissection with no adjuvant chemotherapy in clinical stage I nonseminomatous germ cell tumours: long-term outcome and analysis of risk factors of recurrence. „Eur Urol”. 58 (6), s. 912–918, 2010. DOI: 10.1016/j.eururo.2010.08.032. PMID: 20817343.
- ↑ Gilligan i in. 2017 ↓, s. 15.
- ↑ a b c d e f Albers i in. 2016 ↓, s. 22.
- ↑ J.P. Donohue, J.A. Thornhill, R.S. Foster, R. Bihrle i inni. The role of retroperitoneal lymphadenectomy in clinical stage B testis cancer: the Indiana University experience (1965 to 1989). „J Urol”. 153 (1), s. 85–89, 1995. PMID: 7966799.
- ↑ S.D. Williams, D.M. Stablein, L.H. Einhorn, F.M. Muggia i inni. Immediate adjuvant chemotherapy versus observation with treatment at relapse in pathological stage II testicular cancer. „N Engl J Med”. 317 (23), s. 1433–1438, 1987. DOI: 10.1056/NEJM198712033172303. PMID: 2446132.
- ↑ A. Horwich, A. Norman, C. Fisher, W.F. Hendry i inni. Primary chemotherapy for stage II nonseminomatous germ cell tumors of the testis. „J Urol”. 151 (1), s. 72–77, 1994. PMID: 8254836.
- ↑ a b Krzakowski i in. 2015 ↓, s. 778.
- ↑ a b c d e f G. Jayram, R.Z. Szmulewitz, S.E. Eggener. Management of good-risk metastatic nonseminomatous germ cell tumors of the testis: current concepts and controversies. „Indian J Urol”. 26 (1). s. 92–97. DOI: 10.4103/0970-1591.60449. PMID: 20535293.
- ↑ Rutkowski i Warzocha 2013 ↓, s. 331.
- ↑ a b c Krzakowski i in. 2015 ↓, s. 779.
- ↑ L. Weissbach, R. Bussar-Maatz, H. Flechtner, U. Pichlmeier i inni. RPLND or primary chemotherapy in clinical stage IIA/B nonseminomatous germ cell tumors? Results of a prospective multicenter trial including quality of life assessment. „Eur Urol”. 37 (5), s. 582–594, 2000. DOI: 20197. PMID: 10765098.
- ↑ Gilligan i in. 2017 ↓, s. 47.
- ↑ a b c Gilligan i in. 2017 ↓, s. 16.
- ↑ F. Rabbani, J. Sheinfeld, H. Farivar-Mohseni, A. Leon i inni. Low-volume nodal metastases detected at retroperitoneal lymphadenectomy for testicular cancer: pattern and prognostic factors for relapse. „J Clin Oncol”. 19 (7), s. 2020–2025, 2001. DOI: 10.1200/JCO.2001.19.7.2020. PMID: 11283135.
- ↑ A.J. Stephenson, G.J. Bosl, D.F. Bajorin, J. Stasi i inni. Retroperitoneal lymph node dissection in patients with low stage testicular cancer with embryonal carcinoma predominance and/or lymphovascular invasion. „J Urol”. 174 (2), s. 557–560, 2005. DOI: 10.1097/01.ju.0000165163.03805.37. PMID: 16006891.
- ↑ Gilligan i in. 2017 ↓, s. 13.
- ↑ Krzakowski i in. 2015 ↓, s. 778–779.
- ↑ a b c d e f g h Gilligan i in. 2017 ↓, s. 48.
- ↑ L.H. Einhorn, S.D. Williams, P.J. Loehrer, R. Birch i inni. Evaluation of optimal duration of chemotherapy in favorable-prognosis disseminated germ cell tumors: a Southeastern Cancer Study Group protocol. „J Clin Oncol”. 7 (3), s. 387–391, 1989. DOI: 10.1200/JCO.1989.7.3.387. PMID: 2465391.
- ↑ a b R. de Wit, G. Stoter, S.B. Kaye, D.T. Sleijfer i inni. Importance of bleomycin in combination chemotherapy for good-prognosis testicular nonseminoma: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group. „J Clin Oncol”. 15 (5), s. 1837–1843, 1997. DOI: 10.1200/JCO.1997.15.5.1837. PMID: 9164193.
- ↑ A. Horwich, D.T. Sleijfer, S.D. Fosså, S.B. Kaye i inni. Randomized trial of bleomycin, etoposide, and cisplatin compared with bleomycin, etoposide, and carboplatin in good-prognosis metastatic nonseminomatous germ cell cancer: a Multiinstitutional Medical Research Council/European Organization for Research and Treatment of Cancer Trial. „J Clin Oncol”. 15 (5), s. 1844–1852, 1997. DOI: 10.1200/JCO.1997.15.5.1844. PMID: 9164194.
- ↑ R. de Wit, J.T. Roberts, P.M. Wilkinson, P.H. de Mulder i inni. Equivalence of three or four cycles of bleomycin, etoposide, and cisplatin chemotherapy and of a 3- or 5-day schedule in good-prognosis germ cell cancer: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council. „J Clin Oncol”. 19 (6), s. 1629–1640, 2001. DOI: 10.1200/JCO.2001.19.6.1629. PMID: 11250991.
- ↑ S. Culine, P. Kerbrat, A. Kramar, C. Théodore i inni. Refining the optimal chemotherapy regimen for good-risk metastatic nonseminomatous germ-cell tumors: a randomized trial of the Genito-Urinary Group of the French Federation of Cancer Centers (GETUG T93BP). „Ann Oncol”. 18 (5), s. 917–924, 2007. DOI: 10.1093/annonc/mdm062. PMID: 17351252.
- ↑ R.H. Jones, P.A. Vasey. Part II: testicular cancer-management of advanced disease. „Lancet Oncol”. 4 (12), s. 738–747, 2003. PMID: 14662430.
- ↑ G.V. Kondagunta, J. Bacik, D. Bajorin, D. Dobrzynski i inni. Etoposide and cisplatin chemotherapy for metastatic good-risk germ cell tumors. „J Clin Oncol”. 23 (36), s. 9290–9294, 2005. DOI: 10.1200/JCO.2005.03.6616. PMID: 16361627.
- ↑ a b R. de Wit, G. Stoter, D.T. Sleijfer, J.P. Neijt i inni. Four cycles of BEP vs four cycles of VIP in patients with intermediate-prognosis metastatic testicular non-seminoma: a randomized study of the EORTC Genitourinary Tract Cancer Cooperative Group. European Organization for Research and Treatment of Cancer. „Br J Cancer”. 78 (6), s. 828–832, 1998. PMID: 9743309.
- ↑ C. Massard, A. Plantade, M. Gross-Goupil, Y. Loriot i inni. Poor prognosis nonseminomatous germ-cell tumours (NSGCTs): should chemotherapy doses be reduced at first cycle to prevent acute respiratory distress syndrome in patients with multiple lung metastases?. „Ann Oncol”. 21 (8), s. 1585–1588, 2010. DOI: 10.1093/annonc/mdq021. PMID: 20181575.
- ↑ a b c d e f g Gilligan i in. 2017 ↓, s. 49.
- ↑ a b H.J. Lavery, R.R. Bahnson, D.S. Sharp, K.S. Pohar. Management of the residual post-chemotherapy retroperitoneal mass in germ cell tumors. „Ther Adv Urol”. 1 (4), s. 199–207, 2009. DOI: 10.1177/1756287209350315. PMID: 21789067.
- ↑ B.S. Carver, A.M. Serio, D. Bajorin, R.J. Motzer i inni. Improved clinical outcome in recent years for men with metastatic nonseminomatous germ cell tumors. „J Clin Oncol”. 25 (35), s. 5603–5608, 2007. DOI: 10.1200/JCO.2007.13.6283. PMID: 17998544.
- ↑ H.G. Sim, P.H. Lange, D.W. Lin. Role of post-chemotherapy surgery in germ cell tumors. „Urol Clin North Am”. 34 (2), s. 199–217, 2007. DOI: 10.1016/j.ucl.2007.02.010. PMID: 17484925.
- ↑ K. Oechsle, M. Hartmann, W. Brenner, S. Venz i inni. [18F]Fluorodeoxyglucose positron emission tomography in nonseminomatous germ cell tumors after chemotherapy: the German multicenter positron emission tomography study group. „J Clin Oncol”. 26 (36), s. 5930–5935, 2008. DOI: 10.1200/JCO.2008.17.1157. PMID: 19018083.
- ↑ a b c d e f g h i j Albers i in. 2016 ↓, s. 25.
- ↑ C. Kollmannsberger, S. Daneshmand, A. So, K.N. Chi i inni. Management of disseminated nonseminomatous germ cell tumors with risk-based chemotherapy followed by response-guided postchemotherapy surgery. „J Clin Oncol”. 28 (4), s. 537–542, 2010. DOI: 10.1200/JCO.2009.23.0755. PMID: 20026807.
- ↑ a b c d e f Oldenburg i in. 2013 ↓, s. 6.
- ↑ K. Fizazi, J. Oldenburg, A. Dunant, I. Chen i inni. Assessing prognosis and optimizing treatment in patients with postchemotherapy viable nonseminomatous germ-cell tumors (NSGCT): results of the sCR2 international study. „Ann Oncol”. 19 (2), s. 259–264, 2008. DOI: 10.1093/annonc/mdm472. PMID: 18042838.
- ↑ K. Fizazi, S. Tjulandin, R. Salvioni, J.R. Germà-Lluch i inni. Viable malignant cells after primary chemotherapy for disseminated nonseminomatous germ cell tumors: prognostic factors and role of postsurgery chemotherapy-results from an international study group. „J Clin Oncol”. 19 (10), s. 2647–2657, 2001. DOI: 10.1200/JCO.2001.19.10.2647. PMID: 11352956.
- ↑ Albers i in. 2016 ↓, s. 25–26.
- ↑ a b c Rutkowski i Warzocha 2013 ↓, s. 332.
- ↑ a b c d e f g Albers i in. 2016 ↓, s. 26.
- ↑ a b c d e f g h i j k l D.R. Feldman, G.J. Bosl, J. Sheinfeld, R.J. Motzer. Medical treatment of advanced testicular cancer. „JAMA”. 299 (6), s. 672–684, 2008. DOI: 10.1001/jama.299.6.672. PMID: 18270356.
- ↑ G.V. Kondagunta, J. Bacik, A. Donadio, D. Bajorin i inni. Combination of paclitaxel, ifosfamide, and cisplatin is an effective second-line therapy for patients with relapsed testicular germ cell tumors. „J Clin Oncol”. 23 (27), s. 6549–6555, 2005. DOI: 10.1200/JCO.2005.19.638. PMID: 16170162.
- ↑ P.J. Loehrer, R. Gonin, C.R. Nichols, T. Weathers i inni. Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. „J Clin Oncol”. 16 (7), s. 2500–2504, 1998. DOI: 10.1200/JCO.1998.16.7.2500. PMID: 9667270.
- ↑ A. Harstrick, H.J. Schmoll, H. Wilke, C.H. Köhne-Wömpner i inni. Cisplatin, etoposide, and ifosfamide salvage therapy for refractory or relapsing germ cell carcinoma. „J Clin Oncol”. 9 (9), s. 1549–1555, 1991. DOI: 10.1200/JCO.1991.9.9.1549. PMID: 1651992.
- ↑ J.A. McCaffrey, M. Mazumdar, D.F. Bajorin, G.J. Bosl i inni. Ifosfamide- and cisplatin-containing chemotherapy as first-line salvage therapy in germ cell tumors: response and survival. „J Clin Oncol”. 15 (7), s. 2559–2563, 1997. DOI: 10.1200/JCO.1997.15.7.2559. PMID: 9215825.
- ↑ R.J. Motzer, D.F. Bajorin, V. Vlamis, S. Weisen i inni. Ifosfamide-based chemotherapy for patients with resistant germ cell tumors: the Memorial Sloan-Kettering Cancer Center experience. „Semin Oncol”. 19 (6 Suppl 12), s. 8–11, 1992. PMID: 1336624.
- ↑ P.J. Loehrer, R. Lauer, B.J. Roth, S.D. Williams i inni. Salvage therapy in recurrent germ cell cancer: ifosfamide and cisplatin plus either vinblastine or etoposide. „Ann Intern Med”. 109 (7), s. 540–546, 1988. PMID: 2844110.
- ↑ a b c L. Popovic, G. Matovina-Brko, M. Popovic, D. Petrovic i inni. High dose chemotherapy with stem cell support in the treatment of testicular cancer. „World J Stem Cells”. 7 (11), s. 1222–1232, 2015. DOI: 10.4252/wjsc.v7.i11.1222. PMID: 26730267.
- ↑ A. Lorch, A. Kleinhans, A. Kramar, C.K. Kollmannsberger i inni. Sequential versus single high-dose chemotherapy in patients with relapsed or refractory germ cell tumors: long-term results of a prospective randomized trial. „J Clin Oncol”. 30 (8), s. 800–805, 2012. DOI: 10.1200/JCO.2011.38.6391. PMID: 22291076.
- ↑ L.H. Einhorn, S.D. Williams, A. Chamness, M.J. Brames i inni. High-dose chemotherapy and stem-cell rescue for metastatic germ-cell tumors. „N Engl J Med”. 357 (4), s. 340–348, 2007. DOI: 10.1056/NEJMoa067749. PMID: 17652649.
- ↑ a b J.L. Pico, G. Rosti, A. Kramar, H. Wandt i inni. A randomised trial of high-dose chemotherapy in the salvage treatment of patients failing first-line platinum chemotherapy for advanced germ cell tumours. „Ann Oncol”. 16 (7), s. 1152–1159, 2005. DOI: 10.1093/annonc/mdi228. PMID: 15928070.
- ↑ A. Lorch, C. Kollmannsberger, J.T. Hartmann, B. Metzner i inni. Single versus sequential high-dose chemotherapy in patients with relapsed or refractory germ cell tumors: a prospective randomized multicenter trial of the German Testicular Cancer Study Group. „J Clin Oncol”. 25 (19), s. 2778–2784, 2007. DOI: 10.1200/JCO.2006.09.2148. PMID: 17602082.
- ↑ A. Lorch, J. Beyer, C. Bascoul-Mollevi, A. Kramar i inni. Prognostic factors in patients with metastatic germ cell tumors who experienced treatment failure with cisplatin-based first-line chemotherapy. „J Clin Oncol”. 28 (33), s. 4906–4911, 2010. DOI: 10.1200/JCO.2009.26.8128. PMID: 20956623.
- ↑ K. Oechsle, A. Lorch, F. Honecker, C. Kollmannsberger i inni. Patterns of relapse after chemotherapy in patients with high-risk non-seminomatous germ cell tumor. „Oncology”. 78 (1), s. 47–53, 2010. DOI: 10.1159/000292358. PMID: 20215785.
- ↑ A. Lorch, C. Bascoul-Mollevi, A. Kramar, L. Einhorn i inni. Conventional-dose versus high-dose chemotherapy as first salvage treatment in male patients with metastatic germ cell tumors: evidence from a large international database. „J Clin Oncol”. 29 (16), s. 2178–2184, 2011. DOI: 10.1200/JCO.2010.32.6678. PMID: 21444870.
- ↑ J. Beyer, S. Stenning, A. Gerl, S. Fossa i inni. High-dose versus conventional-dose chemotherapy as first-salvage treatment in patients with non-seminomatous germ-cell tumors: a matched-pair analysis. „Ann Oncol”. 13 (4), s. 599–605, 2002. PMID: 12056711.
- ↑ K. Oechsle, C. Kollmannsberger, F. Honecker, F. Mayer i inni. Long-term survival after treatment with gemcitabine and oxaliplatin with and without paclitaxel plus secondary surgery in patients with cisplatin-refractory and/or multiply relapsed germ cell tumors. „Eur Urol”. 60 (4), s. 850–855, 2011. DOI: 10.1016/j.eururo.2011.06.019. PMID: 21704446.
- ↑ N. Nicolai, A. Necchi, L. Gianni, L. Piva i inni. Long-term results of a combination of paclitaxel, cisplatin and gemcitabine for salvage therapy in male germ-cell tumours. „BJU Int”. 104 (3), s. 340–346, 2009. DOI: 10.1111/j.1464-410X.2009.08453.x. PMID: 19239440.
- ↑ a b Albers i in. 2016 ↓, s. 27.
- ↑ Gilligan i in. 2017 ↓, s. 50–51.
- ↑ a b Krzakowski i in. 2015 ↓, s. 789.
- ↑ N Howlader i inni, Contents of the SEER Cancer Statistics Review (CSR), 1975-2014 Table 25.8 Cancer of the Testis (Invasive) [zarchiwizowane z adresu 2018-01-09].
- ↑ W. Sui, D.C. Morrow, C.E. Bermejo, N.J. Hellenthal. Trends in Testicular Cancer Survival: A Large Population-based Analysis. „Urology”. 85 (6), s. 1394–1398, 2015. DOI: 10.1016/j.urology.2015.03.022. PMID: 26099885.
- ↑ R.H. Verhoeven, A. Gondos, M.L. Janssen-Heijnen, K.U. Saum i inni. Testicular cancer in Europe and the USA: survival still rising among older patients. „Ann Oncol”. 24 (2), s. 508–513, 2013. DOI: 10.1093/annonc/mds460. PMID: 23110807.
- ↑ a b A.I. Baba, C. Câtoi: Comparative Oncology. The Publishing House of the Romanian Academy, 2007. ISBN 978-973-27-1457-7.
- ↑ a b Stephen J. Withrow: Withrow and MacEwen’s Small Animal Clinical Oncology. Elsevier Health Sciences, 2007, s. 637–640. ISBN 978-0-7216-0558-6.
- ↑ a b c d e f g h N. Hanna, L.H. Einhorn. Testicular cancer: a reflection on 50 years of discovery. „J Clin Oncol”. 32 (28), s. 3085–3092, 2014. DOI: 10.1200/JCO.2014.56.0896. PMID: 25024068.
- ↑ M.C. LI, R. Hertz, D.M. Bergenstal. Therapy of choriocarcinoma and related trophoblastic tumors with folic acid and purine antagonists. „N Engl J Med”. 259 (2), s. 66–74, 1958. DOI: 10.1056/NEJM195807102590204. PMID: 13566422.
- ↑ R.H. Blum, S.K. Carter, K. Agre. A clinical review of bleomycin--a new antineoplastic agent. „Cancer”. 31 (4), s. 903–914, 1973. PMID: 4122362.
- ↑ M.L. Samuels, C.D. Howe. Vinblastine in the management of testicular cancer. „Cancer”. 25 (5), s. 1009–1017, 1970. PMID: 5443728.
- ↑ M.L. Samuels, D.E. Johnson, P.Y. Holoye. Continuous intravenous bleomycin (NSC-125066) therapy with vinblastine (NSC-49842) in stage III testicular neoplasia. „Cancer Chemother Rep”. 59 (3). s. 563–570. PMID: 54212.
- ↑ D.J. Higby, H.J. Wallace, D.J. Albert, J.F. Holland. Diaminodichloroplatinum: a phase I study showing responses in testicular and other tumors. „Cancer”. 33 (5), s. 1219–1215, 1974. PMID: 4856724.
- ↑ L.H. Einhorn, J. Donohue. Cis-diamminedichloroplatinum, vinblastine, and bleomycin combination chemotherapy in disseminated testicular cancer. „Ann Intern Med”. 87 (3), s. 293–298, 1977. PMID: 71004.
- ↑ J.D. Hainsworth, S.D. Williams, L.H. Einhorn, R. Birch i inni. Successful treatment of resistant germinal neoplasms with VP-16 and cisplatin: results of a Southeastern Cancer Study Group trial. „J Clin Oncol”. 3 (5), s. 666–671, 1985. DOI: 10.1200/JCO.1985.3.5.666. PMID: 2582097.
- ↑ G.J. Bosl, R. Gluckman, N.L. Geller, R.B. Golbey i inni. VAB-6: an effective chemotherapy regimen for patients with germ-cell tumors. „J Clin Oncol”. 4 (10), s. 1493–1499, 1986. DOI: 10.1200/JCO.1986.4.10.1493. PMID: 2428948.
- ↑ G.J. Bosl, N.L. Geller, D. Bajorin, S.P. Leitner i inni. A randomized trial of etoposide + cisplatin versus vinblastine + bleomycin + cisplatin + cyclophosphamide + dactinomycin in patients with good-prognosis germ cell tumors. „J Clin Oncol”. 6 (8), s. 1231–1238, 1988. DOI: 10.1200/JCO.1988.6.8.1231. PMID: 2457657.
- ↑ S.D. Williams, R. Birch, L.H. Einhorn, L. Irwin i inni. Treatment of disseminated germ-cell tumors with cisplatin, bleomycin, and either vinblastine or etoposide. „N Engl J Med”. 316 (23), s. 1435–1440, 1987. DOI: 10.1056/NEJM198706043162302. PMID: 2437455.
Bibliografia
- P. Albers, W. Albrecht, F. Algaba, C. Bokemeyer i inni. Guidelines on Testicular Cancer. „Eur Urol”, 2016. DOI: 10.1016/j.eururo.2015.07.044.
- T. Gilligan, C. Beard, B. Carneiro, N. Cost i inni. Testicular Cancer, Version 2.2017. „J Natl Compr Canc Netw”, 2017.
- J. Oldenburg, S.D. Fosså, J. Nuver, A. Heidenreich i inni. Testicular seminoma and non-seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 24 Suppl 6, 2013. DOI: 10.1093/annonc/mdt304. PMID: 24078656.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- John N. Eble, Guido Sauter, Jonathan I. Epstein, Isabell A. Sesterhenn: Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs. IARC Press, 2004.
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Christopher D.M. Fletcher: Diagnostic Histopathology of Tumors. Elsevier Health Sciences, 2013. ISBN 978-1-4557-3754-3.
- Noel Weidner, Richard J. Cote, Saul Suster, Lawrence M. Weiss: Modern Surgical Pathology. Elsevier Health Sciences, 2009. ISBN 978-1-4377-1958-1.
- Nowotwory złośliwe jądra. W: Piotr Rutkowski, Krzysztof Warzocha: Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych 2013 rok. VM Media, 2013. ISBN 978-83-7599-594-7.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Nephron, Licencja: CC BY-SA 3.0
Micrograph of a spermatocytic seminoma. H&E stain.
Features of spermatocytic seminoma:
- Population of three cells.
- Small cells (6-8 µm) - with a large NC ratio.
- Look like secondary spermatocytes.
- Medium cells (15-18 µm) with prominent nucleoli.
- Filamentous chromatin (AKA spireme chromatin).
- Large cells (50-100 µm).
- Filamentous chromatin.
- Small cells (6-8 µm) - with a large NC ratio.
- Mucoid lakes.
- Intratubular spread (not seen on this image).
Related images
Autor: Nephron, Licencja: CC BY-SA 3.0
Intermediate magnification micrograph of an embryonal carcinoma, a type of germ cell tumour. H&E stain.
Features:
- Cell borders indistinct.
- Mitoses common.
- Variable architecture:
- Tubulopapillary,
- Glandular,
- Solid,
- Embryoid bodies - ball of cells in surrounded by empty space on three sides.
- Nuclei overlap.
- +/- Necrosis.
Related images
Additional images:
Autor: Nephron, Licencja: CC BY-SA 3.0
Low magnification micrograph of a Sertoli cell tumour, a type of testicular tumour. H&E stain.
Features:
- Groups of cells in chords or trabeculae (beam-like arrangement).
- Cells have:
- Light staining bubbly cytoplasm +/- large cytoplasmic vacuoles.
- Slightly irregular nucleoli.
- Granular irregular appearing chromatin.
Negatives:
- Mitoses are rare.
- No significant nuclear atypia.
Note:
- Cells resemble those found in immature seminiferous tubules.
Related images
Autor: Nephron, Licencja: CC BY-SA 3.0
Low magnification micrograph of a mature teratoma. H&E stain.
Products of all three germ layers are seen in the image:
- Mesoderm: immature cartilage (left of image).
- Endoderm: gastrointestinal lining cells/glands (centre-bottom of image).
- Ectoderm: epidermis with keratin (right of image).
Related images
Another case:
Autor: Jmarchn, Licencja: CC BY-SA 3.0
Left testicular seminoma (at left), with right testicle (at right), ultrasound image
Autor: Nephron, Licencja: CC BY-SA 4.0
Micrograph showing yolk sac tumour of the testis. H&E stain.
Findings were confirmed with immunohistochemistry (glypican-3 positive).
Related images
Autor: Jmarchn, Licencja: CC BY-SA 3.0
Retroperitoneal and bilateral lymphadenopathies of left testicular seminoma, come together and embrace the aorta, extending towards the posterior mediastinum. Man of 44 years old. Computed Tomography image.
Autor: Mme Mim, Licencja: CC BY-SA 4.0
most likely a seminoma (no pathology)
Autor:
- Fæ
-
Cancer_Research_UK_uploader
- derivative work: M1llx (zgłoś błąd)
Schemat przedstawiający orchidektomię z dostępu pachwinowego.
Autor: Ed Uthman from Houston, TX, USA, Licencja: CC BY 2.0
This 21-year-old male was aware of this 10-cm testicular mass for several months before he sought attention. His serum beta-HCG and alpha-fetoprotein were elevated. CT scan showed enlarged retroperitoneal and mesenteric lymph nodes, suspicious for malignancy. The urologist performed an orchiectomy.
The cut surface of the tumor was soft and hemorrhagic. I intially put in 20 sections, but the tumor was almost entirely necrotic. There were a few microscopic foci of what appeared to be syncytiotrophoblast. I put in 30 more sections and am awaitng those slides.
Autor: Nephron, Licencja: CC BY-SA 3.0
Intermediate magnification micrograph of a gonadoblastoma, a rare tumour of the gonads that is composed of a sex cord-stromal element (Sertoli cells or granulosa cells) and primitive germ cells. H&E stain.
Related images
Autor: Yale Rosen, Licencja: CC BY-SA 2.0
Metastatic testicular endodermal sinus tumor (yolk sac tumor).
Autor: Rocque BG, Başkaya MK, Licencja: CC BY 2.0
MRI showing injury due to brain herniation in a patient with choriocarcinoma. Caption reads, "Coronal MRI T2 FLAIR sequence showing herniation injury"
Autor: Yale Rosen from USA, Licencja: CC BY-SA 2.0
Metastatic choriocarcinoma
Autor: Calicut Medical College , Licencja: CC BY-SA 4.0
Micrograph of seminoma testes showing lobules of uniform cells separated by delicate septae of fibrous tissue. These cells can have a distinct outline with clear cytoplasm. The nuclei are large, with central prominent nucleolus.
Autor: Nephron, Licencja: CC BY-SA 3.0
High magnification micrograph of choriocarcinoma. H&E stain.
Choriocarcinomas consist of two cell populations:
-
Cytotrophoblasts.
- Pale/clear cytoplasm.
-
Syncytiotrophoblasts.
- Hyperchromatic cytoplasm.
- Typically multinucleated.
Traditionally, the syncytiotrophoblasts are said to produce the beta-hCG;[1]however, it has been determined that cytotrophoblast also produce some.[2]
The syncytiotrophoblasts are often arranged around the outside of cytotrophoblast cell clusters, reminicent of the arrangement in the placenta. On placental villi, the syncytiotrophoblasts are superficial to and, early in pregnancy, cover the cytotrophoblast.
Choriocarcinoma is classified as a germ cell tumour. It can arise in the testis or ovary and from a hydatidiform mole. It may be part of a mixed germ cell tumour.
Related images
References
- ↑ (2010). "Biological functions of hCG and hCG-related molecules.". Reprod Biol Endocrinol 8: 102. DOI:10.1186/1477-7827-8-102.
- ↑ (Aug 2002). "Trophoblast origin of hCG isoforms: cytotrophoblasts are the primary source of choriocarcinoma-like hCG.". Mol Cell Endocrinol 194 (1-2): 147-55.
Autor: Nephron, Licencja: CC BY-SA 3.0
Intermediate magnification micrograph of intratubular germ cell neoplasia, abbreviated ITGCN. H&E stain.
Normal seminiferous tubules with sperm are also seen in the images. This testis had a seminoma; however, this is not shown in the images.
Related images
Autor: Nephron, Licencja: CC BY-SA 3.0
Micrograph of the primitive neuroepithelium of an immature teratoma. H&E stain.
Related images
Autor: Nephron, Licencja: CC BY-SA 3.0
Intermediate magnification micrograph of a mixed germ cell tumour, also spelled mixed germ cell tumor. Testis (not apparent in images). H&E stain.
The intermediate magnification image show both embryonal carcinoma (right of image) and yolk sac tumour (left of image). The higher magnification images show only yolk sac tumour.
Common mixed germ cell tumour combinations are:
- Teratoma and embryonal carcinoma and yolk sac tumour.
- Seminoma and embryonal carcinoma.
- Teratoma and embryonal carcinoma.
Yolk sac tumour has ten different morphologic patterns:
- Reticular.
- Endodermal sinus-like.
- Microcystic.
- Papillary.
- Solid.
- Glandular.
- Alveolar
- Polyvesicular vitelline.
- Enteric.
- Hepatoid.
Related images
Seminoma of the Testis
Autor: Nephron, Licencja: CC BY-SA 3.0
High magnification micrograph of a Leydig cell tumour of the testis. H&E stain. Leydig cell tumours fall in the sex cord-stromal tumour subgroup of testicular tumours.
Leydig tumour shown has:
- cells with moderate nuclear size variation, and cells with:
- prominent round central nucleoli, and an
- eosinophilic vacuolated cytoplasm.
Classically, Leydig tumours have Reinke crystals, cylindrical crystalloid eosinophilic cytoplasmic bodies; these are not apparent in the micrograph.
See also
- Image:Leydig_cell_tumour1.jpg - low magnification view.
- Image:Leydig_cell_tumour2.jpg - intermediate magnification view.
Autor: Nephron, Licencja: CC BY-SA 3.0
Very high magnification micrograph of choriocarcinoma. H&E stain.
Choriocarcinomas consist of two cell populations:
-
Cytotrophoblasts.
- Pale/clear cytoplasm.
-
Syncytiotrophoblasts.
- Hyperchromatic cytoplasm.
- Typically multinucleated.
Traditionally, the syncytiotrophoblasts are said to produce the beta-hCG;[1]however, it has been determined that cytotrophoblast also produce some.[2]
The syncytiotrophoblasts are often arranged around the outside of cytotrophoblast cell clusters, reminicent of the arrangement in the placenta. On placental villi, the syncytiotrophoblasts are superficial to and, early in pregnancy, cover the cytotrophoblast.
Choriocarcinoma is classified as a germ cell tumour. It can arise in the testis or ovary and from a hydatidiform mole. It may be part of a mixed germ cell tumour.
Related images
References
- ↑ (2010). "Biological functions of hCG and hCG-related molecules.". Reprod Biol Endocrinol 8: 102. DOI:10.1186/1477-7827-8-102.
- ↑ (Aug 2002). "Trophoblast origin of hCG isoforms: cytotrophoblasts are the primary source of choriocarcinoma-like hCG.". Mol Cell Endocrinol 194 (1-2): 147-55.
Autor: Nephron, Licencja: CC BY-SA 4.0
Micrograph showing a seminoma with granulomas. H&E stain.
Related images
Autor: Nephron, Licencja: CC BY-SA 3.0
Very high magnification micrograph of an embryonal carcinoma, a type of germ cell tumour. H&E stain.
Main features:
- Nuclear atypia.
- Nucleoli prominent.
- Necrosis common.
- Nuclei overlap.
Other features:
- Variable architecture:
- Tubulopapillary.
- Glandular.
- Solid.
- Embryoid bodies - ball of cells in surrounded by empty space on three sides.
- Mitoses common.