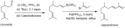Reakcja Suzukiego
Reakcja Suzukiego (sprzęganie Suzukiego[1], reakcja/sprzęganie Suzukiego-Miyaury[a]) – reakcja tworzenia wiązania węgiel-węgiel zachodząca pomiędzy związkami boroorganicznymi zawierającymi ligand nienasycony (Ar−BY2, R2C=CH−BY2, RC≡C−BY2) a halogenkami arylowymi lub winylowymi. Katalizowana jest przez kompleksy palladu na stopniu utlenienia (0)[3][4].
Nazwa pochodzi od nazwiska odkrywcy, chemika pochodzenia japońskiego, Akiry Suzukiego (ur. 1930), laureata Nagrody Nobla w dziedzinie chemii w 2010 r, oraz jego współpracownika Norio Miyaury.
Reakcja Suzukiego odgrywa znaczącą rolę w syntezie organicznej. Reakcja ta stosowana jest do rozbudowy szkieletu węglowego cząsteczek, szczególnie duże znaczenie odgrywa ona w otrzymywaniu polialkenów, pochodnych styrenu oraz podstawionych bifenyli[5]. Na temat tej reakcji oraz jej zastosowań w syntezie organicznej opublikowano wiele prac przeglądowych[6][7][8].
Reakcja zachodzi także z pseudohalogenkami, takimi jak triflany. Względna aktywność różnych halogenków i pseudohalogenków organicznych uszeregowana jest następująco:
- R2−I > R2−OTf > R2−Br >> R2−Cl
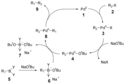
Mechanizm reakcji
Mechanizm reakcji posiada wiele cech wspólnych dla reakcji katalizowanych przez kompleksy metali przejściowych. W pierwszym etapie zachodzi addycja oksydatywna kompleksu palladu do halogenku 2, w wyniku czego powstaje związek palladoorganiczny 3. Następcza reakcja z zasadą prowadzi do powstania związku przejściowego 4, który poprzez reakcję transmetalacji z kompleksem boronowym 6 daje kolejny związek palladoorganiczy 8. Końcowym etapem reakcji jest reduktywna eliminacja oczekiwanego produktu 9 prowadząca do regeneracji katalizatora[10].
Addycja oksydatywna
Proces addycji zachodzi z retencją konfiguracji absolutnej w przypadku halogenków winylowych. Gdy substratem jest halogenek allilowy lub benzylowy to ma miejsce inwersja konfiguracji[11]. W wyniku addycji dochodzi do uformowania się izomeru cis kompleksu palladu, który następnie spotanicznie przekształca się do izomeru trans[12].
Reduktywna eliminacja
Poprzez wykorzystanie znakowania izotopowego z użyciem deuteru wykazano, że proces zachodzi z retencją konfiguracji absolutnej[13].
Zastosowania
Wiele przykładowych syntez z wykorzystaniem reakcji Suzukiego zostało opisanych w pracy Kotha[14]. Dzięki wykorzystaniu nowych ligandów fosforoorganicznych udało się ograniczyć ilość katalizatora używanego w reakcji do 0,001 procenta molowego[15].
Zobacz też
Uwagi
Przypisy
- ↑ Sprzęganie Suzukiego. W: Hanna Ignasiak: Synteza pochodnych pirydyny w reakcjach sprzęgania katalizowanych kompleksami palladu (praca doktorska). Katowice: Uniwersytet Śląski, Instytut Chemii, 2010, s. 49-52. [dostęp 2014-01-14].
- ↑ Spis treści. W: J. Gawroński, K. Gawrońska, K. Kacprzak, M. Kwit: Współczesna synteza organiczna. Warszawa: PWN, 2004.
- ↑ Norio Miyaura, Akira Suzuki, Kinji Yamada. A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides. „Tetrahedron Lett.”. 20, s. 3437-3440, 1979. DOI: 10.1016/S0040-4039(01)95429-2.
- ↑ Karolina Osowska, Sławomir Szafert. Związki i kompleksy poliynowe strategia syntezy i zastosowania. „Wiadomości Chemiczne”. 62 (5-6), s. 479-511, 2008.
- ↑ Jan H. Kirchhoff, Matthew R. Netherton, Ivory D. Hills, Gregory C. Fu. Boronic Acids: New Coupling Partners in Room-Temperature Suzuki Reactions of Alkyl Bromides. Crystallographic Characterization of an Oxidative-Addition Adduct Generated under Remarkably Mild Conditions. „J. Am. Chem. Soc.”. 124 (46), s. 13662–13663, 2002. DOI: 10.1021/ja0283899.
- ↑ Akira Suzuki. Synthetic studies via the cross-coupling reaction of organoboron derivatives with organic halides. „Pure Appl. Chem”. 63 (3), s. 419-422, 1991. DOI: 10.1351/pac199163030419.
- ↑ Akira Suzuki. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. „Chem. Rev.”. 95 (7), s. 2457–2483, 1995. DOI: 10.1021/cr00039a007.
- ↑ Akira Suzuki. Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles, 1995–1998. „J. Organomet. Chem.”. 576 (1-2), s. 147-168, 1999. DOI: 10.1016/S0022-328X(98)01055-9.
- ↑ Suzuki Coupling. Organic Chemistry Portal. [dostęp 2014-01-14].
- ↑ Karl Matos, John A. Soderquist. Alkylboranes in the Suzuki−Miyaura Coupling: Stereochemical and Mechanistic Studies. „J. Org. Chem.”. 63 (3), s. 461–470, 1998. DOI: 10.1021/jo971681s.
- ↑ John K. Stille, Kreisler S. Y. Lau. Mechanisms of oxidative addition of organic halides to Group 8 transition-metal complexes. „Acc. Chem. Res.”. 10 (12), s. 434–442, 1977. DOI: 10.1021/ar50120a002.
- ↑ Arturo L. Casado, Pablo Espinet. On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4 and the Mechanism of the cis-to-trans Isomerization of [PdRX(PPh3)2] Complexes (R = Aryl, X = Halide). „Organometallics”. 17 (5), s. 954–959, 1998. DOI: 10.1021/om9709502.
- ↑ Brian H. Ridgway, K. A. Woerpel. Transmetalation of Alkylboranes to Palladium in the Suzuki Coupling Reaction Proceeds with Retention of Stereochemistry. „J. Org. Chem.”. 63 (3), s. 458–460, 1998. DOI: 10.1021/jo970803d.
- ↑ Sambasivarao Kotha, Kakali Lahiri, Dhurke Kashinath. Recent applications of the Suzuki–Miyaura cross-coupling reaction in organic synthesis. „Tetrahedron”. 58 (48), s. 9633-9695, 2002. DOI: 10.1016/S0040-4020(02)01188-2.
- ↑ Timothy E. Barder, Shawn D. Walker, Joseph R. Martinelli, Stephen L. Buchwald. Catalysts for Suzuki−Miyaura Coupling Processes: Scope and Studies of the Effect of Ligand Structure. „J. Am. Chem. Soc.”. 127 (13), s. 4685–4696, 2005. DOI: 10.1021/ja042491j.
Media użyte na tej stronie
Description: Reaction mechanism of the Suzuki reaction.
- Author, date of creation: selfmade by ~K, 01 January 2006.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.
Synthesis of cappatriene from w:citronellal using a w:Suzuki coupling