Receptor AMPA
Receptor AMPA − jeden z czterech głównych receptorów kwasu glutaminowego[1], selektywnie aktywowany przez kwas α-amino-3-hydroksy-5-metylo-4-izoksazolopropionowy (AMPA), sztuczny analog glutaminianu.
 |  |
| AMPA | Kwas glutaminowy |
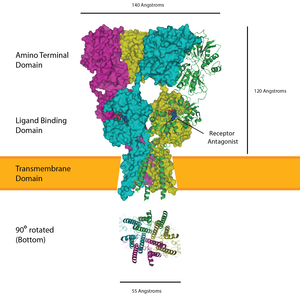
Jest to receptor jonotropowy, który pod wpływem związania ligandu staje się przepuszczalny dla jonów sodu (Na+), potasu (K+) oraz wapnia (Ca2+). Jest jednym z najbardziej powszechnych receptorów w ośrodkowym układzie nerwowym. Bierze udział w tzw. szybkim przekaźnictwie synaptycznym. Odgrywa również ważną rolę w zjawisku zwanym długotrwałym wzmocnieniem synaptycznym (LTP).
Poszczególne receptory AMPA są zbudowane z czterech typów podjednostek (GluR1, GluR2, GluR3 oraz GluR4) połączonych ze sobą w różnych kombinacjach.
Receptory AMPA razem z receptorami NMDA znajdują się w synapsach pobudzeniowych, gdzie wspólnie otwierają kanały wapniowe w odpowiedzi na bodziec, przy czym receptory NMDA działają wolniej i dłużej, a AMPA szybciej i krócej. Stosunek receptorów AMPA/NMDA rośnie wraz z wiekiem organizmu[1].
Przypisy
- ↑ a b Małgorzata Kossut: Synapsy i plastyczność mózgu. W: Polskie i światowe osiągnięcia nauki. Nauki biologiczne [on-line]. Fundacja im. Wojciecha Świętosławskiego na rzecz wspierania nauki i rozwoju potencjału naukowego w Polsce. s. 185–230. [dostęp 2015-07-14]. [zarchiwizowane z tego adresu (2013-11-09)]. ISBN 978-83-87576-52-3
Bibliografia
- Alan Longstaff: Neurobiologia. Warszawa: Wydawnictwo Naukowe PWN, 2012, s. 47. ISBN 978-83-01-13805-9.
- T. Nakagawa. The biochemistry, ultrastructure, and subunit assembly mechanism of AMPA receptors.. „Mol Neurobiol”. 42 (3), s. 161-84, Dec 2010. DOI: 10.1007/s12035-010-8149-x. PMID: 21080238.
Media użyte na tej stronie
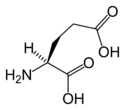
2D structure of AMPA (α-amino-3-hydroxyl-5-methyl-4-isoxazole-propionate)
Autor: Curtis Neveu, Licencja: CC BY-SA 3.0
The AMPA receptor bound to a glutamate antagonist showing the amino terminal, ligand binding, and transmembrane domain, PDB 3KG2.