Reguła Hückla
Reguła Hückla (reguła 4n+2) − prosta metoda pozwalająca na sprawdzenie, czy płaski pierścień związku chemicznego jest aromatyczny. Reguła ta wynika z analiz kwantowo-mechanicznych zjawiska aromatyczności wykonanych przez Ericha Hückla w 1931 r.
Reguła ta głosi:
- Związek jest prawdopodobnie aromatyczny, gdy w układzie wiązań wielokrotnych tworzących układ cykliczny tego związku występuje 4n+2 elektronów zlokalizowanych na wiązaniach π, gdzie n = dowolna liczba naturalna.
Reguła ta w praktyce jest sprawdzona dla n = od 0 do 6, przy czym zawodzi ona dla związków, w których występują więcej niż 3 sprzężone pierścienie. Np. piren i koronen są związkami aromatycznymi, mimo że nie spełniają reguły Hückla[1]. Podobnie jest też z fulerenami.
Dokładniejszym sposobem ustalania aromatyczności związków organicznych jest metoda Pariser-Parr-Pople, która jednak nie daje się sprowadzić do prostej formuły obliczeniowej.
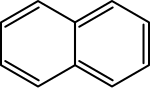
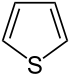
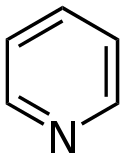
Przykłady związków aromatycznych spełniających regułę Hückla
- związki zawierające heteroatomy
- związki jonowe
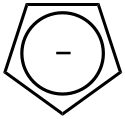
- karboaniony
- Karboaniony to rodzaj jonów, które powstają przez oderwanie atomu wodoru od atomu węgla z pozostawieniem wolnej pary elektronowej na atomie węgla. W niektórych układach cyklicznych para ta jest włączana do układu wiązań π na skutek czego jon uzyskuje cechy aromatyczności. Przykładem takiego anionu jest cyklopentadienyl.
- karbokationy
- Przykładem karbokationu spełniającego regułę Hückla jest kation cykloheptatrienylowy.
Przypisy
- ↑ Roberts, John D., Streitwieser, Andrew, Regan, Clare M.. Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals. „Journal of the American Chemical Society”. 74 (18), s. 4579-4582, 1952. DOI: 10.1021/ja01138a038.
Media użyte na tej stronie
Chemical structure of pyridine.
Skeletal formula of Naphthalene
Structure of the cycloheptatrienyl cation
Chemical structure of Furan
Structural formula of thiophene
Pyrrole
Structure of the cyclopentadienyl anion