Shigella flexneri
| ||
 | ||
| Systematyka | ||
| Domena | bakterie | |
| Typ | proteobakterie | |
| Klasa | gammaproteobakterie | |
| Rząd | Enterobacteriales | |
| Rodzina | Enterobacteriaceae | |
| Rodzaj | Shigella | |
| Gatunek | Shigella flexneri | |
| Nazwa systematyczna | ||
| Shigella flexneri Castellani & Chalmers, 1919 | ||
Shigella flexneri – gatunek bakterii powodujący zatrucia pokarmowe (czerwonka). W klasyfikacji serologicznej zaliczany do podgrupy B rodzaju Shigella. Nazwa gatunkowa pochodzi od Simona Flexnera.
Biologia
Morfologia
Są to Gram-ujemne, nieurzęsione, bezotoczkowe i nieprzetrwalnikujące pałeczki. W mikroskopie elektronowym u szczepów dzikich widoczne są fimbrie, co jest cechą charakterystyczną tego gatunku.
Bakterię zalicza się do fakultatywnych patogenów wewnątrzkomórkowych[1].
Hodowla
Bakteria wzrasta na prostych podłożach hodowlanych, pożywkach z żółcią (agar MacConkeya, agar SS), pożywce XLD[2] oraz na wybiórczym podłożu Leifsona. Wzrost następuje w dwóch możliwych postaciach:
- kolonie okrągłe, wypukłe, błyszczące – forma S
- kolonie rozlane, szorstkie – forma R
W przypadku skażenia żywności S. flexneri, komórek bakteryjnych jest zazwyczaj zbyt mało (~100/1g) aby posiew był wiarygodny (dużo wyników fałszywie ujemnych); trzeba użyć innych metod[3].
Wymagania S. flexneri są identyczne jak u innych bakterii należących do rodzaju Shigella.
Profil biochemiczny
Podobnie jak inne bakterie tej rodziny, S. flexneri rozkłada glukozę, nie wytwarza ureazy, H2S, ani nie rozkłada żelatyny. Wszystkie cukry fermentowane są bez wytwarzania gazu – wyjątkiem jest serotyp 6 wytwarzający gaz przy wykorzystywaniu glukozy, dulcitolu i mannitolu (szczepy te początkowo nazwano Newcastle bacillus i Manchester bacillus)[4]. Uważa się, że ma to związek z obecnością 4 plazmidów R[4]. Poza serotypem 2b oraz 6 drobnoustroje należące do tego gatunku wykazują zdolność wytwarzania indolu.
Drobnoustrój wytwarza bakteriocyny, które są aktywne wobec flory fizjologicznej człowieka[5].
| Serotyp | Laktoza | Sacharoza | Dulcitol | Mannitol | Ramnoza | Ksyloza |
| 1a | brak | opóźniona | brak | obecna | brak | brak |
| 1b | brak | obecna | brak | obecna | brak | brak |
| 2a | brak | brak | brak | obecna | brak | brak |
| 2b | brak | brak | brak | obecna | brak | brak |
| 3 | brak | opóźniona | brak | obecna | obecna | brak |
| 4a | brak | brak | brak | obecna | brak | brak |
| 4b | brak | opóźniona | brak | obecna | brak | brak |
| 5 | brak | opóźniona | brak | obecna | brak | brak |
| 6 | brak | brak | obecna | obecna | brak | brak |
Czynniki wirulencji
Zidentyfikowano wiele czynników wirulencji, wśród których jest kinaza tyrozynowa ABL-1[6] oraz charakterystyczny dla Salmonella kompleks białkowy PhoP/PhoQ utrudniający fagocytozę drobnoustroju[7]. Wszystkie szczepy patogenne posiadają plazmid wirulencji z genami IpaACDB oraz Mxi-Spa-typ III, których produkty są niezbędne do inwazji nabłonka jelita[7].
Odpowiedzią gospodarza na zakażenie jest miejscowa reakcja zapalna z naciekami z limfocytów, makrofagów, wydzielaniem cytokin: TNF, IL-1, IL-6 i IL-12[8]. We wczesnej reakcji obronnej rolę odgrywa IFN-gamma; jego źródłem mogą być limfocyty T oraz NK[8].
Chorobotwórczość
Zakażenie S. flexneri u ludzi częściej dotyczy płci męskiej[9]. Występuje nieco później niż infekcje innymi gatunkami Shigella (średnie wieku zachorowania odpowiednio 12 i 8 lat)[9]. Być może późniejszy średni wiek zachorowań oraz płeć męska ma związek z przenoszeniem tej bakterii u mężczyzn mających kontakty seksualne z innymi mężczyznami (nie jest to jednak pewna przyczyna – w tej populacji wykryto także S. sonnei)[9].
W badaniu przeprowadzonym w USA nie wykazano cykliczności zachorowań zależnie od pory roku lub od lokalizacji geograficznej[9].
Zażywanie morfiny lub jej pochodnych nie zwiększa ryzyka infekcji systemowej[10].
Dyzenteria
Gatunek ten jest w Azji oraz Afryce najważniejszą przyczyną czerwonki – w Europie jest nią najczęściej S. sonnei[11]. S. flexneri odpowiada za 90% (Tanzania)[12], 87% (Argentyna)[13] 72,2% (Etiopia)[14], 64% (Erytrea)[15], 60% (Jemen)[16], 58% (Autonomia Palestyńska)[17], 54% (Pakistan)[18], 51% (Republika Środkowoafrykańska)[19], 49% (Senegal)[20], 45% (Indie)[21], 43-67% (Nepal)[22][23] wszystkich przypadków. Drugie miejsce zajmuje w Iranie (19,51%)[24], USA (18%)[9] czy Hiszpanii (46%)[25]. Podczas operacji w Iraku gatunek ten był odpowiedzialny za 10% wszystkich epizodów biegunek u amerykańskich Marines[26].
Bakteriemia
Gatunek ten odpowiada za około 88% wszystkich przypadków bakteriemii Shigella[27]. Obecność bakterii we krwi występuje znamiennie częściej u pacjentów HIV dodatnich (co najmniej 30% przypadków)[27]. Rokowanie u dzieci jest dobre, natomiast połowa dorosłych umiera z powodu zakażenia[27].
Sepsa dla S. flexneri jest bardzo rzadka, opisano jednak jej przypadki u osób z zakażeniem układu pokarmowego, zazwyczaj niekompetentnych immunologicznie[28][29][30]. Powikłaniem jednego przypadku sepsy była encefalopatia[31].
Zapalenie rogówki
Shigella flexneri jest rzadkim czynnikiem etiologicznym wrzodziejącego zapalenia rogówki; w latach 1943–2006 opisano jedynie 14 takich przypadków[32]. Zakażenia dotyczyły młodych pacjentów (3 miesiące – 8 lat), zawsze z towarzyszącym agresywnym zakażeniem przewodu pokarmowego[32]. Z tego powodu przy dodatniej hodowli z rogówki należy wykonać posiew kału[32].
Zapalenie płuc
Opisano przypadki zapalenia płuc o etiologii S. flexneri u osób w złym stanie ogólnym (alkoholicy i osoby niedożywione); ma ono niepomyślne rokowanie[33][34].
Zapalenie sromu i pochwy
Opisano co najmniej kilkanaście przypadków przewlekłego zapalenia sromu i pochwy u małych dziewczynek[35][36][37]; prawdopodobnie przy współistniejącym zakażeniu przewodu pokarmowego[37]
Rzadkie choroby
Opublikowano jeden przypadek zapalenia opon mózgowych[38], zapalenia otrzewnej[39], toksycznego rozdęcia okrężnicy[29] oraz kilka przypadków ropni – (okołonerkowy[40] i śledziony[41]).
Opisano również niewydolność nerek spowodowaną krążącymi kompleksami immunologicznymi[42] oraz dwa przypadki aseptycznego zapalenia stawów jako powikłanie po infekcji tą bakterią[43].
Antybiotykowrażliwość
Informacje ogólne
Uważa się, że większość szczepów jest wrażliwa na imipenem oraz cyprofloksacynę[44][45].
Wyniki wielu badań sugerują, że gatunek ten jest najbardziej oporny spośród całego rodzaju Shigella[13][14][46][47].
Afryka
Opisano wrażliwość bakterii na antybiotyki u dzieci z infekcją przewodu pokarmowego o etiologii S. flexneri w Mozambiku (2009)[48]. Oporność była następująca – ampicylina (66%), chloramfenikol (61%), tetracykliny (64%); większość szczepów wrażliwa była na cyprofloksacynę oraz ceftriakson[48]. W Senegalu ponad połowa szczepów nie była wrażliwa na amoksycylinę (także z kwasem klawulanowym) oraz chloramfenikol[20]. Powszechnie stosowane antybiotyki na szigellozę w Afryce nie wykazują aktywności przeciwko S. flexneri[12].
Azja
W Chinach 12% szczepów S. flexneri było opornych na fluorochinolony – przyczyną są mutacje genów gyrA oraz parC[49], kodujące pompy przezbłonowe aktywnie usuwające antybiotyk z komórek[50]. Podobne mutacje opisano w Korei – 2 przypadki oporne na ogólną liczbę 5938 szczepów[50]. Rosyjskie szczepy są w większości oporne na chloramfenikol i tetracykliny[51]. W Turcji 73% szczepów oporne jest na ampicylinę; ma to ważne implikacje kliniczne podczas leczenia empirycznego, ponieważ częstszy czynnik etiologiczny czerwonki w tym rejonie jest zazwyczaj wrażliwy na ten antybiotyk[45].
Na 5616 wyizolowanych szczepów S. flexneri w Izraelu, 4 wytwarzały ESBL[52].
Ameryka
W Stanach Zjednoczonych 75% szczepów oporne było na ampicylinę, 40% na trimetoprym-sulfametoksazol, 2% na kwas nalidyksowy, 0,003% na cyprofloksacynę (u dziecka z Chin), a wszystkie bakterie wrażliwe były na ceftriakson[9]. Oporność na chloramfenikol wynosząca 70% była znamiennie wyższa od wartości dla S. sonnei wynoszącej 1%[9]. Mechanizm oporności na ten antybiotyk kodowany jest na chromosomie[53].
Przypisy
- ↑ CJ. Dorman, S. McKenna, C. Beloin. Regulation of virulence gene expression in Shigella flexneri, a facultative intracellular pathogen. „Int J Med Microbiol”. 291 (2), s. 89-96, May 2001. PMID: 11437343.
- ↑ HM. Pollock, BJ. Dahlgren. Clinical evaluation of enteric media in the primary isolation of Salmonella and Shigella. „Appl Microbiol”. 27 (1), s. 197-201, Jan 1974. PMID: 4589129.
- ↑ SB. Tollison, MG. Johnson. Sensitivity to bile salts of Shigella flexneri sublethally heat stressed in buffer or broth. „Appl Environ Microbiol”. 50 (2), s. 337-41, Aug 1985. PMID: 3901919.
- ↑ a b CE. Dodd, D. Jones. Enhancement of gas production in a strain of Shigella flexneri serotype 6 by R plasmids. „J Med Microbiol”. 14 (4), s. 469-73, Nov 1981. PMID: 7031253.
- ↑ C. Padilla, O. Lobos, E. Hubert. Shigella flexneri strains produce bacteriocins active against members of the human microbial intestinal flora. „Rev Latinoam Microbiol”. 46 (3-4). s. 85-8. PMID: 17061528.
- ↑ EA. Burton, AM. Pendergast, A. Aballay. The Caenorhabditis elegans ABL-1 tyrosine kinase is required for Shigella flexneri pathogenesis. „Appl Environ Microbiol”. 72 (7), s. 5043-51, Jul 2006. DOI: 10.1128/AEM.00558-06. PMID: 16820504.
- ↑ a b JE. Moss, PE. Fisher, B. Vick, EA. Groisman i inni. The regulatory protein PhoP controls susceptibility to the host inflammatory response in Shigella flexneri. „Cell Microbiol”. 2 (6), s. 443-52, Dec 2000. PMID: 11207599.
- ↑ a b K. Le-Barillec, JG. Magalhaes, E. Corcuff, A. Thuizat i inni. Roles for T and NK cells in the innate immune response to Shigella flexneri. „J Immunol”. 175 (3), s. 1735-40, Aug 2005. PMID: 16034114.
- ↑ a b c d e f g S. Sivapalasingam, JM. Nelson, K. Joyce, M. Hoekstra i inni. High prevalence of antimicrobial resistance among Shigella isolates in the United States tested by the National Antimicrobial Resistance Monitoring System from 1999 to 2002. „Antimicrob Agents Chemother”. 50 (1), s. 49-54, Jan 2006. DOI: 10.1128/AAC.50.1.49-54.2006. PMID: 16377666.
- ↑ H. Asakura, K. Kawamoto, S. Igimi, S. Yamamoto i inni. Enhancement of mice susceptibility to infection with Listeria monocytogenes by the treatment of morphine. „Microbiol Immunol”. 50 (7), s. 543-7, 2006. PMID: 16858145.
- ↑ GP. Pazhani, SK. Niyogi, AK. Singh, B. Sen i inni. Molecular characterization of multidrug-resistant Shigella species isolated from epidemic and endemic cases of shigellosis in India. „J Med Microbiol”. 57 (Pt 7), s. 856-63, Jul 2008. DOI: 10.1099/jmm.0.2008/000521-0. PMID: 18566144.
- ↑ a b MM. Temu, GM. Kaatano, ND. Miyaye, SN. Buhalata i inni. Antimicrobial susceptibility of Shigella flexneri and S. dysenteriae isolated from stool specimens of patients with bloody diarrhoea in Mwanza, Tanzania. „Tanzan Health Res Bull”. 9 (3), s. 186-9, Sep 2007. PMID: 18087897.
- ↑ a b LA. Merino, GE. Hreñuk, MC. Ronconi, JM. Alonso. [Antibiotic resistance and molecular epidemiology of Shigella spp. in northeastern Argentina]. „Rev Panam Salud Publica”. 15 (4), s. 219-24, Apr 2004. PMID: 15193176.
- ↑ a b M. Tiruneh. Serodiversity and antimicrobial resistance pattern of Shigella isolates at Gondar University teaching hospital, Northwest Ethiopia. „Jpn J Infect Dis”. 62 (2), s. 93-7, Mar 2009. PMID: 19305047.
- ↑ DG. Naik. Prevalence and antimicrobial susceptibility patterns of Shigella species in Asmara, Eritrea, northeast Africa.. „J Microbiol Immunol Infect”. 39 (5), s. 392-5, Oct 2006. PMID: 17066201.
- ↑ KA. Al-Moyed, NS. Harmal, AH. Al-Harasy, HA. Al-Shamahy. Increasing single and multi-antibiotic resistance in Shigella species isolated from shigellosis patients in Sana'a, Yemen. „Saudi Med J”. 27 (8), s. 1157-60, Aug 2006. PMID: 16883444.
- ↑ FH. Abu Elamreen, FA. Sharif, JE. Deeb. Isolation and antibiotic susceptibility of Salmonella and Shigella strains isolated from children in Gaza, Palestine from 1999 to 2006. „J Gastroenterol Hepatol”. 23 (8 Pt 2), s. e330-3, Aug 2008. DOI: 10.1111/j.1440-1746.2007.05139.x. PMID: 17854424.
- ↑ A. Zafar, N. Sabir, ZA. Bhutta. Frequency of isolation of shigella serogroups/serotypes and their antimicrobial susceptibility pattern in children from slum areas in Karachi. „J Pak Med Assoc”. 55 (5), s. 184-8, May 2005. PMID: 15960281.
- ↑ R. Bercion, SP. Njuimo, PM. Boudjeka, A. Manirakiza. Distribution and antibiotic susceptibility of Shigella isolates in Bangui, Central African Republic. „Trop Med Int Health”. 13 (4), s. 468-71, Apr 2008. DOI: 10.1111/j.1365-3156.2008.02023.x. PMID: 18282240.
- ↑ a b JM. Sire, EA. Macondo, JD. Perrier-Gros-Claude, T. Siby i inni. Antimicrobial resistance in Shigella species isolated in Dakar, Senegal (2004-2006). „Jpn J Infect Dis”. 61 (4), s. 307-9, Jul 2008. PMID: 18653976.
- ↑ B. Mamatha, BR. Pusapati, C. Rituparna. Changing patterns of antimicrobial susceptibility of Shigella serotypes isolated from children with acute diarrhea in Manipal, South India, a 5 year study. „Southeast Asian J Trop Med Public Health”. 38 (5), s. 863-6, Sep 2007. PMID: 18041303.
- ↑ P. Kansakar, S. Malla, GR. Ghimire. Shigella isolates of Nepal: changes in the incidence of shigella subgroups and trends of antimicrobial susceptibility pattern. „Kathmandu Univ Med J (KUMJ)”. 5 (1). s. 32-7. PMID: 18603983.
- ↑ G. Wilson, JM. Easow, C. Mukhopadhyay, PG. Shivananda. Isolation antimicrobial susceptibility of Shigella from patients with acute gastroenteritis in Western Nepal. „Indian J Med Res”. 123 (2), s. 145-50, Feb 2006. PMID: 16575113.
- ↑ S. Farshad, R. Sheikhi, A. Japoni, E. Basiri i inni. Characterization of Shigella strains in Iran by plasmid profile analysis and PCR amplification of ipa genes. „J Clin Microbiol”. 44 (8), s. 2879-83, Aug 2006. DOI: 10.1128/JCM.00310-06. PMID: 16891506.
- ↑ MM. Navia, J. Gascón, J. Vila. Analysis of the mechanisms of resistance to several antimicrobial agents in Shigella spp. causing travellers' diarrhoea. „Clin Microbiol Infect”. 11 (12), s. 1044-7, Dec 2005. DOI: 10.1111/j.1469-0691.2005.01277.x. PMID: 16307563.
- ↑ SA. Thornton, SS. Sherman, T. Farkas, W. Zhong i inni. Gastroenteritis in US Marines during Operation Iraqi Freedom. „Clin Infect Dis”. 40 (4), s. 519-25, Feb 2005. DOI: 10.1086/427501. PMID: 15712073.
- ↑ a b c NE. Davies, AS. Karstaedt. Shigella bacteraemia over a decade in Soweto, South Africa. „Trans R Soc Trop Med Hyg”. 102 (12), s. 1269-73, Dec 2008. DOI: 10.1016/j.trstmh.2008.04.037. PMID: 18550134.
- ↑ JB. Yen, KW. Chang, TL. Wu, AJ. Kuo i inni. Shigella flexneri sepsis in an infant. „Chang Gung Med J”. 26 (8), s. 611-4, Aug 2003. PMID: 14609044.
- ↑ a b CS. Bello, AA. Al-Barki, ME. El-Awad, RV. Patel. Shigella flexneri bacteremia in a child. „Saudi Med J”. 24 (4), s. 403-5, Apr 2003. PMID: 12754544.
- ↑ HM. Oh, AL. Tan. Shigella septicaemia in adults: report of two cases and mini-review. „Ann Acad Med Singapore”. 30 (6), s. 668-70, Nov 2001. PMID: 11817302.
- ↑ A. Beigelman, E. Leibovitz, S. Sofer. Septic shock associated with Shigella flexneri dysentery. „Scand J Infect Dis”. 34 (9), s. 692-3, 2002. PMID: 12374365.
- ↑ a b c HL. Muytjens, CA. Eggink, FC. Dijkman, JM. Bakkers i inni. Keratitis due to Shigella flexneri. „J Clin Microbiol”. 44 (6), s. 2291-4, Jun 2006. DOI: 10.1128/JCM.00481-06. PMID: 16757643.
- ↑ ND. Iushchuk, AIu. Rozenblium, IuG. Parkhomenko, LV. Efremova i inni. [Clinical and morphological aspects of Shigellosis flexneri in patients with an aggravated premorbid state]. „Zh Mikrobiol Epidemiol Immunobiol”. 2. s. 77-9. PMID: 12043161.
- ↑ T. Butler, D. Dunn, B. Dahms, M. Islam. Causes of death and the histopathologic findings in fatal shigellosis. „Pediatr Infect Dis J”. 8 (11), s. 767-72, Nov 1989. PMID: 2594452.
- ↑ TC. Davis. Chronic vulvovaginitis in children due to Shigella flexneri.. „Pediatrics”. 56 (1), s. 41-4, Jul 1975. PMID: 1098002.
- ↑ M. Baiulescu, PR. Hannon, JF. Marcinak, WM. Janda i inni. Chronic vulvovaginitis caused by antibiotic-resistant Shigella flexneri in a prepubertal child.. „Pediatr Infect Dis J”. 21 (2), s. 170-2, Feb 2002. PMID: 11840089.
- ↑ a b S. Rajkumar, G. Narayanaswamy, TA. Laude. Shigella vulvovaginitis in childhood: a case report.. „J Natl Med Assoc”. 71 (10), s. 1005-6, Oct 1979. PMID: 395325.
- ↑ HP. Jackson, DG. Kilgore. Purulent meningitis caused by Shigella flexneri. A case report. „J S C Med Assoc”. 67 (8), s. 347-50, Aug 1971. PMID: 5286587.
- ↑ [Acute enterocolitis due to Shigella flexneri associated with bronchopneumonia and complicated by peritonitis.]. „Bol Med Hosp Infant Mex”. 11 (2), s. 203-11, Apr 1954. PMID: 13181966.
- ↑ H. Al-Soub, M. Al-Maslamani, J. Al-Khuwaiter, Y. El-Deeb i inni. Shigella flexneri perinephric abscess and bacteremia. „Ann Saudi Med”. 25 (5). s. 419-21. PMID: 16270768.
- ↑ DL. Drow, L. Mercer, JB. Peacock. Splenic abscess caused by Shigella flexneri and Bacteroides fragilis. „J Clin Microbiol”. 19 (1), s. 79-80, Jan 1984. PMID: 6361064.
- ↑ DM. Musher, RJ. Hamill, MR. Ladinsky, DK. Winsor i inni. Acute glomerulonephritis due to Shigella flexneri dysentery with demonstration of a virulence protein of Shigella in circulating immune complexes.. „J Infect Dis”. 161 (2), s. 366-7, Feb 1990. PMID: 2405072.
- ↑ WD. Neithercut, MA. Hudson, CC. Smith. Can erythema nodosum and reactive arthritis be a sequel to Shigella flexneri gastroenteritis?. „Scott Med J”. 29 (3), s. 197-9, Jul 1984. PMID: 6398514.
- ↑ TA. Burbutashvili, AO. Golidzhashvili, MG. Dzuliashvili, KA. Gabitashvili i inni. [Study of antibiotic sensitivity of diarrheal microorganisms]. „Georgian Med News”. 146, s. 47-52, May 2007. PMID: 17595461.
- ↑ a b EN. Ozmert, B. Göktürk, K. Yurdakök, SS. Yalçin i inni. Shigella antibiotic resistance in central Turkey: comparison of the years 1987-1994 and 1995-2002. „J Pediatr Gastroenterol Nutr”. 40 (3), s. 359-62, Mar 2005. PMID: 15735493.
- ↑ CY. Kuo, LH. Su, J. Perera, C. Carlos i inni. Antimicrobial susceptibility of Shigella isolates in eight Asian countries, 2001-2004. „J Microbiol Immunol Infect”. 41 (2), s. 107-11, Apr 2008. PMID: 18473096.
- ↑ C. Boehme, T. Iglesias, A. Loyola, L. Soto i inni. [Comparison of Shigella susceptibility to commonly used antimicrobials in the Temuco Regional Hospital, Chile 1990 - 2001]. „Rev Med Chil”. 130 (9), s. 1021-6, Sep 2002. PMID: 12434650.
- ↑ a b I. Mandomando, D. Jaintilal, MJ. Pons, X. Vallès i inni. Antimicrobial susceptibility and mechanisms of resistance in Shigella and Salmonella isolates from children under five years of age with diarrhea in rural Mozambique. „Antimicrob Agents Chemother”. 53 (6), s. 2450-4, Jun 2009. DOI: 10.1128/AAC.01282-08. PMID: 19332670.
- ↑ XY. Pu, JC. Pan, HQ. Wang, W. Zhang i inni. Characterization of fluoroquinolone-resistant Shigella flexneri in Hangzhou area of China. „J Antimicrob Chemother”. 63 (5), s. 917-20, May 2009. DOI: 10.1093/jac/dkp087. PMID: 19297378.
- ↑ a b JY. Kim, SH. Kim, SM. Jeon, MS. Park i inni. Resistance to fluoroquinolones by the combination of target site mutations and enhanced expression of genes for efflux pumps in Shigella flexneri and Shigella sonnei strains isolated in Korea. „Clin Microbiol Infect”. 14 (8), s. 760-5, Aug 2008. DOI: 10.1111/j.1469-0691.2008.02033.x. PMID: 18727800.
- ↑ IV. Novokshonova, OI. Zelenskaia, IE. Gol'dberg, BA. Kozlikhin i inni. [Significance of determination of Shigella antibiotic resistance in bacteriological diagnosis of dysentery]. „Antibiot Khimioter”. 50 (2-3), s. 30-2, 2005. PMID: 16308937.
- ↑ V. Vasilev, R. Japheth, R. Yishai, N. Andorn i inni. Extended-spectrum beta-lactamase-producing Shigella strains in Israel, 2000-2004.. „Eur J Clin Microbiol Infect Dis”. 26 (3), s. 189-94, Mar 2007. DOI: 10.1007/s10096-007-0263-y. PMID: 17265070.
- ↑ M. Farfán, O. Flores, N. Navarro, V. Prado i inni. [Molecular characterization of resistance mechanisms to chloramphenicol in Shigella flexneri strains isolated from Chilean children with acute diarrhea]. „Rev Med Chil”. 130 (3), s. 275-80, Mar 2002. PMID: 12043369.
Bibliografia
- Podstawy mikrobiologii lekarskiej : podręcznik dla studentów. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1979, s. 260-265. ISBN 83-200-0181-1.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Y tambe, Licencja: CC-BY-SA-3.0
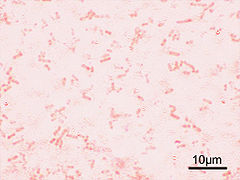
Microscopic image of Shigella flexneri. Gram staining, magnification: 1,000

