Szczętki
| Euphausiacea | |
| Dana, 1852 | |
 Kryl antarktyczny (Euphausia superba) | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Podkrólestwo | |
| Nadtyp | |
| Typ | |
| Podtyp | |
| Gromada | |
| Rząd | szczętki |
Szczętki (l. poj.: szczętka), eufauzje, eufazje (Euphausiacea), popularnie zwane krylem – rząd morskich pancerzowców liczący 86 gatunków[1]. W odróżnieniu od innych skorupiaków szczętki mają skrzela zewnętrzne.
Szczętki występują we wszystkich oceanach świata, gdzie stanowią kluczowe, dolne ogniwo w łańcuchu pokarmowym. Odżywiają się fitoplanktonem oraz w mniejszym stopniu zooplanktonem, same zaś są zjadane przez wiele gatunków większych zwierząt, dla których kryl jest najważniejszym elementem diety, np. fiszbinowców, mant, rekinów wielorybich, krabojadów oraz innych płetwonogich, a także kilku gatunków ptaków morskich[2]. Szacuje się, że w Oceanie Południowym organizmy z gatunku kryla antarktycznego (Euphausia superba) mają biomasę 500 milionów ton – dwa razy więcej niż ogólna biomasa ludzi. Połowa tego zjadana jest corocznie przez wieloryby, płetwonogie, pingwiny, kałamarnice i ryby. W poszukiwaniu pokarmu wiele gatunków szczętek odbywa pionową migrację, stanowiąc w nocy pokarm dla drapieżników żerujących przy powierzchni wody, a w dzień – w głębinach.
Człowiek poławia szczętki w ilości 150–200 tys. ton rocznie. Połowy prowadzi się głównie na wodach Oceanu Południowego i u wybrzeży Japonii. Szczętki wykorzystuje się przeważnie w rolnictwie i gospodarstwach rybackich jako paszę, w wędkarstwie jako przynęty, a także w przemyśle farmaceutycznym. W Rosji i Japonii kryl jest również pokarmem ludzi.
Nazwa „kryl” pochodzi od norweskiego słowa krill oznaczającego „narybek”.
Systematyka
W rzędzie Euphausiacea wyróżnia się dwie rodziny. Rodzina Bentheuphausiidae jest monotypowa, zawiera wyłącznie gatunek Bentheuphausia amblyops żyjący w strefie batialnej na głębokościach poniżej 1000 m p.p.m., uważany za najprymitywniejszy gatunek szczętek[3]. Do kolejnej rodziny Euphausiidae zaliczono 85 gatunków, zgrupowanych w dziesięciu rodzajach, z których najliczniejszym jest rodzaj Euphausia liczący 31 gatunków[1].
Z powodu komercyjnych połowów najlepiej zbadanymi są gatunki: kryl antarktyczny (Euphausia superba), kryl pacyficzny (Euphausia pacifica) oraz kryl północny (Meganyctiphanes norvegica).
Systematyka rzędu Euphausiacea:
- Euphausiidae Dana, 1852
- Euphausia Dana, 1852
- Meganyctiphanes Holt i W. M. Tattersall, 1905
- Nematobrachion Calman, 1905
- Nematoscelis G. O. Sars, 1883
- Nyctiphanes G. O. Sars, 1883
- Pseudeuphausia Hansen, 1910
- Stylocheiron G. O. Sars, 1883
- Tessarabrachion Hansen, 1911
- Thysanoessa Brandt, 1851
- Thysanopoda Latreille, 1831
- Bentheuphausiidae Colosi, 1917
- Bentheuphausia G. O. Sars, 1885
Filogeneza
Do tej pory nie znaleziono kopalnych szczętek, więc mało znana jest ich paleobiologia. Historia specjacji kryla jest znana jedynie z badań wolno ewoluujących jądrowych sekwencji DNA. Porównanie zmian w ich 28S rDNA ze zmianami w 28S rDNA ich bliskich krewnych pancerzowców, których kopalne dowody zachowały się, pozwoliło na określenie dat wyodrębnienia się poszczególnych rodzajów szczętek. Analiza filogenetyczna częściowych sekwencji 28S rDNA euphauzji – stosowana do badania powiązań rodzinnych między gatunkami kryla – wykazała, że ostatni wspólny przodek rodziny Euphasiidae żył we wczesnej kredzie ok. 130 milionów lat temu. Dwie linie rodowe kryla przeżyły wymieranie kredowe (65 milionów lat temu), a nowoczesne gatunki kryla powstały przed końcem paleogenu (23 miliony lat temu)[4].
← mln lat temu Szczętki | ||||||||||||
| ←4,6 mld | 541 | 485 | 443 | 419 | 359 | 299 | 252 | 201 | 145 | 66 | 23 | 2 |
Rozmieszczenie geograficzne
Szczętki występują we wszystkich oceanach świata. Rozmieszczenie większości gatunków obejmuje również wszystkie oceany, niektóre gatunki występują endemicznie albo wykazują występowanie ograniczone do strefy sublitoralu.
Gatunki z rodzaju Thysanoessa występują zarówno w Atlantyku jak i w Oceanie Spokojnym. Wody tego drugiego to także habitat kryla pacyficznego. Kryl północny żyje w północnej części Atlantyku od wysokości Morza Śródziemnego. Cztery gatunki rodzaju Nyctiphanes występują obficie w miejscach prądów podnoszących się oceanicznych wód głębinowych (upwelling) jak: Prąd Kalifornijski, Prąd Peruwiański, Prąd Benguelski i Prąd Kanaryjski, w których człowiek jednocześnie poławia na dużą skalę ryby, mięczaki i skorupiaki.
W Oceanie Południowym otaczającym Antarktydę występuje siedem gatunków kryla: jeden z rodzaju Thysanoessa (T. macrura) i sześć z rodzaju Euphausia[5]. Kryl antarktyczny żyje zwykle na głębokościach do 100 m p.p.m.[6], podczas gdy gatunek Euphausia crystallorophias znaleziono na głębokości 4000 m p.p.m., chociaż normalnie występuje od 300 do 600 m p.p.m.[7]. Oba gatunki są spotykane na południe od 55° S szerokości geograficznej, przy czym E. crystallorophias dominuje na południe od 74° S i w regionach zwartego lodu[8]. Inne znane gatunki występujące w Oceanie Południowym to E. frigida, E. longirostris, E. triacantha oraz E. vallentini[9].
Anatomia i morfologia


Szczętki to skorupiaki mające chitynowy egzoszkielet. Przezroczyste ciało składa się z 21 segmentów, wyraźnie zróżnicowanych na tegmy: głowę, tułów oraz odwłok. Pierwsze dwie tegmy zrośnięte są w głowotułów osłonięty chitynowym karapaksem. U większości gatunków ta zewnętrzna osłona jest przezroczysta. Szczętki mają także skomplikowane oczy złożone, umieszczone na krótkich słupkach. Niektóre gatunki mogą adaptować się do zmiennych warunków świetlnych dzięki pigmentom, których używają jako biologicznego rodzaju rastru[10]. Wyposażone są w parę długich, wieloczłonowych czułków (u stawonogów zwane antenami[11]) oraz kilka par dwugałęziowych odnóży, które dzielą się na odnóża kroczne (pereiopody) oraz odnóża tułowiowe (torakopody). Liczba par jest różna u poszczególnych rodzajów oraz gatunków. W skład torakopodów wchodzą odnóża służące do karmienia i do filtracji pokarmu z wody. U gatunków drapieżnych, druga lub druga i trzecia para są wydłużone i zaopatrzone w szczypce, spełniając rolę narządów chwytnych. Poza tym wszystkie gatunki mają pięć par, zaopatrzonych w długie szczeci, pływnych odnóży (pleopody) bardzo podobnych do pleopodów homara. Większość gatunków dorasta do 1–2 cm długości, zaś kilka może osiągnąć rozmiar 6–12 cm. Największym gatunkiem jest mezopelagiczna szczętka Thysanopoda spinicaudata[12]. Szczętki można z łatwością odróżnić od innych skorupiaków ze względu na ich widoczne z zewnątrz, nitkowate i zwijające się spiralnie skrzela.
Wiele gatunków kryla filtruje pożywienie za pomocą przednich odnóży (torakopody), które tworzą rodzaj bardzo gęstego grzebienia odsączającego pożywienie z wody. Rzęsy filtrów mogą być tak gęste, że niektóre gatunki, jak np. Euphausia spp., mogą odżywiać się głównie fitoplanktonem, a w szczególności jednokomórkowymi algami okrzemkami. Przyjmuje się jednak, że szczętki to głównie organizmy wszystkożerne. Niektóre gatunki są wyłącznie mięsożernymi, polującymi na mały zooplankton i larwy ryb.
Oprócz Bentheuphausia amblyops wszystkie pozostałe szczętki mają zdolność bioluminescencji, dzięki organom zwanym fotoforami mogącym emitować światło o barwie żółtej lub żółtozielonej, w błyskach 1-6-sekundowych[13]. Fotofory występują na częściach podstawowych słupków ocznych albo odnóży tułowiowych oraz na 4 sterniach segmentów tułowia. Światło powstaje w wyniku enzymatycznych reakcji chemiluminescencji, w których pigment lucyferyna jest aktywowana przez enzym lucyferazę. Badania wykazały, że lucyferyny wielu gatunków szczętek to fluorescencyjne tetrapirole, podobne, aczkolwiek nie identyczne, z lucyferynami niektórych bruzdnic[14]. Szczętki prawdopodobnie nie mogą samodzielnie produkować tych substancji, jednak wchłaniają je wraz z bruzdnicami będącymi częścią ich diety[15]. Fotofory szczętek są dość rozwinięte i mogą skupiać światło oraz obracać je w wybranym kierunku za pomocą mięśni[16]. Funkcja tych organów nie jest dokładnie znana, sądzi się, że odgrywają pewną rolę przy kopulacji, warunkują stosunki społeczne, czy też ułatwiają orientację. Niektórzy badacze (m.in.: Lindsay i Latz[17] oraz Johnsen[18]) przypuszczają, że szczętki używają światła jako kamuflażu mającego zredukować ich cień i w ten sposób uczynić niewidocznymi dla drapieżników pływających pod nimi.
Tryb życia
Większość gatunków szczętek to zwierzęta żyjące w ławicach. Ich rozmiary i gęstość różnią się znacznie w zależności od gatunku jak i regionu występowania. W przypadku kryla antarktycznego stwierdzono gęstość ławic w wielkości od 10 000 do 30 000 osobników na metr sześcienny[19]. Pływanie w ławicy jest mechanizmem ochronnym, który irytuje mniejsze drapieżniki koncentrujące się podczas ataku na pojedyncze okazy.
Większe migracje szczętek związane są z prądami morskimi. W ciągu dnia skorupiaki te odbywają zwykle wędrówki wertykalne – spędzają dzień w głębiach i wypływają w wyższe warstwy akwenów podczas nocy. Im głębiej schodzą, tym bardziej zmniejszają swoją aktywność, przypuszczalnie aby ograniczać spotkania z drapieżnikami i oszczędzać siły[20]. Niektóre gatunki (np. kryl antarktyczny, kryl pacyficzny, E. hanseni, Pseudeuphausia latifrons albo Thysanoessa spinifera) tworzą również ławice bezpośrednio pod powierzchnią oceanów za dnia, poszukując pokarmu oraz w celach rozrodczych. To zachowanie naraża je jednak bardziej na ataki drapieżników. Gęste ławice znajdujące się bezpośrednio pod powierzchnią wód, gdzie mają ograniczoną możliwość ucieczki, mogą wywoływać szał jedzenia np. u ptaków czy ryb. Ławice rozpraszają się, gdy są zaniepokojone. Obserwowano jak niektóre osobniki szczętek liniały nagle, zostawiając powłokę egzoszkieletu (exuvia) w celu zmylenia napastnika[21].
Szczętki płyną zwykle z szybkością kilku centymetrów na sekundę (0,2-10 długości ciała na sekundę), używając odnóży pływnych (pleopody) jako napędu. Będąc w niebezpieczeństwie, reagują ucieczką zwaną lobstering – kurcząc i rozkurczając segmenty ogonowe telsona i uropody, szczętki poruszają się do tyłu względnie szybko, osiągając prędkości wahające się od 10 do 27 długości ciała na sekundę, co oznacza w przypadku dużych gatunków (jak np. kryl antarktyczny) około 0,8 m/s[22]. Ze względu na taką zdolność pływania wielu naukowców klasyfikuje dorosłe szczętki jako nekton, czyli organizmy zdolne do poruszania się wbrew (słabym) prądom morskim. Natomiast wszystkie formy larwalne szczętek traktuje się zasadniczo jako zooplankton[23].
Rola w ekosystemie
Szczętki są ważnym ogniwem łańcucha pokarmowego. Częściowo wchodzą w skład gildii filtratorów. Kryl antarktyczny odżywia się fitoplanktonem, przeobrażając energię pierwszego rzędu w formę materii przystępną dla konsumpcji większych zwierząt, które nie mogą odżywiać się bezpośrednio mikroskopijnymi algami. Inne gatunki, jak np. kryl północny, mają stosunkowo drobny system filtrów umożliwiający im aktywne polowanie na widłonogi i większy zooplankton. Z drugiej strony szczętki są pożywieniem wielu gatunków zwierząt. Do nich należą zarówno mniejsze zwierzęta, np. ryby albo ptaki, jak i większe ssaki, np. płetwonogie, a nawet fiszbinowce.
Zaburzenia ekosystemu, które powodują zmiany ilościowe populacji szczętek, mogą mieć poważne konsekwencje (kaskada troficzna). Przykładem może być zjawisko obserwowane w Morzu Beringa w 1998: Podczas zakwitu glonów z rzędu Coccolithophorales z gromady haptofitów w dotkniętych regionach morza spadła koncentracja okrzemek, którymi odżywiają się szczętki[24]. Ponieważ te nie mogą odżywiać się jeszcze mniejszymi Coccolithophorales, ich populacje (głównie kryla pacyficznego) zmniejszyły się drastycznie w tym akwenie. To znów pociągnęło za sobą zmiany ilościowe innych gatunków zwierząt (np. zmniejszyły się populacje burzyków). Możliwe, że spadek liczebności szczętek mógł być przyczyną zmiany tras wędrówek łososi, które nie powróciły w tym sezonie na tarło do rzek zachodniej Alaski[25].
Oprócz drapieżnictwa i doboru pokarmu na stopień śmiertelności szczętek mogą wpływać również inne czynniki. Istnieje kilka jednokomórkowych, endopasożytniczych orzęsków z rodzaju Collinia, które mogą zarazić różne gatunki kryla i spowodować znaczące spadki w dotkniętych populacjach. Takie zarażenia obserwowano u Thysanoessa inermis w Morzu Barentsa, jak i u populacji kryla pacyficznego, Thysanoessa spinifera oraz T. gregaria żyjących wzdłuż północnoamerykańskich wybrzeży Pacyfiku[26]. Istnieją również ektopasożyty z rodziny Dajidae, rzędu równonogów, które atakują szczętki (jak i krewetki oraz lasonogi). Jednym z takich pasożytów jest Oculophryxus bicaulis, którego znaleziono na gatunkach kryla: Stylocheiron affine i S. longicorne. Napastnik przyczepia się do czułek ocznych szczętek i wysysa krew z ich głów. Przyjmuje się, że w ten sposób uniemożliwia rozmnażanie swojego żywiciela, ponieważ żaden z zarażonych osobników nie osiągnął dojrzałości płciowej[27].
Cykl życiowy
Cykl życiowy kryli był tematem kilku badań naukowych (np. Guerny 1942[28] i Mauchline & Fisher 1969[29]), które obejmowały różne gatunki. Jest on więc dosyć dobrze znany, przy czym istnieją małe różnice w cyklach życiowych poszczególnych gatunków.
Szczętki są rozdzielnopłciowe, samice nie opiekują się jajami. Po tym jak szczętka wykluje się z jaja, skorupiak przechodzi kilka faz larwalnych, zwanych: nauplius, pseudometanauplius, metanauplius, calyptopsis i furcilia. Każda z tych faz dzieli się dalej na podfazy. Fazę pseudometanauplius przechodzą wyłącznie gatunki – tak zwane "sac-spawners" (wylęgacze workowe) – które składają jaja w worku jajotwórczym. Larwy rosną i linieją kilka razy podczas rozwoju. Zrzucają wtedy swój sztywny egzoszkielet za każdym razem, gdy ten staje się za mały i wytwarzają nowy. Linienie następuje częściej, gdy larwy są mniejsze, a gdy stają się większe, częstotliwość linienia spada. Podczas fazy metanauplius larwy odżywiają się resztkami żółtka znajdującego się w ich ciele. Dopiero w fazie calyptopsis, w wyniku procesu różnicowania komórkowego, powstają otwór gębowy i układ trawienny, po czym larwy zaczynają się odżywiać fitoplanktonem. Podczas tej fazy larwy muszą dotrzeć do strefy fotycznej wyższych warstw oceanu, w których żyją algi, gdyż ich rezerwy żółtka wyczerpują się. W przebiegu fazy furcilia powstają kolejno segmenty ciała z parami odnóży pławnych (pleopody). Każda z nowo powstałych par funkcjonuje dopiero po kolejnym procesie linienia. Przy tym liczba segmentów z kończynami powstających podczas każdej z podfaz fazy furcilia może się różnić w przypadku tego samego gatunku w zależności od warunków środowiskowych[30]. Po tej ostatniej fazie młody kryl wygląda podobnie do dorosłego osobnika, nie jest jednak jeszcze dojrzały.
Podczas okresu godowego, który odbywa się w różnych porach w zależności od gatunku i klimatu, dochodzi do kopulacji, przy czym samce przystawiają spermatofor do otworu genitalnego (thelycum) samic. Samice mogą nosić do kilku tysięcy jaj w jajnikach. Masa jaj może wynosić do jednej trzeciej masy ciała samicy[31]. Podczas jednego sezonu kryle mogą rozmnażać się kilkakrotnie, przy czym okresy między lęgami można liczyć nawet w dniach.

Istnieją dwa rodzaje mechanizmu rozrodczego:
- 57 gatunków rodzajów Bentheuphausia, Euphausia, Meganyctiphanes, Thysanoessa i Thysanopoda to tak zwane "wylęgacze rozsyłające" (ang. : broadcast spawners) – samica wypuszcza zapłodnione jaja do wody, tam zwykle opadają w niższe warstwy, rozpraszają się i są pozbawione opieki. Potomstwo tych gatunków najczęściej wykluwa się w pierwszej fazie rozwoju larwy nauplius, jednak wyklucia obserwowane były również w późniejszej fazie metanauplius, a nawet w fazie calyptopis[32];
- pozostałe 29 gatunków innych rodzajów to "wylęgacze workowe" (ang. : sac spawners) – samica nosi zapłodnione jaja ze sobą w worku jajotwórczym przy tylnych parach torakopodów aż do momentu wyklucia w fazie larwalnej metanauplii. Niektóre gatunki jak Nematoscelis difficilis mogą jednak wykluwać się podczas fazy nauplius albo pseudometanauplius[33].
Kilka z gatunków szczętek, które występują w wodach polarnych, może żyć ponad sześć lat (np. kryl antarktyczny). Inne, np. kryl pacyficzny, występujący w wodach klimatu umiarkowanego, mogą osiągnąć wiek dwóch lat[23]. Okres życia gatunków występujących w wodach klimatu podrównikowego albo równikowego jest jeszcze krótszy, np. Nyctiphanes simplex żyje zwykle od sześciu do ośmiu miesięcy[33].
Szczętki linieją za każdym razem, gdy wyrosną ze swojego sztywnego egzoszkieletu. Młode okazy, które rosną szybciej, linieją częściej niż starsze i większe zwierzęta. Częstotliwość linienia różni się u poszczególnych gatunków. W zależności od czynników zewnętrznych (szerokość geograficzna, temperatura wody, zasoby pokarmowe) może być różna nawet u tego samego gatunku. Okres między linieniami podtropikalnego gatunku Nyctiphanes simplex waha się ogólnie od dwóch do siedmiu dni – podczas gdy larwy linieją średnio co 4 dni, okazy młode i dorosłe zrzucają egzoszkielet co 6 dni. W wypadku kryla antarktycznego (Ocean Południowy) okresy między linieniami wahają się od 9 do 28 dni w zależności od temperatury wody (od 0 °C do 4 °C). Okresy te trwają u kryla północnego (Morze Północne) również od 9 do 28 dni, jednak przy temperaturach od 2,5 °C do 15 °C[34]. Kryl antarktyczny potrafi także zmniejszyć rozmiar swojego ciała, gdy nastąpi niedobór pokarmu. Również wtedy zwierzę linieje, zrzucając swój za duży egzoszkielet[35]. Podobna umiejętność kurczenia się jest charakterystyczna dla kryla pacyficznego występującego w wodach od klimatu umiarkowanego do polarnego. Jest to adaptacja do wysokich temperatur panujących okresowo w wodach, w których gatunek występuje. Naukowcy tłumaczą tę samą adaptację w przypadku innych gatunków szczętek zamieszkujących umiarkowane akweny[36].
Znaczenie dla człowieka
W Japonii szczętki, poławiane tam co najmniej od XIX w., są pożywieniem dla ludzi (okiami (オキアミ) jap.) oraz karmą dla zwierząt hodowlanych. Globalne połowy na wielką skalę rozpoczęły się na przełomie lat 60. i 70. XX w. Obecnie prowadzi się je w Morzu Szkockim i na wodach antarktycznych oraz u wybrzeży Japonii. Największe połowy w historii prowadziły Japonia oraz ZSRR, zaś po jego rozpadzie Rosja i Ukraina. Szczyt odłowów odnotowano w 1983, kiedy to uzyskano 528 tys. ton kryla tylko z Oceanu Południowego (93% odłowiło ZSRR). W 1993 dwa wydarzenia przyczyniły się do drastycznego zmniejszenia odłowów kryla. Rosja zrezygnowała z połowów oraz wprowadzono znaczące limity uzyskiwania szczętek. Limity wynikały z Konwencji o Ochronie Żywych Zasobów Antarktyki(ang.) (CCAMLR) będącej częścią Traktatu Antarktycznego. W 2007 największe odłowy prowadziła Japonia, za którą znalazły się Korea Południowa, Ukraina i Polska[23]. Obecnie odłowy w wodach antarktycznych kształtują się na poziomie ok. 100 tys. ton rocznie. Są regulowane przez piętnasty paragraf CCAMLR[37]. Prawdopodobnie ograniczenie połowów jest także związane z wysokimi kosztami uzysku, aczkolwiek kwestie polityczne i konieczność legalizacji także odgrywają istotną rolę[38]. Połowy u wybrzeży Japonii kształtują się na poziomie 70 tys. ton[39].
Eksperymentalne połowy na małą skalę prowadzi się także na innych obszarach, m.in. kryla pacyficznego u wybrzeży Kolumbii Brytyjskiej, oraz kryla północnego, Thysanoessa raschii i Thysanoessa inermis w Zatoce Świętego Wawrzyńca. Podczas tych połowów uzyskuje się kilkaset ton szczętek rocznie. Nicol oraz Foster uważają, iż rozpoczęcie połowów na dużą skalę w tych rejonach może spotkać się z oporem ze strony lokalnych rybaków oraz ekologów[39].
Szczętki mają smak słony i bardziej intensywny niż krewetki. Do masowej konsumpcji i przemysłowego przetworzenia muszą być obierane, ponieważ ich egzoszkielet zawiera fluorki, które w dużych ilościach mogą być toksyczne[40]. Nadmierne spożycie okiami może także wywoływać biegunkę. Olej z kryla jest natomiast bogatym źródłem nienasyconych kwasów tłuszczowych typu omega-3, DHA oraz EPA[41].
Zobacz też
Przypisy
- ↑ a b Euphausiacea, [w:] Integrated Taxonomic Information System [online] [dostęp 2008-03-08] (ang.).
- ↑ Encarta Reference Library Premium 2005. Article – "Krill", (en), [16.02.2008].
- ↑ Edward Brinton. The distribution of Pacific euphausiids. „Bulletin of the Scripps Institution of Oceanography”. 8. 2, s. 51-269, 1962 (ang.). [dostęp 2009-01-25].
- ↑ Simon N. Jarman: The evolutionary history of krill inferred from nuclear large subunit rDNA sequence analysis, w: Biological Journal of the Linnean Society, 73 (2) (2001), 199–212 doi:10.1111/j.1095-8312.2001.tb01357.x, [dostęp 15.03.2008], (en).
- ↑ Brueggeman, P.: Euphausia crystallorophias, w: Podwodny przewodnik terenowy na wody u wybrzeży Ross Island & McMurdo Sound, (Antarktyda), (en), [dostęp 16.02.2008].
- ↑ MarineBio.org: Euphausia superba, Krill – MarineBio.org, (en), [dostęp 12.02.2008].
- ↑ Kirkwood, J.A. (1984): A Guide to the Euphausiacea of the Southern Ocean. Australian National Antarctic Research Expedition; Australia Dept of Science and Technology, Antarctic Division.
- ↑ Sala, A.; Azzali, M.; Russo, A. (2002): Krill of the Ross Sea: distribution, abundance and demography of Euphausia superba and Euphausia crystallorophias during the Italian Antarctic Expedition (January-February 2000), w: Scientia Marina, 66(2), ss. 123–133.
- ↑ Hosie, G. W.; Fukuchi, M.; Kawaguchi, S. (2003): Development of the Southern Ocean Continuous Plankton Recorder survey, w: Progress in Oceanography, 58, ss. 263–283.
- ↑ Gaten, T.: Meganyctiphanes norvegica; [dostęp 15.06.2005].
- ↑ anteny, [w:] Encyklopedia PWN [online] [dostęp 2008-02-20].
- ↑ Brinton, E.: Thysanopoda spinicaudata, a new bathypelagic giant euphausiid crustacean, with comparative notes on T. cornuta and T. egregia, w: Journal Washington Academy of Sciences, 43, ss. 408–412; 1953.
- ↑ Czesław Jura: Bezkręgowce : podstawy morfologii funkcjonalnej, systematyki i filogenezy. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 475. ISBN 83-01-14595-1.
- ↑ Shimomura O. The roles of the two highly unstable components F and P involved in the bioluminescence of euphausiid shrimps.. „Journal of bioluminescence and chemiluminescence”. 2 (10). s. 91–101. DOI: 10.1002/bio.1170100205. PMID: 7676855.
- ↑ Dunlap JC., Hastings JW., Shimomura O. Crossreactivity between the light-emitting systems of distantly related organisms: Novel type of light-emitting compound.. „Proceedings of the National Academy of Sciences of the United States of America”. 3 (77), s. 1394–1397, marzec 1980. PMID: 16592787.
- ↑ Herring, P. J.; Widder, E. A.: Bioluminescence in Plankton and Nekton, w: Steele, J. H., Thorpe, S. A.; Turekian, K. K. (eds.): Encyclopedia of Ocean Science, Tom I, ss. 308–317. Academic Press, San Diego, 2001.
- ↑ Lindsay, S. M.; Latz, M. I.: Experimental Evidence for Luminescent Countershading by some Euphausiid Crustaceans, Poster presented at the American Society of Limnology and Oceanography (ASLO) Aquatic Sciences Meeting, Santa Fe, 1999.
- ↑ Johnsen, S.: The Red and the Black: Bioluminescence and the Color of Animals in the Deep Sea, w: Integr. Comp. Biol. 45, ss. 234–246, 2005.
- ↑ Uwe Kils: Der Krill, wie er schwimmt und frisst – neue Einsichten mit neuen Methoden. W: I. Hempel, G. Hempel: Biologie der Polarmeere – Erlebnisse und Ergebnisse. G. Fischer, 1995, s. 201–210. ISBN 3-334-60950-2. (niem.)
- ↑ Jaffe, J.S.; Ohmann, M. D.; De Robertis, A.: Sonar estimates of daytime activity levels of Euphausia pacifica in Saanich Inlet, W: Can. J. Fish. Aquat. Sci., 56, ss. 2000–2010, 1999.
- ↑ Howard, D.: Krill in Cordell Bank National Marine Sanctuary, NOAA, [dostęp 15.06.2005].
- ↑ Kils, U.: Swimming behavior, Swimming Performance and Energy Balance of Antarctic Krill Euphausia superba., w: BIOMASS Scientific Series 3, BIOMASS Research Series, ss. 1–122, 1982.
- ↑ a b c Nicol, S.; Endo, Y.: Krill Fisheries of the World, FAO Fisheries Technical Paper, 367, 1997.
- ↑ Weier, J.: Changing Currents color the Bering Sea a new shade of Blue, NOAA Earth Observatory, 1999. [Dostęp 15.06.2005].
- ↑ Brodeur, R.D.; Kruse, G.H., et al.: Draft Report of the FOCI International Workshop on Recent Conditions in the Bering Sea, ss. 22–26, NOAA, 1998.
- ↑ Gómez-Gutiérrez J., Peterson WT., De Robertis A., Brodeur RD. Mass mortality of krill caused by parasitoid ciliates.. „Science (New York, N.Y.)”. 5631 (301), s. 339, lipiec 2003. DOI: 10.1126/science.1085164. PMID: 12869754.
- ↑ Shields JD., Gómez-Gutiérrez J. Oculophryxus bicaulis, a new genus and species of dajid isopod parasitic on the euphausiid Stylocheiron affine Hansen.. „International journal for parasitology”. 3 (26), s. 261–8, marzec 1996. PMID: 8786215 (ang.).
- ↑ Gurney, R. (1942): Larvae of decapod crustacea, W: Royal Society Publ., 129, Londyn.
- ↑ Mauchline, J.; Fisher, L.R. (1969): The biology of euphausiids, w: Adv. Mar. Biol. 7.
- ↑ Knight, M. D. (1984): Variation in Larval Morphogenesis within the Southern California Bight Population of Euphausia pacifica from Winter through Summer, 1977–1978, w: CalCOFI Report, Vol. XXV.
- ↑ Ross, R. M.; Quetin, L. B. (1986): How Productive are Antarctic Krill? w: Bioscience, 36, ss. 264–269.
- ↑ Gómez-Gutiérrez, J.: Hatching mechanism and delayed hatching of the eggs of three broadcast spawning euphausiid species under laboratory conditions, w: J. of Plankton Research, 24 (12), ss. 1265–1276, 2002.
- ↑ a b E. Brinton, M. D. Ohman, A. W. Townsend, M. D. Knight, A. L. Bridgeman: Euphausiids of the World Ocean (World Biodiversity Database CD-ROM Series). Springer Verlag, 1999. ISBN 3-540-14673-3.
- ↑ Buchholz, F.: Experiments on the physiology of Southern and Northern krill, Euphausia superba and Meganyctiphanes norvegica, with emphasis on moult and growth — a review, w: Marine and Freshwater Behaviour and Physiology, 36, (4), ss. 229–247, 2003.
- ↑ Hyoung-Chul Shin; Nicol, S.: Using the relationship between eye diameter and body length to detect the effects of long-term starvation on Antarctic krill Euphausia superba, w: Mar Ecol Progress Series (MEPS), 239:157–167; 2002.
- ↑ Marinovic, B.; Mangel, M.: Krill can shrink as an ecological adaptation to temporarily unfavourable environments, W: Ecology Letters, 2, ss. 338–343; Blackwell Science, 1999.
- ↑ CCAMLR: Harvested species: Krill (Eupausia superba) (ang.). [dostęp 2008-02-18]. [zarchiwizowane z tego adresu (17 lipca 2005)].
- ↑ Wright, M.: The Ownership of Antarctica, its Living and Mineral Resources, w: J. Law & the Environment (1987).
- ↑ a b Nicol, S.; Foster, J.: Recent trends in the fishery for Antarctic krill, w: Aquat. Living Resour, 16, s. 42–45, 2003, [dostęp 2008-02-20].
- ↑ Haberman, K: Answers to miscellaneous questions about krill, February 26 1997, [dostęp 06.09.2007].
- ↑ Arts, M.T., Ackman R.G., Holub, B.J.: "Essential fatty acids" in aquatic ecosystems: a crucial link between diet and human health and evolution, w: Can. J. Fish. Aquat. Sci., 58(1), s. 122–137, 2001, doi:10.1139/cjfas-58-1-122, [dostęp 2008-02-16].
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Dr. Jaime Gómez-Gutiérrez, Licencja: CC-BY-SA-3.0
The head of female krill of the sac-spawning species Nematoscelis difficilis with her brood sac.
Autor: Dr. Russell R. Hopcroft, Institute of Marine Science, University of Alaska Fairbanks., Licencja: CC-BY-SA-3.0
The gills of krill are externally visible, contrary to those of shrimps. The image shows the gills of a krill of the species Euphausia pacifica.
Autor: Autor nie został podany w rozpoznawalny automatycznie sposób. Założono, że to Aung~commonswiki (w oparciu o szablon praw autorskich)., Licencja: CC-BY-SA-3.0
Picture from commons: Krillanatomykils.jpg. Now with pl text. antarctic krill anatomy graph by uwe kils gfdl modified and translated from Kils & Klages 1979
Translated pl AungAutor: Autor nie został podany w rozpoznawalny automatycznie sposób. Założono, że to Uwe kils (w oparciu o szablon praw autorskich)., Licencja: CC-BY-SA-3.0
bioluminescence antarctic krill - watercolor by User:uwe kils.
NASA SeaWiFS image taken on April 25, 1998, showing the en:coccolithophore en:bloom in the en:Bering Sea. This is not a false-color image: the greenish color is caused by the high concentration of en:phytoplankton. NB Subsequent research suggests that this image, and others from the area showing bright waters early in the year, probably show resedimented particles not an active coccolithophore bloom (Broerse et al. 2003, Continental Shelf Research, 23, 1579-1596).
Autor:
- Krill666.jpg: Uwe Kils I am willing to give the image in 1700 resolution to Wikipedia Uwe Kils
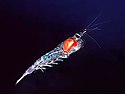
Antarctic krill Euphausia superba. This is the startimage of the virtual microscope http://www.ecoscope.com/cybermic/index.htm of krill where you can click into details of the animal to get higher magnifications, like the gills, the feeding basket or the swimming legs, up to raster electron and transmission electron images, also some videos - there are many links to jumpoff sites for educators, like from the SCIENCE MAGAZINE. In natural hovering position - the red organs produce the bioluminescence - the hepatopancreas is filled with green phytoplankton, the food of krill, the strait gut in the back is filled with the empty shells of phytoplankton - in the front you see the compound eye
Autor: Image by User:Uwe kils, Licencja: CC-BY-SA-3.0
The pleopods (swimming legs, or "swimmerets") of a krill (here a member of Euphausia superba, the Antarctic krill).
Autor: Dr. Jaime Gómez-Gutiérrez, Licencja: CC-BY-SA-3.0
A nauplius of the krill Euphausia pacifica hatching, emerging backwards from the egg.