Szczeżuja chińska
| Sinanodonta woodiana[1] | |||
| (I. Lea, 1834) | |||
 | |||
 Żywe osobniki szczeżui chińskiej w wodach prefektury Kagoshima. | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Gromada | |||
| Podgromada | |||
| Rząd | |||
| Rodzina | |||
| Rodzaj | Sinanodonta | ||
| Gatunek | Szczeżuja chińska | ||
| Synonimy | |||
| |||
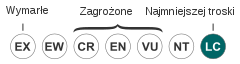
| Kategoria zagrożenia (CKGZ)[2] | |||
 | |||
Szczeżuja chińska (Sinanodonta woodiana (I. Lea, 1834)[3]) – gatunek dużego, wschodnioazjatyckiego, słodkowodnego małża z rodziny skójkowatych. Gatunek inwazyjny – zawlekany z materiałem zarybieniowym rozprzestrzenia się w Azji, Europie i w Ameryce Środkowej. Największy gatunek małża występujący w wodach śródlądowych Europy.
Taksonomia
Gatunek opisany przez I. Lea pod nazwą Symphynota woodiana, epitet gatunkowy honorował osobę, która zebrała i przesłała z Kantonu okazy muszli tego gatunku dla autora gatunku[4]. Obecnie przypisany do rodzaju Sinanodonta. W Polsce znana pod nazwami szczeżuja chińska[5] lub szczeżuja Wooda[6].
Cechy morfologiczne
Muszla w zarysie prawie kolista, skrzydełko bardzo silnie zaznaczone, wierzchołki muszli przesunięte ku przodowi (znajdują się w 1/3 długości muszli). Część środkowa muszli bardzo silnie wybrzuszona. Muszla cienkościenna, krucha, staje się bardziej masywna u starszych osobników. Rzeźba wierzchołków w postaci silnych wybrzuszeń, przypominających rozchodzące się fale. Pierścienie przyrostów dobrze widoczne na powierzchni muszli. Wewnątrz muszla perłowa, może być pokryta nieregularnymi inkrustacjami, czasami występują półperły. Muszle mają zmienne ubarwienie, są koloru od ciemnobrunatnego do oliwkowozielonego. Jest to największy gatunek małża, spośród występujących w wodach śródlądowych Europy. Długość muszli: 80-260 mm; szerokość: do 60 mm; wysokość: do 120 mm; masa: do 1,2 kg (świeża masa z muszlą)[7][5][6].
Występowanie
Gatunek rodzimy dla wód śródlądowych południowo-wschodniej Azji: od dorzecza Amuru do Kambodży, Tajlandii, Tajwanu i Japonii. W związku z importem materiału zarybieniowego z tych rejonów szybko rozprzestrzenia się w Azji, a także na innych kontynentach (w Europie i Ameryce). W Europie introdukowany został po raz pierwszy w latach 60. XX wieku w Rumunii i na Węgrzech. W Polsce stwierdzona po raz pierwszy w latach 80. XX wieku w litoralu jezior konińskich. Zawleczona tam została najprawdopodobniej z narybkiem tołpygi pstrej (Aristichthus nobilis) i białej (Hypophthalamichthys molitrix), sprowadzonym z Węgier. Stamtąd rozprzestrzenia się powoli w Polsce: w 2002 roku stwierdzono jej występowanie w stawie rybnym w okolicach Sierakowa w woj. wielkopolskim, w 2003 roku w kanale wód zrzutowych elektrowni Dolna Odra, w stawach rybnych koło Milicza, w kanale Warta-Gopło oraz w Narwi[7][8][5]. Przewiduje się, że gatunek będzie kontynuował rozprzestrzenianie się w wodach śródlądowych Polski i Europy, choć jego ekspansja może być ograniczona w związku z jego wymaganiami temperaturowymi[8][5].
Biologia i ekologia
Zajmowane siedliska
Gatunek zasiedlający litoral rzek, jezior, zbiorników zaporowych i stawów rybnych. W Polsce występuje głównie w wodach podgrzanych przez zrzuty wody z elektrociepłowni, ale stwierdzono również jego występowanie w zbiornikach o naturalnym reżymie temperaturowym[5]. Preferuje wody płytkie: od 1,5 do 3,5 m[9].
Gatunek ciepłolubny, toleruje temperatury wody w zakresie 10-30ºC[5].
Odżywianie
Filtrator, w skład pokarmu wchodzą glony planktonowe, seston, drobny zooplankton. W ciągu godziny osobnik może przefiltrować ok. 1-2 litry wody[5].
Rozmnażanie
Brak dymorfizmu płciowego. Dojrzałość płciowa osiągana przy wymiarach muszli 30-40 mm. Rozwój złożony z larwą pasożytującą na skrzelach lub płetwach ryb karpiowatych – larwy nie wykazują specyficzności gatunkowej w stosunku do żywiciela. W zależności od temperatury rozwój glochidium trwa od 5 do 14 dni. Osobniki młodociane cechuje szybkie tempo wzrostu – wielkość 100 mm osiągają po 2-4 latach[5].
Drapieżnictwo
Małż może stanowić dodatkowe źródło pożywienia dla wielu gatunków zwierząt, zwłaszcza gdy występuje w stawach rybnych. Są to między innymi: ostrygojad (Haematopus ostralegus) podczas wędrówki jesiennej, bielik (Haliaeetus albicilla), dzik (Sus scrofa). Ponadto zostało potwierdzone żerowanie wydry (Lutra Lutra) na tych szczeżujach[10].
Znaczenie dla ekosystemu
Glochidia pasożytują na skrzelach ryb karpiowatych, na obszarach naturalnego zasięgu występowania głównie na Sinocyclocheilus grahami. Zagrożeniem dla lokalnych ryb mogą być glochidia, produkowane przez osobniki tego gatunku w dużych ilościach praktycznie przez cały sezon wegetacyjny, oraz przenoszone patogeny[5].
Stwierdzono, że małż jest bardziej odporny na zanieczyszczenia wód oraz lepiej znosi niekorzystne warunki środowiska niż gatunki rodzime, co może skutkować wypieraniem ich z danych obszarów[5].
Należy też zwrócić uwagę na ostatnie doniesienia o negatywnym wpływie na rozród różanki (Rhodeus amarus). S. woodiana w przeciwieństwie do rodzimych gatunków Unionidae pozbywa się ikry, którą ryba składa do wnętrza jamy płaszczowej uniemożliwiając tym samym rozwój narybku[10].
Ponadto, przez swoją dużą biomasę, S. woodiana odgrywa ważną rolę w procesie powstawania materii organicznej. Wpływa to pozytywnie na liczebność i skład organizmów dennych, między innymi skąposzczetów, skorupiaków obunogich, larw ochotkowatych czy chruścików. Tworzy dogodne warunki dla racicznicy zmiennej, która osadza się na muszlach[11].
Zagrożenia i ochrona
Nie jest zagrożony – w IUCN ma status gatunku mniejszej troski (LC)[12].
Zobacz też
Przypisy
- ↑ Sinanodonta woodiana, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ Sinanodonta woodiana, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Sinanodonta woodiana (I. Lea, 1834). WoRMS - World Register of Marine Species. [dostęp 2017-06-29]. (ang.).
- ↑ Isaac Lea. Observations on the naiades; and descriptions of new species of that, and other families. „Trans. Amer. Philosop. Soc.”. 5, s. 42, fig. 13, 1834.
- ↑ a b c d e f g h i j Maria Urbańska, Tadeusz Mizera. Szczeżuja chińska Sinanodonta woodiana (Lea, 1834) – jak ją rozpoznać?. „Przegląd Zoologiczny”. XX (1-2), s. 51-58, 2009.
- ↑ a b Rafał Wąsowski: Muszle: przewodnik. Warszawa: MULTICO, 2000, s. 325. ISBN 83-7073-250-X.
- ↑ a b Andrzej Kołodziejczyk, Paweł Koperski: Bezkręgowce słodkowodne Polski: klucz do oznaczania oraz podstawy biologii i ekologii makrofauny. Warszawa: Wydawnictwa Uniwersytetu Warszawskiego, 2000, s. 213, 215. ISBN 83-235-0192-0.
- ↑ a b Andrzej Kraszewski. The continuing expansion of Sinanodonta woodiana (Lea, 1834) (Bivalvia: Unionidae) in Poland and Europe. „Folia Malacologica”. 15 (2), s. 65-69, 2007. ISSN 1506-7629.
- ↑ Andrzej Kraszewski, Bogdan Zdanowski. The distribution and abundance of the chinese mussel Anodonta woodiana (Lea, 1834) in the heated Konin lakes. „Archives of Polish Fisheries”. 9 (2), s. 253-265, 2001.
- ↑ a b W. Andrzejewski, M.Urbańska, H. Gierszal, Szczeżuja chińska w stawach sąsiadujących z lasami., „Studia i Materiały Centrum Edukacji Przyrodniczo-Leśnej, 14 (33/34).”, 2012.
- ↑ A. Stańczykowska-Piotrowska, K. Lewandowski, A. Kołodziejczyk, Wpływ wybranych gatunków małży na różnorodność biologiczną ekosystemów wodnych, 2010.
- ↑ K. Cummings, Sinanodonta woodiana, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2015-05-05] (ang.).
Linki zewnętrzne
- Sinanodonta woodiana w AnimalBase Uniwersytet w Getyndze; dostęp: 5 maja 2015.
- Gatunki obce w faunie Polski: Sinanodonta woodiana Andrzej Kraszewski i Bogusław Zdanowski, Instytut Ochrony Przyrody PAN, Kraków, Red: Zbigniew Głowaciński; dostęp: 5 maja 2015.
Media użyte na tej stronie
Autor: Hirase, Licencja: CC BY-SA 3.0
ドブガイ(Sinanodonta woodiana)。淡水に生息するイシガイ科の二枚貝。鹿児島県の藺牟田池での写真。


