Tyreoidektomia

Tyreoidektomia, tyroidektomia (łac. thyreoidectomia) – operacyjne usunięcie całej tarczycy. Stosowane w leczeniu raka tarczycy oraz niezłośliwego wola. Operację przeprowadza się w znieczuleniu ogólnym. Do powikłań tyreoidektomii należą w szczególności: krwawienie, uszkodzenie nerwu krtaniowego wstecznego i usunięcie przytarczyc. Wycięcie płata, hemityreoidektomia (łac. lobectomia, hemithyreoidectomia) polega na wycięciu płata tarczycy i węziny[1]. Częściowe usunięcie tarczycy z pozostawieniem aktywnych fragmentów gruczołu to strumektomia. Pierwszą tyroidektomię przeprowadził w 1880 r. frankfurcki chirurg Ludwig Rehn.
Wskazania

Głównym wskazaniem do operacji jest wole złośliwe. Po stwierdzeniu raka tarczycy, bądź w przypadku jego podejrzenia, operacja powinna być przeprowadzona jak najszybciej. Jeżeli dodatkowo występuje nadczynność tarczycy (hipertyreoza), należy doprowadzić do normalizacji stężeń hormonów we krwi przy pomocy leków. W przeciwnym razie w trakcie operacji może dojść do przełomu tyreotoksycznego.
Tyreoidektomię stosuje się ponadto w leczeniu woli łagodnych – rozlanych lub guzkowatych – jeżeli częściowe usunięcie tarczycy wiązałoby się z pozostawieniem zmienionej chorobowo tkanki. W takim przypadku często przeprowadza się hemityreoidektomię oraz wycięta zostaje część drugiego płata tarczycy (operacja Dunhilla).
Wskazania szczegółowe
Wskazania szczegółowe do[1]:
- częściowego lub subtotalnego wycięcia tarczycy:
- wole guzowate (nadczynne i obojętne)
- wole miąższowe (nadczynne i obojętne)
- zapalenia tarczycy (np. w przebiegu choroby Hashimoto)
- wycięcia płata tarczycy:
- guz pęcherzykowy w jednym z płatów, jeśli drugi nie jest zmieniony
- całkowitego wycięcia tarczycy:
- rak tarczycy
- prawie całkowitego wycięcia tarczycy:
- rozległe zmiany miąższu w przebiegu wola guzowatego
Badania przed zabiegiem
W skład badań ogólnych, poprzedzających każdą operację, wchodzi pomiar ciśnienia tętniczego i tętna, badanie rentgenowskie klatki piersiowej oraz EKG. Wykonuje się również morfologię krwi i badanie krwi pod względem stężenia elektrolitów oraz wskaźniki krzepnięcie krwi, funkcji nerek i poziomu CRP (w celu wykluczenia stanu zapalnego).
Specyficzne badania poprzedzające operację wycięcia wola obejmują: oznaczenie poziomu hormonów tarczycy we krwi oraz ocena ruchomości strun głosowych przez lekarza laryngologa.
Przebieg operacji
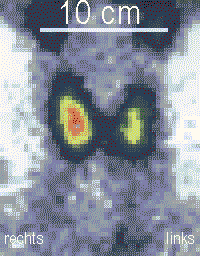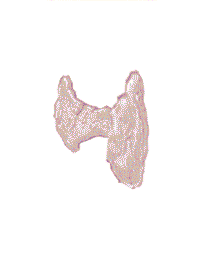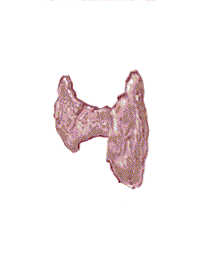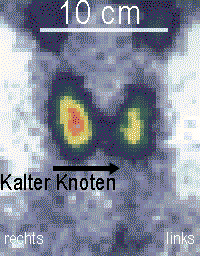
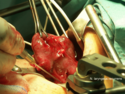
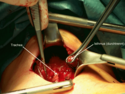
Po odsłonięciu przedniej powierzchni tarczycy, węzinę przymocowuje się do przedniej części tchawicy, przecina, a na jej końce zakłada specjalne, hamujące krwawienie zaciski. Następnie stopniowo oddziela się płaty tarczycy od otaczających tkanek i przecina związane z nimi naczynia krwionośne (tętnica tarczowa górna, tętnica tarczowa dolna oraz towarzyszące im żyły). W kolejnym kroku – zwracając szczególną uwagę na nerw krtaniowy wsteczny, do identyfikacji którego najczęściej stosuje się neuromonitoring, oraz na przytarczyce – przecina się tkankę łączną pomiędzy tarczycą i tchawicą a następnie usuwa płaty tarczycy.
Znieczulenie
Standardem przy tyreoidektomii jest stosowanie znieczulenia ogólnego. Na początku lat 70. XX wieku operacja ta była przeprowadzana także z zastosowaniem znieczulenia miejscowego; obawiano się bowiem zatoru powietrznego, który może powstać w przypadku niezauważonego uszkodzenia dużej żyły, a któremu przytomny pacjent może przeciwdziałać. Zagrożenie to zostało wyeliminowane dzięki zastosowaniu nowoczesnej nadciśnieniowej aparatury do oddychania (PEEP).
Ułożenie pacjenta podczas operacji
Podczas operacji pacjent ułożony jest z lekko uniesionym tułowiem (ok. 30º). Głowa jest odchylona do tyłu i ułożona w specjalnym wgłębieniu, tak by szyja była naprężona, a dostęp do tarczycy ułatwiony.
Sposób nacięcia
Standardem jest cięcie kołnierzowe Kochera, czyli poprzeczne, łukowate nacięcie o długości 5–7 cm, prowadzone na wysokości około dwóch grubości palca ponad wcięciem szyjnym mostka. Linię nacięcia zaznacza się na przytomnym jeszcze pacjencie i ze względów kosmetycznych – o ile jest to możliwe – ukrywa się w fałdzie skórnym. Skóra i podskórna tkanka tłuszczowa zostają przecięte i odsunięte od mięśni. Podłużne mięśnie szyi odsuwa się na bok, tak aby ułatwić dostęp do tarczycy. Czasem, w przypadku bardzo powiększonej tarczycy, konieczne jest poprzeczne nacięcie krótkich mięśni podłużnych szyi. W wyjątkowych przypadkach udaje się usunąć tarczycę z wolem zamostkowym, przeprowadzając częściową sternotomię.
Rozszerzenie zabiegu
Jeżeli przed lub w czasie operacji stwierdzono przerzuty nowotworowe do węzłów chłonnych, przeprowadza się radykalną tyreoidektomię oraz operację Jawdyńskiego-Crile’a[2], która polega na usunięciu pięciu grup węzłów chłonnych oraz niektórych struktur anatomicznych szyi, przy czym cięcie kołnierzowe Kochera zostaje rozszerzone (przeprowadza się podłużne cięcie na środku szyi aż do podbródka, które dalej prowadzi się poprzecznie w obydwie strony, w taki sposób, że przypomina ono otwarte drzwi.
Zamykanie rany

Przed zaszyciem rany stosuje się drenaż Redona w celu odprowadzenia krwi i wydzielin. Zamykanie rany następuje w trzech etapach: mięśnie i tkankę podskórną zszywa się samorozpuszczalną nicią chirurgiczną, skórę zszywa się syntetycznymi nićmi jednowłóknowymi. Ze względów kosmetycznych często zakłada się szew śródskórny. Jako alternatywę stosuje się stripy (plastry) lub kleje tkankowe.
Powikłania
Powikłania niespecyficzne
Krwawienia podczas operacji (śródoperacyjne) lub po przeprowadzonej operacji (pooperacyjne) mogą być niebezpiecznie intensywne, ponieważ tarczyca jest bardzo dobrze ukrwiona. W przypadku przewidywanych trudności (nawrót wola) przygotowuje się wcześniej jednostki krwi.
Infekcje i stany zapalne rany występują bardzo rzadko ze względu na dobre ukrwienie, dają się łatwo rozpoznać i nie sprawiają trudności w leczeniu. Mogą prowadzić jednak do powstania szpecących blizn. Ponieważ pacjent szybko odzyskuje zdolność ruchową, rzadko dochodzi do zakrzepicy i zatorowości płucnej.
Powikłania specyficzne

Przecięcie nerwu krtaniowego wstecznego prowadzi do trwałego paraliżu mięśnia głosowego (porażenie nerwu krtaniowego wstecznego) i utrzymującej się chrypki. Powikłanie to występuje po mniej niż 1% operacji tarczycy[1][3].
Uszkodzenie nerwu poprzez zmiażdżenie lub naciągnięcie prowadzi m.in. również do tymczasowego paraliżu, który jest jednak odwracalny i ustępuje samoczynnie, bez konieczności stosowania dodatkowego leczenia. Obustronne porażenie nerwu krtaniowego wstecznego może prowadzić – poprzez zamknięcie szpary głośni wskutek braku napięcia mięśnia głosowego – do całkowitego przesunięcia tchawicy, grożąc uduszeniem. Stanowi to wskazanie do ewentualnej stałej tracheotomii. Z tego powodu dokładne zidentyfikowanie nerwu krtaniowego wstecznego jest wytyczną medyczną, a w jego przeprowadzeniu bardzo pomocny jest neuromonitoring. Bardzo rzadko (ze względu na technikę operacji łatwiej można tego uniknąć) uszkodzeniu ulega nerw krtaniowy górny.
Niezamierzone usunięcie lub uszkodzenie przytarczyc (łac. glandulae parathyroideae), które w wielu przypadkach trudno zidentyfikować, prowadzi do zaburzenia gospodarki wapniowej w surowicy krwi (hipokalcemii, która występuje w 5% przypadków i w ciągu 12 miesięcy ustępuje w 80%[4][5]) i związanej z nim tężyczki, którą z reguły łatwo leczyć, podając wapń (w dawce 1,5–3,0 g/d[5]) i witaminę D[1]. Trwała niedoczynność przytarczyc występuje po mniej niż 1–2%[3] operacji tarczycy, a niedoczynność przejściowa po 1–5%[1]. Usunięte lub pozbawione ukrwienia przytarczyce można retransplantować – rozdrobnione zaszywa się w mięśniu. Jeżeli przewiduje się konieczność naświetlań, np. w przypadku anaplastycznego guza tarczycy, możliwe jest także profilaktyczne wycięcie przytarczyc i ich retransplantacja w miejsce oddalone od obszaru naświetlanego (np. do mięśnia przedramienia).
Ryzyko poważnych powikłań w przypadku guza tarczycy zależne jest przede wszystkim od jego położenia i wielkości, w związku z czym niemożliwe jest opisanie go za pomocą wiarygodnych statystyk.
Kontrola i pielęgnacja pooperacyjna
Ruchliwość wiązadeł głosowych sprawdza się laryngoskopem bezpośrednio przy wybudzeniu z narkozy, albo przez zbadanie fonacji (w tym wypadku pacjentowi każe się mówić), w celu natychmiastowego rozpoznania porażenia nerwu krtaniowego. W przypadku jego wystąpienia należy uważnie obserwować oddech pacjenta.
W ciągu 24 godzin po operacji oznacza się poziom wapnia we krwi[5]. Jego niski poziom wskazuje na niedoczynność przytarczyc i w razie potrzeby trzeba podawać go pacjentowi.
W niejasnych przypadkach do odróżnienia krwiaka od zwykłego pooperacyjnego obrzęku służy ultrasonografia.
Pacjent, u którego nie wystąpiły żadne powikłania, może już wieczorem po operacji wstać z łóżka i przyjmować płyny. Następnego dnia po operacji może normalnie jeść, a jego mobilność nie jest ograniczona. Zazwyczaj nie trzeba podawać pacjentowi dużych ilości leków przeciwbólowych. Tylko w przypadkach, w których z powodu wielkości wola mięśnie szyi musiały zostać przecięte w poprzek, przez 10 do 15 dni po operacji odradza się gwałtownych ruchów głowy.
Po tyreoidektomii połączonej z operacją Jawdyńskiego-Crile’a problemy z ruchomością i nasilenie bólu zależą od ilości wyciętych węzłów chłonnych i, co za tym idzie, ubytków w mięśniach, tkance łącznej i naczyniach krwionośnych. W tej sytuacji konieczne może być dłuższe podtrzymanie mięśni szyi, np. przy pomocy kołnierza ortopedycznego.
Usunięcie drenów następuje drugiego, opuszczenie szpitala najwcześniej trzeciego, a zazwyczaj czwartego lub piątego dnia po operacji. Szwy usuwa się po tygodniu. Powstała blizna jest widoczna przez pierwsze osiem do dwunastu tygodni, i dopiero po tym czasie przyjmuje ona swoją właściwą szerokość i barwę. W idealnym przypadku udaje się otrzymać tylko delikatną, ledwie zauważalną kreskę na skórze. Rozmiar powstałej blizny jest jednak u każdego pacjenta inny. Po operacji Jawdyńskiego-Crile’a z zastosowaniem rozszerzonego cięcia Kochera powstała blizna jest większa.
Kontrola pooperacyjna polega na regularnym sprawdzaniu poziomu TSH. Poza przypadkiem, gdy rak tarczycy został całkowicie usunięty, regularnie przeprowadza się terapię radiojodem (RJT), czyli radioaktywnym jodem-131[6]. W ramach tej terapii wykonuje się scyntygrafię, która informuje o kompletności tyreoidektomii i pokazuje ewentualnie niewykryte przerzuty nowotworowe do węzłów chłonnych. Terapia radiojodem jest niezawodna w zwalczaniu małych pozostałości guza albo przerzutów nowotworowych do węzłów chłonnych, prowadzi do farmakologicznej, radioizotopowej resekcji[7]. Nie działa ona jednak na guzy niegromadzące jodu, np. rak anaplastyczny albo rdzeniasty tarczycy. Sukces terapii radiojodem dokumentuje się trzy miesiące później przez wykonanie kolejnej scyntygrafii.
Kontrole USG z początku wykonuje się często (co trzy miesiące), natomiast kontrole scyntygraficzne co rok.
Zaburzenia w funkcjonowaniu organizmu spowodowane usunięciem tarczycy wyrównuje się, stosując hormonalną terapię zastępczą, podając doustnie tyroksynę (T4). Dawkę ustala się określając wartość TSH w organizmie, która w przypadku raka tarczycy powinna wynosić między 0,05 a 0,1 mU/l. W przypadku łagodnych zachorowań zaleca się utrzymanie poziomu TSH wynoszącego od 0,4 do 0,9 mU/I przy dawce początkowej 1 μg tyroksyny na każdy kilogram wagi pacjenta[8].
Historia
Pierwszą opisaną operację wycięcia tarczycy przeprowadził w 1791 roku francuski chirurg Pierre Joseph Desault[9].
Tyreoidektomia – wtedy nazywana jeszcze strumektomią – została przeprowadzona w roku 1876 przez szwajcarskiego chirurga i zarazem noblistę (1909) Emila Theodora Kochera, jako całkowita ekstyrpacja wola (w obecnej terminologii tyreoidektomia), a w roku 1878 ukazała się jego praca pod tytułem Exstirpation einer Struma retrooesophagea[10]. W ciągu następnych dziesięciu lat Kocher w poważnym stopniu przyczynił się do poprawienia techniki operacji, co spowodowało znaczne zmniejszenie śmiertelności. W roku 1883 ogłosił on, że ekstyrpacja całkowita może prowadzić do stanu podobnego do kretynizmu. Można by temu zapobiec, jeśli w ciele pacjenta pozostałaby resztka tkanki tarczycy. Zarówno cięcie kołnierzowe Kochera, jak i kleszcze Kochera, które stosuje się do dziś, zostały nazwane jego nazwiskiem[11].
Pierwsza operacja wycięcia tarczycy w Niemczech została przeprowadzona w 1884 roku przez Ludwiga Rehna na pacjencie z nadczynnością tarczycy[12].
Zobacz też
Przypisy
- ↑ a b c d e Wojciech Noszczyk: Chirurgia. Warszawa: Wydawnictwo Lekarskie PZWL, 2005, s. 447–9. ISBN 83-200-3120-6.
- ↑ Jürgen Witte: Radikalitätsprinzipien in der Chirurgie differenzierter Schilddrüsenkarzinome unter Berücksichtigung prognoserelevanter Parameter. Praca habilitacyjna. Düsseldorf: 2003. [dostęp 2010-01-10]. (niem.).
- ↑ a b Veyseller B, Aksoy F, Demirhan H, Yıldırım YS, Ertaş B, Açıkalın RM, Kumral TL, Bayraktar GI. Total thyroidectomy in benign thyroid diseases. „Kulak Burun Bogaz Ihtis Derg”. 19 (6), s. 299–303, listopad-grudzień 2009. PMID: 20030598. (ang. • tur.).
- ↑ Ernest L. Mazzaferri, Richard T. Kloos. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer. „J Clin Endocrinol Metab”. 86 (4), s. 1447–63, kwiecień 2001. PMID: 11297567. (ang.).
- ↑ a b c 36 – Thyroid. W: David C. Sabiston, Courtney M. Townsend: Sabiston textbook of surgery: the biological basis of modern surgical practice. Philadelphia: Saunders/Elsevier, 2008. ISBN 978-0-8089-2401-2.
- ↑ Terapia radiojodem. V Wojskowy Szpital Kliniczny – Zakład Medycyny Nuklearnej. [dostęp 2010-01-10]. [zarchiwizowane z tego adresu (2010-12-22)].
- ↑ Tomasz Stawski: Nadczynność tarczycy a operacja. eChirurgia.pl. [dostęp 2010-01-10].
- ↑ U. Scharlau, H. Steffen, K. Hermann. Die benigne Knotenstruma – aktuelle Behandlungsstrategien aus chirurgischer Sicht. „Ärzteblatt Mecklenburg-Vorpommern”. 7, 2008. [dostęp 2010-01-10]. (niem.).
- ↑ Joseph DuBose, Richard Barnett, Timothy Ragsdale. Honest and sensible surgeons: the history of thyroid surgery. „Curr Surg”. 61 (2), s. 213–9, marzec-kwiecień 2004. DOI: 10.1016/j.cursur.2003.07.021. PMID: 15051267. (ang.).
- ↑ Die Chronik der Medizin. H. Schott, I. W. Müller i wsp.. Dortmund: Chronik Verlag, 1993, s. 314. ISBN 3-611-00273-9.
- ↑ Emil Theodor Kocher, [w:] Encyclopædia Britannica [online] [dostęp 2010-01-10] (ang.).
- ↑ Jochen Glamsch: Intraoperatives Neuromonitoring des Nervus laryngeus recurrens mit Hilfe des Neurosign® 100 bei Operationen an der Schilddrüse. Dysertacja. Würzburg: sierpień 2002. [dostęp 2010-01-10]. (niem.).
Bibliografia
- H.-D. Röher: Chirurgie der Schilddrüse. W: Chirurgie Kopf und Hals. H. D. Röher, B. Breitner (red.). Wyd. 2. T. 1: Chirurgische Operationslehre. Verlag Urban & Schwarzenberg München – Wien – Baltimore, 1990. ISBN 3-541-14412-2.
- V. Bay, P. Matthaes: Schilddrüse. W: Spezielle Chirurgie für die Praxis. F. Baumgartl, K. Kremer, H. W. Schreiber (red.). T. 1. Georg Thieme Verlag Stuttgart, 1973, s. 482. ISBN 3-13-445301-0.
- Frank Bauer: Der Einfluß der Ligatur der Arteria thyreoidea inferior auf die Komplikationsraten bei der Chirurgie der benignen Struma. Halle/Wittenberg: 2002. [dostęp 2010-01-10]. (niem.).
Linki zewnętrzne
- Strumektomia. eChirurgia.pl.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Redlinux, Licencja: CC BY 3.0
Schematisierte Darstellung eines kalten Knotens am linken Unterpol
Variante della tiroide con un lobo piramidale che emerge dal centro della tiroide.
Autor: Drahreg01, Licencja: CC BY-SA 4.0
Szintigramm der Schilddrüse nach Hemithyreoidektomie links
Autor: THWZ, Licencja: CC BY-SA 3.0
Strumaresektion; N.laryngeus recurrens komplett dargestellt
Autor: THWZ, Licencja: CC BY-SA 3.0
Mögliche Schnittführungen für Strumaresektion