Wirus Zika
 model wirusa Zika | |
| Systematyka | |
| Grupa | Grupa IV ((+)ssRNA) |
|---|---|
| Rodzina | |
| Rodzaj | |
| Cechy wiralne | |
| Kwas nukleinowy | RNA |
| Liczba nici | jedna |
Wirus Zika, ZIKV, ZIKAV (ang. Zika virus) – wirus RNA z rodzaju Flavivirus, z rodziny Flaviviridae[1]. Przenoszony przez komary. Pochodzi z Afryki, jednak rozprzestrzenił się w Azji, Ameryce, Europie. Infekcja zazwyczaj cechuje się przebiegiem bezobjawowym lub samoograniczającym. Niekiedy występują objawy grypopodobne, wysypka. Zakażenie w ciąży może wiązać się z małogłowiem. Leczenie zazwyczaj przebiega w warunkach ambulatoryjnych. Nie istnieje leczenie przyczynowe.
Budowa
ZIKV należy do wirusów RNA. Jego materiał genetyczny obejmuje 10794 reszty nukleotydowe[2] położone na nici kodującej[3]. Po raz pierwszy zsekwencjonowali go w 2007 Kuno i Chang[4]. Występuje pojedyncza ramka odczytu, na końcach 5' i 3' leżą nieulegające translacji regiony flankujące[3]. Region 5' zawiera 106 reszt nukleotydowych, natomiast region 3' obejmuje 428 reszt nukleotydowych[4].
Materiał genetyczny koduje 3419 reszt aminoacylowych[2]. Translacja prowadzi do powstania łańcucha poliproteinowego, z którego wycinane są następnie trzy białka strukturalne. Białko C bierze swą nazwę od kapsydu wirionu (capsid), prM jest białkiem błonowym (premembrane/membrane), E czerpie nazwę od osłonki (envelope)[3]. Liczą sobie one odpowiednio 122, 178 i 500 reszt aminoacylowych[4]. Oprócz nich powstaje 7 białek niestrukturalnych[3]. Oznacza się je NS1 (342 reszty aminokwasowe), NS2A (226 aa), NS2B (130 aa), NS3 (617 aa), NS4A (127 aa), 2K (23 aa), NS4B (252 aa) i NS5 (902 aa)[4]. To ostatnie posłużyło badaczom do wyróżnienia różnych linii wirusa[3].
W obrębie tych białek, jednak nie w domenach hydrofobowych, znajdują się miejsca ich glikozylacji. Uwagę badaczy zwrócił również konserwatywny wzór 12 reszt cysteinylu w białkach E i NS1, jak też domena pr w białku prM zawierająca 6 reszt cysteinylowych. W białku E występuje motyw RGD związany z przyleganiem do komórek gospodarza. Konserwatywne motywy znaleziono również w białkach niestrukturalnych 3 i 5[4].
Trwałość
Wirus ten ulega zniszczeniu po 15 min w temperaturze 60 °C lub po 2 h w 0,5% roztworze nadmanganianu potasu, natomiast zachowuje aktywność po 24 h w 10% etanolu lub 0,5% fenolu. Jest odporny na kilkugodzinne przebywanie w nasyconym (tj. ok. 6–7%) roztworze eteru, natomiast ginie po 24 h w takim środowisku[5].
Systematyka
Wirus Zika zaliczany jest do rodziny flawiwirusów, a w jej obrębie do rodzaju Flavivirus[1]. Wśród wirusów tego rodzaju wirus Zika należy do serokompleksu Spondweni[3].
Lanciotti i współpracownicy w 2008 przedstawili następujący kladogram obrazujący pokrewieństwa w obrębie rodzaju Flavivirus na podstawie sekwencji kodującej niestrukturalne białko 5. Widać na nim odrębny klad tworzony przez ZIKV, którego grupę siostrzaną stanowi SPOV. W obrębie tego kladu wyróżniono podklady związane z zasięgiem geograficznym. Wirus z Senegalu reprezentuje linię zachodnioafrykańską, a prototypowy szczep z Ugandy – linię z Afryki Wschodniej. W Azji Południowo-Wschodniej rozprzestrzenił się zaś inny szczep, wyizolowany podczas epidemii w 2007[1]:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lanciotti i in. zwrócili uwagę na 12 par zasad w genie kodującym białko osłonki (ang. envelope protein) szczepu z 2007, które nie występowały u szczepu z Ugandy, jako że wiążą się one z motywem glikozylacji, a przez to z wirulencją. Motyw ten był tracony przez niektóre wirusy z rodzaju Flavivirus. Nie można wykluczyć, że szczep z Ugandy utraci go podczas pasażowania na mózgach mysich, podobnie jak to się stało w przypadku wirusa Zachodniego Nilu[1].
Haddow i współpracownicy przeprowadzili natomiast opisane w 2012 badania genetyczne, dzięki który porównali różne linie wirusa, co zobrazowano kladogramem (wirus Spondweni stanowi grupę zewnętrzną)[3]:
| |||||||||||||||||||
wirus Spondweni | |||||||||||||||||||
W badaniu wyraźnie zaznaczył się podział na szczepy afrykańskie i azjatyckie. Różnią je między innymi pewne delecje zmieniające miejsca glikozylacji białka E. Jednakże zmiany te wynikać też mogą z pasażowania. Zgodnie z tymi badaniami szczep odpowiedzialny za epidemię na Yap powstał w Azji Południowo-Wschodniej. Natomiast szczep z Kambodży, nieznany przed 2010, wyodrębnił się niedawno od szczepu malezyjskiego, którego przodek rozprzestrzeniał się w Azji Południowo-Wschodniej w połowie pierwszej dekady XX wieku[3].
Kutsuna et al również zbadali pokrewieństwa pomiędzy różnymi szczepami wirusa Zika (wirus Spondweni także w tym badaniu pełni rolę grupy zewnętrznej). Ich wyniki zobrazowano następującym kladogramem[6]:
| |||||||||||||||||||||||||
wirus Spondweni | |||||||||||||||||||||||||
Rozmieszczenie geograficzne i historia
ZIKV znany był początkowo z Afryki oraz Azji Południowo-Wschodniej[1]. Po raz pierwszy został wyizolowany w Ugandzie w 1947 z małpy z gatunku makak królewski podczas badań żółtej gorączki prowadzonych w lesie Zika[1] (w okolicy Entebbe[7]), na obszarze występowania komara Aedes africanus[1]. Zwierzę uczestniczące w programie badań gorączki żółtej Fundacji Rockefellera, nazwane Rhesus 766[2], cierpiało na gorączkę[1], która rozwinęła się 18 kwietnia 1947. Dwa dni później w laboratorium surowicą jego krwi inokulowano domózgowo myszy. W badaniach wzięły udział albinotyczne myszy szczepu Swiss[5]. Objawy pojawiały się zazwyczaj po 6 dniach[5], rozwinęły się u wszystkich gryzoni po 10 dniach[2]. Myszy prezentowały mniejszą aktywność, ich futro było bardziej szorstkie. Wszystkie zarażone gryzonie padały podczas 17 pierwszych pasażowań. Dopiero przy 18. pasażowaniu jeden z nich przeżył. Średni czas przeżycia zwierząt w następnych 4 pasażowaniach określono na 10,6 dnia, później spadł on do 5 dni. Po 60 pasażowaniach okres inkubacji spadł do 5 dni, a jeszcze później do 4, utrzymując się odtąd na stałym poziomie (przeprowadzono 157 pasażowań do czasu oddania publikacji). W miarę pasażowania pojawiały się też u myszy nowe objawy, jak słabość kończyn aż do paraliżu, śmiertelnego w skutkach (śmierć następowała po nim w 24–48 godzin). Jednakże niektóre myszy po 1–2 tygodniach choroby zdrowiały, także te z osłabieniem siły mięśniowej kończyn[5]. Podobne były wyniki analogicznych badań ze szczepem E/1 wirusa, choć okres inkubacji szybciej zmierzał ku 4 dniom. Ponadto zaobserwowano jeszcze zwiększającą się z wiekiem myszy podatność[5].
Z mózgów myszy udało się wyizolować wirusa[2], poza tymi, które wyzdrowiały. Sekcja zwłok wykazała także brak zajęcia przez niego innych narządów poza mózgiem. Badania Dicka wykazały również brak wykrywalnej wiremii[5]. Nie udało się natomiast zarazić ZIKV bawełniaka szczeciniastego[5] (chomikowate)[8], nie chorowały także laboratoryjne kawie domowe i króliki. Również u większości małp poza rezusem 766 (badano kotawce zielonosiwe, zwane także koczkodanami zielonosiwymi) nie dopatrzono się objawów choroby, po 2–3 tygodniach od zarażenia wykrywano u nich przeciwciała odpornościowe. Niekiedy obserwowano nieznaczne podwyższenie temperatury ciała[5].
Dick przebadał również osocze ludzkie. Nie znalazł żadnych przypadków przeciwciał neutralizujących działanie wirusa, podejrzewał jednak kontakt przebadanych ludzi z wirusem Zika bądź podobnym[5].
W 1948 udało się wyizolować wirusa z komarów Aedes africanus[2], natomiast w 1956 Boorman i Porterfield opisali metodę zainfekowania nim komara Aedes aegypti, z którego ZIKV udało się przenieść powtórnie na małpy[9].
Pierwsze doniesienia o zakażeniu tym wirusem człowieka pochodzą z 1952, kiedy to Smithburn znalazł przeciwciała neutralizujące go w surowicy krwi człowieka z Afryki Wschodniej[10]. W 1954 MacNamara doniósł o trzech przypadkach zachorowania przez człowieka podczas epidemii żółtaczki w Nigerii[11]. W 1964 Simpson opisał jako pierwszy przypadek choroby spowodowanej przez wirusa Zika u człowieka (u siebie samego)[2][12], a kolejny zdarzył się w 1973[13]. W końcu udało się wyizolować tego wirusa również od ludzi. Pisał o tym zespół Moore’a w 1975[14] oraz Fagbami dwa lata później. Oba badania przeprowadzono w Nigerii. Jak wynika z badań Fagbamiego przeprowadzonych w stanie Oyo w latach 1971–1975, znaczna część populacji Nigeryjczyków miała kontakt z wirusem. Test hamowania hemaglutynacji okazał się dodatni u 31% badanej próby. U 40% znaleziono w osoczu przeciwciała neutralizujące wirusa, jednak tylko u 9% z nich były one specyficzne jedynie dla ZIKV, reagowały zazwyczaj też z innymi flawiwirusami. Połowa osób odpornych na ZIKV posiadała przeciwciała monotypowe przeciwko samemu wirusowi bądź też razem z innymi flawiwirusami. Wynika z tego, że nie można utożsamiać odporności na wirusa z przeciwciałami reagującymi krzyżowo na flawiwirusy[10].
W wykonanych niedługo po odkryciu wirusa badaniach serologicznych specyficzne dlań przeciwciała wykryto u 6,1% przebadanej populacji w Ugandzie. Późniejsze badania wykrywały go u ludzi zamieszkujących Afrykę Wschodnią i Zachodnią[1]. Między 1951 a 1981 pojawiły się doniesienia z Ugandy, Tanzanii, Egiptu, Republiki Środkowoafrykańskiej, Sierra Leone i Gabonu[2]. Później do listy dołączył Senegal, na podstawie badań przeprowadzonych między 1988 a 1991, opublikowanych w 1993[15]. Badania serologiczne przeprowadzone w Azji wykryły przeciwciała u ludności Indii, Malezji, Indonezji, Pakistanu, Tajlandii, Wietnamu Północnego i Filipin[1]. Kolejne prace opisywały izolację wirusa z Aedes aegypti w Malezji, w okolicach miasta Bentong[16], komarów na Wybrzeżu Kości Słoniowej[2]. Wskazuje to na szeroki zasięg występowania ZIKV zajmującego tereny od Afryki do Azji Południowo-Wschodniej na północ od linii Wallace’a[1].
W 1981 Olson i współpracownicy opisali kilka przypadków zachorowań w Indonezji[17].
W 2006 zsekwencjonowano genom wirusa[7].
Do 2007 odnotowano mniej niż 10 przypadków zarażenia się tym wirusem u człowieka. W 1977 opisano 7 przypadków z indonezyjskiej Jawy[1]. W kwietniu 2007 wybuchła epidemia w Mikronezji, w stanie Yap[2]. Wirus na wyspę dostał się prawdopodobnie z zawleczonym tam przez człowieka komarem[3]. Pierwsze przypadki odnotowano 15 kwietnia. Donoszono o przypadkach wysypki, bólu i zapalenia stawów, zapalenia spojówek, poczucia gorączki[7]. Początkowo podejrzewano, że chodzi o wirusa powodującego dengę, choroba przebiegała bowiem podobnie do niej, a znalezione przeciwciała krzyżowo reagowały w teście na dengę[1]. Jednakże w rejonie tym dwukrotnie wcześniej doszło do epidemii tej choroby i lekarze dostrzegli pewne różnice. W czerwcu pobrane próbki wysłano do Centers for Disease Control and Prevention Arbovirus Diagnostic and Reference Laboratory w Fort Collins w amerykańskim stanie Kolorado[7]. Wykonane tam dokładniejsze badania z wykorzystaniem serologii, RT-PCR oraz sekwencjonowania DNA obaliły tę hipotezę, wskazując na wirusa Zika (chociaż jego materiał genetyczny w ok. 11% różnił się od szczepu MR766 wyizolowanego w Ugandzie w 1947, różnice te nie przekładają się na wysoką zmienność w sekwencji aminokwasów, która jest konserwatywna w 96%). Wydaje się, że wcześniejsza infekcja flawiwirusem nasila odpowiedź immunologiczną na ZIKV w klasie IgM[1]. Ostatnie przypadki zachorowań odnotowano 14 lipca. W sumie podczas tej epidemii odnotowano 185 zachorowań o podejrzewanej etiologii ZIKV, udało się ją potwierdzić w 49, co stanowi 26%. W dalszych 59 przypadkach, a więc 32%, ZIKV stanowił prawdopodobny czynnik chorobotwórczy. Daje to wskaźnik 14,6 na 1000 mieszkańców wyspy (zamieszkiwanej przez 7391 osób). Chorujący byli w wieku od 1 roku do 76 lat. Średnia wieku chorujących wyniosła 36 lat. Większość pacjentów (61%) stanowiły kobiety. Wirus częściej atakował osoby starsze niż młodsze. Zespół Duffy’ego zbadał również przeciwciała w kilkusetosobowej próbie mieszkańców wyspy. U prawie ¾ wykryto przeciwciała w klasie IgM (częściej u mężczyzn niż u kobiet), a 38% z tej grupy przyznało, że przeszło chorobę o objawach podobnych do wywoływanych przez ZIKV w czasie epidemii. Na podstawie tych badań oszacowano, że chorobę przeszło około 73% mieszkańców wyspy w wieku od 3 lat wzwyż, jednak tylko u 18% rozwinęły się objawy kliniczne[7]. Był to pierwszy przypadek, kiedy wirusa Zika znaleziono poza Azją bądź Afryką[2]. Nie wydaje się prawdopodobne, by wcześniej był on obecny na wyspie, raczej został nań świeżo zawleczony, być może przez jakiegoś naczelnego niebędącego człowiekiem (zamieszkują one pobliską wyspę Palau). Nic nie wiadomo jednak o przybyciu żadnego z nich na Yap, gdzie poza człowiekiem nie ma żadnych innych naczelnych. Pozostaje więc możliwość, że wirusa przeniósł komar bądź też sam człowiek, być może przybysz z Filipin, gdzie występuje ZIKV i skąd podróże na Yap nie należą do rzadkości[7]. W każdym razie może to oznaczać niebezpieczeństwo dalszego rozprzestrzeniania się go na inne wyspy Pacyfiku oraz Amerykę[2][7].
W 2008 Foy i współpracownicy donieśli o przypadku przeniesienia wirusa z jednego z dwóch wcześniej zaszczepionych przeciwko żółtej gorączce naukowców zarażonych w 2008 na północnym wschodzie Senegalu w okolicy Bandafassi na własną żonę po powrocie do domu, być może na drodze seksualnej[18].
Po epidemii z 2007 w rejonie Pacyfiku aż do 2013 nie było doniesień o nowych zachorowaniach. Pojawiły się one w październiku 2013 w Polinezji Francuskiej. W 2014 w tym kraju wybuchła epidemia, podczas której 11% populacji, czyli 28 tys. osób, szukało pomocy medycznej[19] (dane z lutego 2014[20]). Już wcześniej, gdy na początku roku odnotowano 5895 pacjentów, a całkowitą liczbę chorych szacowano na 19 tys., epidemię okrzyknięto największą spowodowaną przez arbowirusa innego niż wirus dengi w Polinezji Francuskiej[21]. Objawy obejmowały bóle stawów, zapalenia spojówek, wysypkę plamkowo-grudkową, niewysoką gorączkę. W listopadzie odnotowano przypadek zespołu Guillaina-Barrégo[19], opisany przez Oehlera i współpracowników[22]. Stwierdzono też po raz pierwszy przeniesienie wirusa z matki na płód[20]. Wirusa stwierdzono też u dwóch Japończyków wracających z Polinezji Francuskiej. Wyizolowany od jednego z tych pacjentów szczep wirusa przypominał znane z epidemii w Yap w 2007 (97,9% zgodności sekwencji nukleotydów) i ten z Kambodży z 2010 (99,1% zgodności sekwencji nukleotydów). Badania te świadczą o istnieniu grupy szczepów azjatyckich, odrębnych od ZIKV z Afryki[6]. Była to największa jak do tego czasu pory epidemia ZIKV[23]. Ponieważ wcześniej nie stwierdzono potrzeby hospitalizacji spowodowanej przez ZIKV, może to świadczyć o ewolucji wirusa w kierunku większej patogenności bądź o większej podatności podatności populacji Polinezji Francuskiej[22].
W sierpniu 2010 znaleziono wirusa w próbce krwi 3-latka z Kambodży, z prowincji Kampong Speu[24].
Kolejne zachorowania pod koniec 2013 pojawiały się w Nowej Kaledonii, na Wyspach Cooka, na Wyspie Wielkanocnej[19].
W 2015 doniesiono o epidemii w Brazylii[25], która rozpoczęła się na jeszcze pod koniec 2014 na północnym wschodzie kraju, gdzie stwierdzono chorobę przebiegającą z wysypką. Jednakże potwierdzenie etiologii nastąpiło dopiero w kwietniu 2015 wraz z wynikami RT-PCR ze stanów Bahia i Rio Grande do Norte. W styczniu 2016 wirus był już obecny w 22 z 26 jednostek administracyjnych tego kraju i we wszystkich jego 5 regionach[26]. To właśnie w Brazylii ZIKV po raz pierwszy skojarzono z ZIKV małogłowiem[25]. Pierwsze doniesienia napłynęły z północy kraju, ze stanu Pernambuco. Kolejne pochodziły z Paraíba i Rio Grande do Norte. W październiku 2015 brazylijskie ministerstwo zdrowia doniosło o wzroście częstości małogłowia. Do stycznia 2016 odnotowano już 3530 takich przypadków, podczas gdy przed wybuchem epidemii rocznie odnotowywano około 157[26].
W końcu wirus pojawił się w kolejnych państwach: w Ameryce (Barbados[27][28], Boliwia[28], Brazylia[28], Chile[29], Curaçao[30][28], Dominikana[31][28], Ekwador[27][28], Gujana[27][28], Gujana Francuska[32], Gwadelupa[28][33], Gwatemala[32], Haiti[28][32], Honduras[28][32], Jamajka[28], Kolumbia[28][32], Kostaryka[28], Martynika[28][32], Meksyk[28][32], Nikaragua[28], Panama[28][32], Paragwaj[34][32][28], Portoryko[28][32], Saint-Martin[28][33], Salwador[32], Stany Zjednoczone[35], Surinam[36][28][32], Wenezuela[28], Wyspy Dziewicze Stanów Zjednoczonych[28]), na południowym Pacyfiku (Samoa Amerykańskie[28], Samoa[28][37])[25], w Afryce (Republika Zielonego Przylądka[38]) i w Azji (Malediwy[38][28], Tajlandia[28]).
W 2016 pojawiły się zalecenia dla osób zajmujących się ochroną zdrowia dzieci i matek przebywających w czasie ciąży na terenach zajmowanych przez ZIKV[39].
Cykl życiowy
Głównym żywicielem wirusa Zika jest człowiek rozumny[40].
ZIKV przenoszony jest przez komarowate. Znaleziono go u przedstawicieli gatunków Aedes africanus na terenie Afryki oraz Aedes aegypti z Malezji[1]. Nowsze badania pozwoliły znaleźć go także u Aedes apicoargenteus, Aedes luteocephalus, Aedes vitattus i Aedes furcifer[7]. Przenosić może go też Aedes albopictus[40]. Obecnie uznawany jest za najbardziej inwazyjny gatunek komara na świecie. Łatwo dostosowuje się on do różnorodnych warunków środowiskowych. Pochodzi w rzeczywistości z Azji Południowo-Wschodniej. Przez ostatnie 30 lat rozprzestrzenił się jednak w 28 krajach na wszystkich kontynentach oprócz Australii i Antarktydy[41], zaliczają się doń USA[40], a w Europie Albania, Bośnia i Hercegowina, Chorwacja, Czarnogóra, Francja, Grecja, Hiszpania, Słowenia, Szwajcaria, Włochy[41].
Epidemię w Polinezji Francuskiej mogły rozprzestrzeniać też Aedes polynesiensis[21].
Nie znaleziono go natomiast u Aedes hensili, dominującego gatunku komara na wyspie Yap, gdzie wybuchła epidemia w 2007[2]. Wykryto tam w sumie 12 gatunków komarów należących do 4 rodzajów, nie udało się jednak znaleźć u żadnego z nich wirusa, choć Aedes hensili wydawał się prawdopodobnym wektorem[7].
Po sztucznym zarażeniu Aedes aegypti początkowo, po 5–6 dniach, poziomy wirusa były niewielkie, następnie jednak rosły, od dnia 20 do 60 przekraczając małpią LD50 o pięć rzędów wielkości[9]. Czas inkubacji w organizmie owada trwa około 10 dni. Istnieją jednak poważne wątpliwości, czy komary mogą przenosić wirusa Zika na małpy w naturze. W badaniach Dicka komary nie wykazywały tendencji do kąsania trzymanych w klatkach małp[5][2].
W organizmie komara gnanego wiatrem wirus może przebyć nawet kilkaset kilometrów nad oceanem, choć w jego przenoszeniu rolę odgrywać też mogą pacjenci z wiremią[3].
Hayes nie zna żadnych rezerwuarów wirusa Zika poza naczelnymi, choć wymienia pojedyncze badanie stwierdzające go u gryzoni[2] – pracę autorstwa Darwisha et al opisującą badania przeprowadzone w Pakistanie[42]. Z drugiej strony przeciwciała reagujące z antygenami ZIKV znaleziono również u innych zwierząt, wśród których wymieniane są wół domowy, koza, owca, gnu, impala zwyczajna, bawolec krowi, hipopotamowate, zebry, słoniowate, lew afrykański, a także gryzonie[3].
Doniesienie o przeniesieniu wirusa przez naukowca na jego żonę w Kolorado sugeruje drogę seksualną (przez nasienie). W każdym razie wirus potrafi przenosić się bezpośrednio z człowieka na człowieka. Na tym obszarze występują pospolicie tylko komary z podrodzaju Aedimorphus (Aedes vexans), a ponadto Culex i Culiseta, podczas gdy wektory ZIKV zaliczają się do podrodzaju Stegomyia[18].
Ponadto wirus może przenosić się drogą perynatalną[19].
Nie ma informacji o przenoszeniu się ZIKV poprzez przetaczane preparaty krwiopochodne, chociaż mogą się w ten sposób przenosić inne flawiwirusy[23] (np. wirus Zachodniego Nilu[43]). W celu zminimalizowania potencjalnego ryzyka przeniesienia wirusa poprzez krew, wprowadzono dla dawców z Polinezji Francuskiej badania przesiewowe, w których 2,8% bezobjawowych dawców okazało się pozytywnych[19][23].
Informacje na temat patogenezy związanej z infekcją ZIKV są skąpe. Bazuje się tutaj na podobieństwach z innymi flawiwirusami. Hayes uważa, że wirus Zika namnaża się już w komórkach dendrytycznych w pobliżu miejsca, gdzie dostał się do organizmu człowieka. Następnie dostaje się do węzłów chłonnych. Jeszcze później powoduje wiremię (wykrywaną już w dniu pojawienia się choroby i przez następne 11 dni)[2]. Uczony odwołuje się tutaj do patomechanizmu choroby spowodowanej wirusem Zachodniego Nilu, również powodującej neuroinfekcję[44]. Zagadkowy jest również przedział w obrębie komórki zajmowany przez wirusa[2]. O ile bowiem flawiwirusy zajmują zazwyczaj cytoplazmę, to ZIKV znaleziony został przez Buckleya i Goulda w 1988 jedynie w jądrze[45].
Czynniki ryzyka
Zespół Duffy’ego po zbadaniu epidemii na wyspie Yap stwierdził brak środowiskowych lub behawioralnych czynników ryzyka[7].
Profilaktyka
Profilaktyka chorób wirusowych przenoszonych przez komary obejmuje likwidację zbiorników z wodą, a także zabijanie larw komarów, zanim jeszcze rozpocznie się okres ich pojawu, jak też zabijanie osobników dorosłych. W przypadku wybuchu epidemii konieczne jest połączenie różnych metod[40].
Zaleca się, aby kobiety w ciąży nie podróżowały do rejonów, gdzie występują zakażenia wirusem Zika. Kobieta, po powrocie z takiego rejonu, jeżeli planuje zajście w ciążę, powinna wstrzymać się, aż upłynie okres ponad 8 tygodni.
U mężczyzn zakażonych wirusem Zika lub po powrocie z regionów zachorowań zaleca się przy stosunkach płciowych używanie prezerwatyw przez okres 6 miesięcy[46]
Szczególnie kobietom ciężarnym zaleca się unikanie ukąszeń przez komary poprzez odpowiedni ubiór (długie rękawy i spodnie), stosowanie repelentów oraz zabezpieczenie pomieszczeń przez ekrany bądź sieci powstrzymujące owady przed wtargnięciem[26].
Podczas epidemii w Polinezji Francuskiej wprowadzono badania krwi mające wykluczyć infekcję ZIKV u potencjalnych dawców. Próbki badano pod kątem obecności kwasów nukleinowych wirusa metodą RT-PCR. Przebadano wtedy 1505 dawców. U 42 z nich (2,8%) wynik był dodatni, co autorzy określili jako „niespodziewanie wysoką liczbę”. Po skontaktowaniu się z dodatnimi dawcami 11 z nich potwierdziło obecność objawów od 3 do 11 dni przed oddaniem krwi. Uzyskane wyniki wskazują na konieczność badania próbek krwi pod tym kątem, jak również na konieczność opracowania planów zagwarantowania dostępności bezpiecznej krwi w razie epidemii na terenach występowania Aedes[23].
Objawy
W trzech czwartych[25] do czterech piątych zachorowań zakażenie przebiega bezobjawowo[39].
Gorączka Zika
Jeśli już pojawią się objawy, są one zazwyczaj łagodne[25]. Okres wylęgania choroby wynosi przynajmniej 9 dni[18]. Objawy trwają zwykle od 2 do 7 dni[25]. Choroba cechuje się zwykle przebiegiem samoograniczającym[6], przypominającym grypę[22].
U człowieka ZIKV powoduje chorobę przebiegającą ze złym samopoczuciem, gorączką[1], wedle pierwszego opisu Simpsona z 1964 łagodną i krótko trwającą[12], wedle nowszych opisów wysoką[17], bólem i zawrotami głowy, bólem brzucha, brakiem apetytu oraz wysypką plamisto-grudkową. Zazwyczaj cechuje się ona łagodnym, samoograniczającym się przebiegiem[1]. Wedle opisu Simpsona najpierw pojawia się łagodny ból głowy. Następnego dnia pojawia się wysypka plamisto-grudkowa obejmująca twarz, szyję, tułów, kończyny górne – najpierw ramiona, potem dłonie i podeszwy stóp. Odnotowano pojawienie się złego samopoczucia, gorączki utrzymującej się do wieczora drugiego dnia choroby, bólu pleców. Wysypka również zaczęła zanikać drugiego wieczora, co zabrało jej jeszcze 2 dni – była więc najdłużej utrzymującym się objawem[2][12]. Natomiast wedle opisu Filipe i współpracowników (pacjent, przedtem zaszczepiony przeciwko gorączce żółtej, również był naukowcem i zaraził się podczas pracy laboratoryjnej) w przebiegu choroby szybko pojawia się gorączka do 38 °C z towarzyszącymi potami, bólem w okolicy zaoczodołowej, bólami szyi i stawów. Drugiego dnia temperatura spadła do 37,5 °C, by podnieść się w nocy do 38,3 °C. Objawy utrzymywały się do trzeciego dnia, po czym zaczęły ustępować. Powrót do zdrowia trwał tydzień. Co istotne, nie zaobserwowano wysypki[13]. Z kolei u naukowca zarażonego przez ukąszenie komara w Senegalu w 2008 początkowe objawy obejmowały obrzęk w okolicy kostek, wysypkę plamisto-grudkową na tułowiu, ból głowy i znaczne uczucie zmęczenia. Gorączka nie wystąpiła. Drugiego dnia dołączyły oszołomienie i dreszcze, a także bóle nadgarstków i stawów skokowych. Ponadto doszło do zapalenia prostaty objawiającego się dyzurią i bólem krocza. Trzeciego dnia złagodzeniu uległy wysypka i uczucie zmęczenia. Czwartego dnia zaobserwowano pojawienie się dwóch aftowatych owrzodzeń na wargach. Piątego dnia wystąpiła hematospermia, utrzymująca się odtąd przez 4 dni. Objawy utrzymywały się 6–9 dni po powrocie. U innego zarażonego choroba przebiegała podobnie, z tym że objawy stawowe dotyczyły także kolan. Piątego dnia od wystąpienia objawów u opisywanego pacjenta choroba ujawniła się u jego żony, prawdopodobnie wirus przeniósł się bezpośrednio, drogą seksualną. Wystąpiły u niej dreszcze, złe samopoczucie, ból głowy i mięśni, światłowstręt. Objawy te trwały 3 dni. Również nie doszło do gorączki. 5 dnia od zachorowania u kobiety pojawiła się wysypka na tułowiu, która następnego dnia rozprzestrzeniła się na szyję i biodra. Zaobserwowano również aftowate owrzodzenia warg. 6 dnia pojawiły się zmiany stawowe (nadgarstek, kciuk) i zapalenie spojówek. U jednego z chorych bóle nadgarstka utrzymywały się przez miesiąc, u pozostałych nawracały po ostrej fazie choroby[18].
Inaczej przedstawiały się zachorowania podczas epidemii w 2007. Odnotowano wysypkę, zapalenie spojówek, ból stawów[1], ból mięśni, obrzęk, wymioty[2][7]. Wiremię określono jako niską, choć nie przeprowadzono dokładniejszych pomiarów. Przy założeniu 200–500 cząsteczek DNA na wirion wiremię oszacowano na od 2 do 3,5 tysiąca wirionów na ml[1]. Doniesienie z Kambodży mówi też o bólu gardła i kaszlu[24].
Wobec tego typowy przebieg choroby opisuje się jako chorobę grypopodobną z niewysoką gorączką (zazwyczaj 37,8–38,5 °C), z bólami stawów, zwłaszcza niewielkich stawów dłoni i stóp, niekiedy z obrzękiem stawów, z bólami mięśni i głowy, zwłaszcza zaoczodołowymi, z zapaleniem spojówek oraz wysypką z grudkami i plamkami[22], z uczuciem zmęczenia[24], rzadziej ze świądem i objawami z układu pokarmowego, do których zaliczają się ból brzucha, zaparcia, biegunka, afty[22].
Kutsuna i inni (2014) prócz leukopenii zwrócili uwagę na trombocytopenię, którą stwierdzili w tej chorobie po raz pierwszy[6].
Wirus Zika a ciąża
Dwa pierwsze udokumentowane przypadki wertykalnego przeniesienia wirusa Zika odnotowano podczas epidemii w Polinezji Francuskiej w grudniu 2013 i lutym 2014. Pierwsza z matek nawet nie gorączkowała, zaobserwowano jedynie swędzącą wysypkę, która pojawiła się na 2 dni przed porodem. W drugim przypadku matka w 5. dekadzie życia z cukrzycą ciążową urodziła noworodka z hipotrofią. Dopiero trzeciego dnia połogu rozwinęła łagodną gorączkę, swędzącą wysypkę i bóle mięśniowe. Wysypka pojawiła się również u dziecka, dołączyła do niej trombocytopenia. Pierwsze dziecko pozostało bezobjawowe. W obu przypadkach przebieg choroby był pomyślny. Rozważano transfer przezłożyskowy, podczas porodu, z mlekiem matki (gdzie również wykryto wirusa w stężeniu 2,9 × 104 i 205 × 104 cząsteczek RNA na ml, jednak w opisywanych przypadkach badania serologiczne nie wskazują na tę drogę)[20].
Pojawiły się też doniesienia wiążące infekcję ZIKV u ciężarnej z wrodzonym małogłowiem[25]. Podczas epidemii w Brazylii odnotowano zwiększenie liczby stwierdzanych przypadków małogłowia. Może do niego dochodzić zwłaszcza jeśli infekcja ZIKV wystąpiła na początku ciąży, w pierwszym trymestrze. W badaniach autorstwa Kleber de Oliveira et al. obejmujących 574 przypadki małogłowia 58,5% dzieci z mikrocefalią było dziewczynkami. Średni obwód głowy wyniósł 28 cm. Ponadto w 15 stanach objętych epidemią małogłowie występowało 2,80 na 10000 porodów, podczas gdy w stanach, gdzie nie potwierdzono kontaktu matek z wirusem, wartość ta wynosiła 0,60 na 10000. Najwyższy wynik pochodził ze stanu Pernambuco: 14,62. Odnotowywano tam do 4 noworodków z małogłowiem tygodniowo. Opisany w ten sposób związek ma jedynie charakter czasowy. Wykonano wobec tego badania mające za zadanie uprawdopodobnić hipotezę o wywoływaniu mikrocefalii przez wirus Zika. Od ciężarnych z Paraíba, u płodów których ultrasonograficznie wykazano mikrocefalię i zwapnienia w obrębie mózgowia, pobrano próbki płynu owodniowego. Następnie za pomocą RT-PCR udało się w nich zidentyfikować RNA wirusa. Później udało się także znaleźć wirusa w tkankach noworodków z małogłowiem, który zmarł niedługo po przyjściu na świat. Powiązania pomiędzy ZIKV a mikrocefalią wymagają jednakże dalszych badań, chociaż mówi się obecnie o zasadności unikania ukąszeń komarów przez ciężarne kobiety na terenie występowania wirusa[26].
Zespół Guillaina-Barrégo
Inne doniesienia łączą ZIKV z zespołem Guillaina-Barrégo[19]. Pierwszy taki przypadek (i w ogóle pierwszy przypadek, kiedy to leczenie zakażenia ZIKV wymagało hospitalizacji) opisał zespół Oehlera u kobiety na początku piątej dekady życia, która zachorowała w październiku 2013 w Polinezji Francuskiej. Pierwszym objawem neurologicznym były parestezje wszystkich kończyn. Po upływie doby pojawiło się osłabienie mięśni, a po trzech – tetrapareza bardziej nasilona na kończynach dolnych. Towarzyszyły jej rozlane bóle mięśniowe i asymetryczne porażenie twarzy, jak też brak głębokich odruchów ścięgnistych. Ponadto obecne były tachykardia, hipotensja ortostatyczna. EMG potwierdziło rozlaną demielinizację[22].
Histopatologia
W badaniach Dicka z 1952 wirusa udało się wykryć jedynie w mózgu zakażonych myszy, pomimo zbadania licznych innych narządów wewnętrznych. Zaobserwowano degenerację neuronów. W ich obrębie znaleziono ciałka Cowdry’ego typu A[5].
Zmiany zapalne błon czy ependymy były minimalne[5].
Rozpoznanie
Diagnostyka ZIKV opiera się na rozpoznaniu RNA wirusa za pomocą PCR lub poprzez stwierdzenie obecności swoistych przeciwciał skierowanych przeciw wirusowi za pomocą testu ELISA. Natomiast przeciwciała neutralizujące można wykryć dopiero od 5 dnia choroby. Badanie z wykorzystaniem PCR jest skuteczne, gdy bada się materiał pobrany przed 10. dniem choroby[2].
Jeśli ciężarna przebywała na terenie bytności wirusa ZIKV, zaleca się przeprowadzenie nie tylko badań matki, ale też płodu (USG)[39]. Badania w kierunku wirusa należy przeprowadzić także u dzieci[39]:
- z mikrocefalią bądź kalcyfikacjami wewnątrzczaszkowymi matek podróżujących na tereny zagrażające zarażeniem się podczas ciąży,
- matek o dodatnim bądź niediagnostycznym wyniku testu na infekcję ZIKV.
Chorobę wywoływaną przez wirusa Zika łatwo pomylić z dengą, chikungunyą oraz innymi chorobami wirusowymi przebiegającymi z wysypką i gorączką[25]. Jednakże zarówno denga, jak i chikungunya znane są lekarzom terenów endemicznych, a testy potwierdzające ich diagnozy wykonują liczne laboratoria. Natomiast gorączka Zika pozostaje chorobą mało znaną i tylko nieliczne ośrodki prowadzą diagnostykę w jej kierunku[3].
Leczenie
Nie opracowano skutecznego specyficznego leczenia przeciwwirusowego ZIKV ani żadnej skutecznej szczepionki przeciw wirusowi[47]. Leczenie choroby jest wyłącznie objawowe i obejmuje leczenie przeciwgorączkowe, przeciwbólowe, podawanie płynów i odpoczynek. Leczenie zakażenia wrodzonego również jest objawowe i opiera się na leczeniu stwierdzonych zaburzeń neurorozwojowych[39][48]. Brak specyficznego leczenia, jednak w łagodzeniu objawów pomocny może być paracetamol (acetaminofen)[47]. Pobyt w szpitalu rzadko bywa konieczny[49].
Zespół Guillaina-Barrégo w przebiegu zakażenia ZIKV leczy się immunoglobulinami dożylnie[22].
Przypisy
- ↑ a b c d e f g h i j k l m n o p q r s Robert S. Lanciotti, Olga L. Kosoy, Janeen J. Laven, Jason O. Velez, Amy J. Lambert, Alison J. Johnson, Stephanie M. Stanfield & Mark R. Duffy. Genetic and Serologic Properties of Zika Virus Associated with an Epidemic, Yap State, Micronesia, 2007. „Emerging Infectious Diseases”. 14 (8), s. 1232–1239, 2008. DOI: 10.3201/eid1408.080287. PMID: 18680646. PMCID: PMC2600394. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t Edward B. Hayes. Zika Virus Outside Africa. „Emerging Infectious Diseases”. 15, s. 1347–1350, 2009. DOI: 10.3201/eid1509.090442. PMID: 19788800. PMCID: PMC2819875. (ang.).
- ↑ a b c d e f g h i j k l Andrew D. Haddow, Amy J. Schuh, Chadwick Y. Yasuda, Matthew R. Kasper, Vireak Heang, Rekol Huy, Hilda Guzman, Robert B. Tesh & Scott C. Weaver. Genetic Characterization of Zika Virus Strains: Geographic Expansion of the Asian Lineage. „PloS Neglected Tropical Diseases”. 6, s. e1477, 2012. DOI: 10.1371/journal.pntd.0001477. (ang.).
- ↑ a b c d e Kuno G & Chang GJ. Full-length sequencing and genomic characterization of Bagaza, Kedougou, and Zika viruses. „Archives of Virology”. 152, s. 687–696, 2007. Springer. (ang.).
- ↑ a b c d e f g h i j k l G.W. Dick. Zika virus. II. Pathogenicity and physical properties. „Transaction of the Royal Society of Tropical Medicine and Hygiene”. 46 (5), s. 521–534, 1952. DOI: 10.1016/0035-9203(52)90043-6. PMID: 12995441.
- ↑ a b c d S Kutsuna, Y Kato, T Takasaki, M L Moi, A Kotaki, H Uemura, T Matono, Y Fujiya, M Mawatari, N Takeshita, K Hayakawa, S Kanagawa & N Ohmagari. Two cases of Zika fever imported from French Polynesia to Japan, December 2013 to January 2014. „Eurosurveillance”. 19, s. 20683, 2014. (ang.).
- ↑ a b c d e f g h i j k Mark R. Duffy, D.V.M., M.P.H., Tai-Ho Chen, M.D., W. Thane Hancock, M.D., M.P.H., Ann M. Powers, Ph.D., Jacob L. Kool, M.D., Ph.D., Robert S. Lanciotti, Ph.D., Moses Pretrick, B.S., Maria Marfel, B.S., Stacey Holzbauer, D.V.M., M.P.H., Christine Dubray, M.D., M.P.H., Laurent Guillaumot, M.S., Anne Griggs, M.P.H., Martin Bel, M.D., Amy J. Lambert, M.S., Janeen Laven, B.S., Olga Kosoy, M.S., Amanda Panella, M.P.H., Brad J. Biggerstaff, Ph.D., Marc Fischer, M.D., M.P.H. & Edward B. Hayes, M.D. Zika Virus Outbreak on Yap Island, Federated States of Micronesia. „The New England Journal of Medicine”. 360 (24), s. 2536–2543, 2009. DOI: 10.1056/NEJMoa0805715. PMID: 19516034. (ang.).
- ↑ Włodzimierz Cichocki, Agnieszka Ważna, Jan Cichocki, Ewa Rajska, Artur Jasiński, Wiesław Bogdanowicz: Polskie nazewnictwo ssaków świata. Warszawa: Muzeum i Instytut Zoologii Polskiej Akademii Nauk, 2015, s. 297. ISBN 978-83-88147-15-9.
- ↑ a b J.P.T Boorman & J.S Porterfield. A simple technique for infection of mosquitoes with viruses transmission of zika virus. „Transactions of the Royal Society of Tropical Medicine and Hygiene”. 50 (3), s. 238–242, 1956. Elsevier. DOI: 10.1016/0035-9203(56)90029-3. PMID: 13337908. (ang.).
- ↑ a b Fagbami A. Epidemiological investigations on arbovirus infections at Igbo-Ora, Nigeria. „Tropical and Geographical Medicine”. 29 (2), s. 187–191, 1977. PMID: 906078. (ang.).
- ↑ F.N MacNamara. Zika virus: A report on three cases of human infection during an epidemic of jaundice in Nigeria. „Transactions of the Royal Society of Tropical Medicine and Hygiene”. 48 (2), s. 139–145, 1954. Elsevier. DOI: 10.1016/0035-9203(54)90006-1. PMID: 13157159. (ang.).
- ↑ a b c D.I.H. Simpson. Zika virus infection in man. „Transactions of the Royal Society of Tropical Medicine and Hygiene”. 58 (4), s. 335–338, 1964. Elsevier. DOI: 10.1016/0035-9203(64)90200-7. PMID: 14175744. (ang.).
- ↑ a b Filipe AR, Martins CM, Rocha H. Laboratory infection with Zika virus after vaccination against yellow fever. „Arch Gesamte Virusforsch”. 43 (4), s. 315–319, 1973. DOI: 10.1007/BF01556147. PMID: 4799154. (ang.).
- ↑ Moore DL, Causey OR, Carey DE, Reddy S, Cooke AR, Akinkugbe FM, David-West TS, Kemp GE. Arthropod-borne viral infections of man in Nigeria. „Annals of Tropical Medicine and Parasitology”. 69 (1), s. 49–64, 1975. PMID: 124969. (ang.).
- ↑ Monlun E, Zeller H, Le Guenno B, Traoré-Lamizana M, Hervy JP, Adam F, Ferrara L, Fontenille D, Sylla R, Mondo M, et al. Surveillance of the circulation of arbovirus of medical interest in the region of eastern Senegal. „Bulletin de la Société deogie Pathol Exotique”. 86 (1), s. 21–28, 1993. PMID: 8099299. (ang.).
- ↑ Marchette NJ, Garcia R, Rudnick A. Isolation of Zika virus from Aedes aegypti mosquitoes in Malaysia. „The Americal Journal of Tropical Medicine and Hygiene”. 18 (3), s. 411–415, 1969. PMID: 4976739. (ang.).
- ↑ a b Olson JG, Ksiazek TG, Suhandiman, Triwibowo. Zika virus, a cause of fever in Central Java, Indonesia. „Transactions of the Royal Society of Tropical Medicine and Hygiene”. 75 (3), s. 389–393, 1981. DOI: 10.1016/0035-9203(81)90100-0. PMID: 6275577. (ang.).
- ↑ a b c d Brian D. Foy, Kevin C. Kobylinski, Joy L. Chilson Foy, Bradley J. Blitvich, Amelia Travassos da Rosa, Andrew D. Haddow, Robert S. Lanciotti & Robert B. Tesh. Probable Non–Vector-borne Transmission of Zika Virus, Colorado, USA. „Emerging Infectious Diseases”. 17 (5), s. 880–882, 2011. DOI: 10.3201/eid1705.101939. PMID: 21529401. PMCID: PMC3321795. (ang.).
- ↑ a b c d e f D. Musso, E.J. Nilles & V.-M. Cao-Lormeau. Rapid spread of emerging Zika virus in the Pacific area. „Clinical Microbiology and Infection”. 20, s. O595-O596, 2014. Wiley Online Library. DOI: 10.1111/1469-0691.12707. (ang.).
- ↑ a b c M Besnard, S Lastère, A Teissier, V M Cao-Lormeau & D Musso. Evidence of perinatal transmission of Zika virus, French Polynesia, December 2013 and February 2014. „Eurosurveillance”. 19, 2014. (ang.).
- ↑ a b Cao-Lormeau VM, Roche C, Teissier A. Zika virus, French Polynesia, South Pacific, 2013. „Emerging Infectious Diseases”. 20, s. 1084–1086, 2014. CDC. (ang.).
- ↑ a b c d e f g E Oehler, L Watrin, P Larre, I Leparc-Goffart, S Lastère, F Valour, L Baudouin, H P Mallet, D Musso & F Ghawche. Zika virus infection complicated by Guillain-Barré syndrome – case report, French Polynesia, December 2013. „Eurosurveillance”. 19, s. 20720, 2014. (ang.).
- ↑ a b c d D Musso, T Nhan, E Robin, C Roche, D Bierlaire, K Zisou, A Shan Yan, V M Cao-Lormeau & J Broult. Potential for Zika virus transmission through blood transfusion demonstrated during an outbreak in French Polynesia, November 2013 to February 2014. „Eurosurveilance”. 19, s. 20761, 2014. (ang.).
- ↑ a b c Heang, V., Yasuda, C. Y., Sovann, L., Haddow, A. D., Travassos da Rosa, A. P., Tesh, R. B., & Kasper, M. R. Zika virus infection, Cambodia, 2010. „Emerging Infectious Diseases”. 18, s. 349–351, 2012. CDC. (ang.).
- ↑ a b c d e f g h European Centre for Disease Prevention and Control: Zika virus epidemic in the Americas: potential association with microcephaly and Guillain-Barré syndrome. 2015. [dostęp 2016-01-31]. [zarchiwizowane z tego adresu (2016-02-12)]. (ang.).
- ↑ a b c d Wanderson Kleber de Oliveira, Juan Cortez-Escalante, Wanessa Tenório Gonçalves Holanda De Oliveira, Greice Madeleine Ikeda do Carmo, Cláudio Maierovitch Pessanha Henriques, Giovanini Evelim Coelho & Giovanny Vinícius Araújo de França. Increase in Reported Prevalence of Microcephaly in Infants Born to Women Living in Areas with Confirmed Zika Virus Transmission During the First Trimester of Pregnancy – Brazil, 2015.. „MMWR Morb Mortal Wkly Rep.”. 65, s. 242–247, 2016. DOI: 10.15585/mmwr.mm6509e2. (ang.).
- ↑ a b c World Health Organization: Zika virus infection – Guyana, Barbados and Ecuador. 2016-01-20. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa World Health Organization: Zika situation report. 2016-02-12.
- ↑ Ministry of Health of Chile: Recomendaciones por Virus Zika. 2016-01-25. (hiszp.).
- ↑ Countries and territories with Zika autochthonous transmission in the Americas. Regional Office for the Americas of the World Health Organization, 2016-02-01. (ang.).
- ↑ World Health Organization: Zika virus infection – Dominican Republic. 2016-01-27. (ang.).
- ↑ a b c d e f g h i j k l Centers for Disease Control and Prevention: CDC Issues Zika Travel Alert. 2016-01-15.
- ↑ a b World Health Organization: Zika virus infection – France – Saint Martin and Guadeloupe. 2016-01-26.
- ↑ World Health Organization: Zika virus infection – Paraguay. 2015-12-03.
- ↑ World Health Organization: Zika virus infection – United States of America. 2016-02-12.
- ↑ World Health Organization: Zika virus infection – Suriname. 2015-11-15.
- ↑ European Centre for Disease Prevention and Control: Countries with local Zika transmission. 2016-02-05.
- ↑ a b World Health Organization: Neurological Syndrome and Congenital Anomalies. [w:] Zika Situation Report [on-line]. 2016-02-05. (ang.).
- ↑ a b c d e J.E. Staples, E.J. Dziuban, M. Fischer, J.D. Cragan i inni. Interim Guidelines for the Evaluation and Testing of Infants with Possible Congenital Zika Virus Infection – United States, 2016. „MMWR Morb Mortal Wkly Rep”. 65 (3), s. 63–67, 2016. DOI: 10.15585/mmwr.mm6503e3. PMID: 26820387. [zarchiwizowane z adresu].
- ↑ a b c d Centers for Disease Control and Prevention: Surveillance and Control of Aedes aegypti and Aedes albopictus in the United States. U.S. Department of Health & Human Services. [dostęp 2016-01-31]. (ang.).
- ↑ a b Giuliano Gasperi, Romeo Bellini, Anna R. Malacrida, Andrea Crisanti, Michele Dottori & Serap Aksoy. A New Threat Looming over the Mediterranean Basin: Emergence of Viral Diseases Transmitted by Aedes albopictus Mosquitoes. „PloS Neglected Tropical Diseases”. 6, s. e1836, 2012. DOI: 10.1371/journal.pntd.0001836. (ang.).
- ↑ Darwish MA, Hoogstraal H, Roberts TJ, Ahmed IP, Omar F. A sero-epidemiological survey for certain arboviruses (Togaviridae) in Pakistan. „Transactions of the Royal Society of Tropical Medicine and Hygiene”. 77 (4), s. 442–445, 1983. DOI: 10.1016/0035-9203(83)90106-2. PMID: 6314612. (ang.).
- ↑ L. R. Petersen & M. P. Busch. Transfusion-transmitted arboviruses. „Vox Sanguinis”. 98, s. 495–503, 2010. Wiley Online Library. DOI: 10.1111/j.1423-0410.2009.01286.x. (ang.).
- ↑ Diamond MS, Shrestha B, Mehlhop E, Sitati E & Engle M. Innate and adaptive immune responses determine protection against disseminated infection by West Nile encephalitis virus. „Viral Immunology”. 16 (3), s. 259–278, 2003. DOI: 10.1089/088282403322396082. PMID: 14583143. (ang.).
- ↑ Buckley A & Gould EA. Detection of virus-specific antigen in the nuclei or nucleoli of cells infected with Zika or Langat virus. „Journal of General Virology”. 69, s. 1913–1920, 1988. DOI: 10.1099/0022-1317-69-8-1913. PMID: 2841406. (ang.).
- ↑ Interna – mp.pl: Zika. [w:] Zika [on-line]. 2016, 2016. [dostęp 2016-12-30]. (pol.).
- ↑ a b Chen LR, Hammer DH. Zika Virus: Rapid Spread in the Western Hemisphere. „Annals of internal medicine”, 2016. PMID: 26832396. (ang.).
- ↑ E.E. Petersen, J.E. Staples, D. Meaney-Delman, M. Fischer i inni. Interim Guidelines for Pregnant Women During a Zika Virus Outbreak – United States, 2016. „MMWR Morb Mortal Wkly Rep”. 65 (2), s. 30–33, 2016. DOI: 10.15585/mmwr.mm6502e1. PMID: 26796813. [zarchiwizowane z adresu].
- ↑ Factsheet for health professionals. ecdc.europa.eu, 2015-12-22.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Moritz UG Kraemer, Marianne E Sinka, Kirsten A Duda, Adrian QN Mylne, Freya M Shearer, Christopher M Barker, Chester G Moore, Roberta G Carvalho, Giovanini E Coelho, Wim Van Bortel, Guy Hendrickx, Francis Schaffner, Iqbal RF Elyazar, Hwa-Jen Teng, Oliver J Brady, Jane P Messina, David M Pigott, Thomas W Scott, David L Smith, GR William Wint, Nick Golding, Simon I Hay, Licencja: CC0
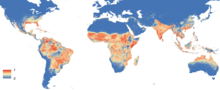
Global map of the predicted distribution of Aedes aegypti in 2015.
The map depicts the probability of occurrence (from 0 blue to 1 red) at a spatial resolution of 5 km × 5 km.
Aedes aegypti , one of the transmitters Zika virus
Autor: Manuel Almagro Rivas, Licencja: CC BY-SA 4.0
Zika virus capsid, colored per chains.
Source: Sirohi, D., Chen, Z., Sun, L., Klose, T., Pierson, T., Rossmann, M. and Kuhn, R. (2016). The 3.8Å resolution cryo-EM structure of Zika virus. DOI: 10.2210/pdb5ire/pdb Available at: http://www.rcsb.org/pdb/explore/explore.do?structureId=5IRE [Checked on 3 Apr. 2016]
Image created using QuteMol and GIMP.Map of reported transmission of Zika virus as of February 3, 2016.








